 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Биологические функцииСейчас выделяют следующие функции: 1. Опсонизирующая функция. Сразу вслед за активацией системы комплемента образуются опсонизирующие компоненты, которые покрывают патогенные организмы или иммунные комплексы, привлекая фагоцитов. Наличие на поверхности фагоцитирующих клеток рецептора к С3b усиливает их прикрепление к опсонизированным бактериям и активирует процесс поглощения. Такое более тесное прикрепление С3b-связанных клеток или иммунных комплексов к фагоцитирующим клеткам получило название феномена иммунного прикрепления. 2. Солюбилизация (т.е. растворение) иммунных комплексов (молекулой C3b). При недостаточности комплемента развивается иммунокомплексная патология (СКВ-подобные состояния). [СКВ = системная красная волчанка] 3. Участие в воспалительных реакциях. Активация системы комплемента приводит к выделению из тканевых базофилов (тучных клеток) и базофильных гранулоцитов крови биологически активных веществ (гистамина, серотонина, брадикинина), которые стимулируют воспалительную реакцию (медиаторов воспаления). Биологически активные компоненты, которые образуются при расщеплении С3 и С5, приводят к высвобождению вазоактивных аминов, таких как гистамин, из тканевых базофилов (тучных клеток) и базофильных гранулоцитов крови. В свою очередь это сопровождается расслаблением гладкой мускулатуры и сокращением клеток эндотелия капилляров, усилением сосудистой проницаемости. Фрагмент С5аи другие продукты активации комплемента содействуют хемотаксису, агрегации и дегрануляции нейтрофилов и образованию свободных радикалов кислорода. Введение С5а животным приводило к артериальной гипотонии, сужению легочных сосудов и повышению проницаемости сосудов из-за повреждения эндотелия. § выступать в роли хемотаксического фактора, вызывая миграцию нейтрофилов по направлению к месту его высвобождения; § индуцировать прикрепление нейтрофилов к эндотелию сосудов и друг к другу; § активировать нейтрофилы, вызывая в них развитие респираторного взрыва и дегрануляцию; § стимулировать продукцию нейтрофилами лейкотриенов. 4. Цитотоксическая, или литическая функция. В конечной стадии активации системы комплемента образуется мембраноатакующий комплекс (МАК) из поздних компонентов комплемента, который атакует мембрану бактериальной или любой другой клетки и разрушает ее. Фактор С3е, образующийся при расщеплении фактора С3b, обладает способностью вызывать миграцию нейтрофилов из костного мозга, и в таком случае быть причиной лейкоцитоза.
10. Фагоцитоз Фагоцитоз представляет собой филогенетически наиболее древнюю иммунную реакцию и является первой реакцией иммунной системы на внедрение чужеродных антигенов, которые могут поступать в организм в составе бактериальных клеток или вирусных частиц, а также в виде высокомолекулярного белка или полисахарида. Макрофаги и моноциты — древние клетки иммунной системы. Последние являются циркулирующими в периферической крови предшественниками макрофагов, функции которых разнообразны и не исчерпываются потребностями иммунной защиты организма. Впервые на защитную функцию макрофагов указал И. И. Мечников, открывший явление фагоцитоза и получивший за это Нобелевскую премию 1908 г. В настоящее время известна другая фундаментальная роль макрофагов — представление этими клетками антигенов лимфоцитам. Без этой функции макрофагов невозможно специфическое распознавание чужеродного антигена. Кроме того, макрофаги являются продуцентами многочисленных медиаторов иммунных реакций (интерлейкины, простагландины), а также белков системы комплемента. Основой эволюционного становления фагоцитоза как иммунологического феномена явилась пищеварительная функция. Предковые одноклеточные организмы поглощали и переваривали чужеродные вещества внешней среды с целью питания. Такой тип питания сохранился у современных протозоа, губок и кишечнополостных. Источником питания, возможно, служили не только неструктурированные вещества, но и прокариоты, среди которых встречается много патогенных микроорганизмов. Несмотря на совершенствование в филогенезе механизмов специфической иммунной защиты, фагоцитарная функция амебоцитов—макрофагов сохранилась в эволюции от одноклеточных до высших многоклеточных, включая млекопитающих. Моноциты. Основой всей моноцитарно—фагоцитарной системы (МФС) является популяция иммунокомпетентных клеток — моноциты. В периферической крови человека в нормальных условиях содержится обычно 0,2—0,8 • 109 этих клеток в 1 л. После недолгого пребывания в крови моноциты мигрируют в ткани, где формируют МФС. Моноциты присутствуют повсюду — в соединительной ткани, вокруг базальных мембран мелких кровеносных сосудов, высокое содержание их обнаруживается в легких (альвеолярные макрофаги) и печени (клетки Купфера). Макрофаги выстилают синусоиды селезенки и медуллярные
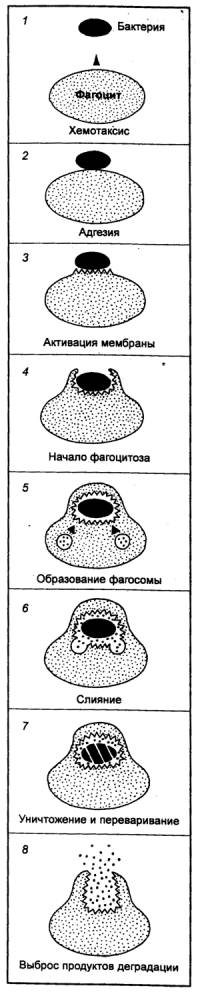
синусы лимфатических узлов. Моноцитарное происхождение имеют мезангиальные клетки почечных клубочков, микроглиальные клетки мозга и остеокласты костной ткани. Моноциты, как правило, мигрируют в ткани диффузно, хаотично. В случае появления клеток, несущих чужеродную информацию, возникает хемотаксический сигнал, направляющий и ускоряющий движение моноцитов из кровотока и окружающих тканей. Макрофаги и некоторые другие клетки МФС живут около 2 месяцев, а некоторые субпопуляции — многие годы. Полагают, что именно этими долгоживущими клетками определяется пожизненная фиксация татуировки и «черное легкое» курильщиков. Внесосудистый пул клеток МФС превышает пул моноцитов циркулирующих в крови, примерно в 25 раз. Наиболее богаты ими печень, легкие, селезенка. Во многих тканях (например, в мышечных) плотность расположения макрофагов исключительно низка. Механизм фагоцитоза однотипен и включает 8 последовательных фаз (рис. 8.6): 1) хемотаксис (направленное движение фагоцита к объекту), 2) адгезия (прикрепление к объекту), 3) активация мембраны (актин—миозиновой системы фагоцита), 4) начало собственно фагоцитоза, связанное с образованием вокруг поглощаемой частицы псевдоподий, 5) образование фагосомы (поглощаемая частица оказывается заключенной в вакуоль благодаря надвиганию на нее плазматической мембраны фагоцита подобно застежке—молнии, 6) слияние фагосомы с лизосомами, 7) уничтожение и переваривание, 8) выброс продуктов деградации из клетки. Фагоцитозу часто предшествует процесс опсонизации (от греч. opsoniazo — снабжать пищей, питать) объекта (клетки, несущей чужеродную информацию). Инициатором этого процесса является образование на поверхности клетки комплекса антиген—антитело. Опсонизация обеспечивается присутствием небольшого количества в организме молекул антител («нормальные антитела»). Антитела, локализующиеся на поверхности чужеродной клетки, стимулируют активацию и присоединение к ним белков системы комплемента. Образовавшийся комплекс действует как активатор остальных стадий фагоцитоза, стимулирует прямо или через посредство других клеток образование веществ, усиливающих эффект опсонизации чужеродной клетки. Хемотаксис. Чужеродные клетки (опсонизированные или неопсонизированные) посылают в окружающую среду хемотаксические сигналы, в направлении которых фагоцит начинает двигаться. В качестве хемотаксических факторов рассматривается целый ряд веществ, в том числе продукты метаболизма микроорганизмов. Считается, что на ранних этапах эволюции каждый из этих факторов действовал самостоятельно. У высших организмов, в том числе у человека, все они действуют в комплексе, последовательно включаясь и усиливая друг друга. Пусковым фактором является комплекс антиген—антитело, определяющий высокую специфичность суммарного хемотаксического сигнала. На этот сигнал приходят первые фагоцитирующие элементы, которые, активируя другие иммунокомпетентные клетки, стимулируют их к выработке медиаторов, усиливающих хемотаксис. Далее хемотаксический потенциал усиливается за счет новообразованных антител, усиления образования комплексов антиген—антитело, а также ряда факторов, образующихся при разрушении макрофагами сосудов и тканей в воспалительном очаге. Этот хемотаксический сигнал второго порядка (развитого очага воспаления) обеспечивает поддержание в нем активной работы за счет поступления новых порций иммунокомпетентных клеток. Достигнув очага воспаления, макрофаг останавливается под влиянием фактора торможения миграции лейкоцитов, вырабатываемого Т—лимфоцитами—хелперами. Исчезновение в очаге воспаления чужеродных антигенов, начало процессов регенерации ведет к резкому уменьшению хемотаксического стимула и появлению продуктов, представляющих собой отрицательный хемотаксический сигнал. В результате этого новые фагоциты перестают мигрировать в воспалительный очаг, а оставшиеся жизнеспособные рассеиваются по всей ткани. Адгезия. Акт адгезии включает две фазы: распознавание чужеродного (специфический процесс) и прикрепление, или собственно адгезию (неспецифический процесс). Адгезия фагоцитирующей клетки к объекту фагоцитоза происходит крайне медленно в том случае, если отсутствует предварительное специфическое распознавание чужеродных клеток. У высших организмов адгезия практически всегда идет с включением специфического компонента. Для активации этого процесса необходимо небольшое количество иммуноглобулинов, которые постоянно присутствуют в организме как нормальные антитела. Захват (собственно фагоцитоз). Важная роль в осуществлении этого этапа фагоцитоза принадлежит специфическим компонентам иммунной реакции. Известно, что захват неопсонизированных частиц идет медленно, причем часть из них вообще не фагоцитируется. Наиболее сильными опсонинами являются иммуноглобулины. Специфичность в осуществлении фагоцитоза появляется в ходе эволюции как надстройка, физиологически связанная с уже имеющейся иммунной системой. В процессе фагоцитоза плазматическая мембрана макрофага при помощи образованных ею выступающих складок захватывает объект фагоцитоза и обволакивает его. Образующаяся при этом небольшая вакуоль называется фагосомой. В дальнейшем фагосома отрывается от поверхности мембраны и перемещается в цитоплазму. Киллинг (убийство). В фагосоме захваченная чужеродная клетка гибнет. Для осуществления киллинга макрофаг продуцирует и секретирует в фагосому реакционноспособные производные кислорода. Переваривание. Последний этап фагоцитоза — переваривание захваченного и убитого материала. Для этого с фагосомой, содержащей объект фагоцитоза, объединяются лизосомы, которые содержат более 25 различных ферментов, в число которых входит большое количество гидролитических энзимов. В фагосоме происходит активация всех этих ферментов, так называемый метаболический взрыв, в результате которого фагоцитированный объект переваривается. Часть молекул антигена при этом разрушается не полностью, их антигенная активность может существенно возрастать. Далее фагосома с остаточным антигеном выбрасывается на поверхность клетки, высвобождая иммуногенный антиген, что имеет важное значение для индукции лимфоцитами специфического иммунного ответа. Нейтрофилы. Главный барьер против микробных инфекций представляют нейтрофилы — популяция лейкоцитов, иначе называемая микрофагами, или микрофагоцитами. Они имеют много общего с другими форменными элементами крови гемопоэтического стволового предшественника. В крови человека нейтрофилы доминируют среди остальных лейкоцитов. Они представляют собой неделящиеся короткоживущие клетки с сегментированным (более зрелые сегментоядерные нейтрофилы) и несегментированным (менее зрелые палочкоядерные нейтрофилы) ядром и набором гранул, различающихся по морфологии, гистогенезу, биохимическому составу, плотности и скорости функциональной мобилизации. Примерно 70% нейтрофилов не циркулируют в крови, а прикреплены к эндотелию сосудов. Главный резервуар пристеночных нейтрофилов — микрососуды легких: число депонированных здесь клеток в несколько раз превосходит количество циркулирующих нейтрофилов. Срок пребывания нейтрофилов в кровотоке составляет около 6,5 ч. Далее нейтрофилы, проникая через эндотелий сосудов, попадают в ткани, где и заканчивают свое существование в течение 3—5 сут, осуществляя свои эффекторные функции, очень похожие на те, которые присущи макрофагам. Значительная часть нейтрофилов приходит к эпителию слизистых оболочек и, проникая через него, заканчивает свой жизненный цикл в слизистом надэпителиальном слое (срок жизни таких нейтрофилов исчисляется часами). У нейтрофилов известны три типа гранул: первичные азурофильные гранулы, содержащие миелопероксидазу, небольшое количество лизоцима и набор катионных белков; вторичные «специфические» гранулы, содержащие лактоферрин, лизоцим и белок, связывающий витамин B12; третичные гранулы (мельчайшие гранулы, или С—частицы), содержащие кислые гидролазы, а также практически всю желатиназную активность нейтрофила. Дегрануляция нейтрофилов может быть истинной, когда гранулы целиком выталкиваются из клетки (экзоцитоз), но чаще из гранул выделяются только растворимые компоненты и имеет место вторичное запустевание гранул (так называемая секреторная дегрануляция). Обширные запасы гликогена, который может быть использован при гликолизе, позволяют нейтрофилам существовать в анаэробных условиях. Основной функцией нейтрофилов является уничтожение чужеродных клеток или веществ биополимерной природы путем фагоцитоза. Эту функцию нейтрофилы осуществляют только после выхода их из сосудистого пула. Процесс фагоцитоза, осуществляемого нейтрофилами, состоит из тех же самых этапов, которые выше описаны для макрофагов. В отличие от макрофагов, нейтрофилы могут фагоцитировать чужеродную клетку или частицу только один раз, после чего они гибнут. Хемотаксис нейтрофилов обусловлен в основном продуктами жизнедеятельности бактерий или денатурированными белками разрушенных клеток собственного организма, т. е. в определенной степени эта стадия фагоцитоза является специфичной. Суммарный хемотаксический эффект усиливается многочисленными факторами разнообразной природы, активирующимися в начале разрушения чужеродного. Сам нейтрофил, будучи активированным в начале фагоцитоза, также выделяет ряд хемотаксических факторов. Благодаря каскадному усилению хемотаксического сигнала к месту разрушения объекта фагоцитоза привлекается большое количество нейтрофилов. Уничтожение чужеродных клеток фагоцитами (макрофагами и нейтрофилами). Антигенная стимуляция резко меняет метаболический профиль фагоцитирующих клеток. К наиболее выраженным сдвигам относится резкое увеличение потребления глюкозы в реакциях гексозомонофосфатного шунта (ГМФШ), генерирующего НАДФ • Н для восстановления молекулярного кислорода на мембранах цитохрома b—245. Если в покоящемся нейтрофиле подобным образом утилизируются лишь 1—2% глюкозы, то стимулированный нейтрофил способен окислить до 30% глюкозы. Одновременно возрастает потребление кислорода и образование оксидантов с мощным энергетическим потенциалом. Этот процесс называют респираторным взрывом. В результате респираторного взрыва образуются мощные бактерицидные агенты: супероксидный анион (О2—), перекись водорода H202), синглетный кислород (1O2), гидроксильные радикалы (ОН—). Сочетание перекиси водорода, миелопероксидазы и ионов галогенов создает мощную систему галогенирования, приводящую к появлению крайне агрессивных вторичных метаболитов: гипохлорной кислоты (НОСl), хлорамина, продуктов перекисного окисления липидов (ПОЛ). Ключевым считается супероксидный анион, с которого берет начало каскад активных форм кислорода и сопряженных с ним феноменов. Избыток энергии реализуется путем выделения тепла, повышенной химической активностью (отсюда высокая биопидность), либо эмиссией квантов света (хемилюминесценция). Кислороднезависимые механизмы. При дисмутации супероксидного аниона потребляются ионы водорода и слегка повышается рН, это создает оптимальные условия для функционирования семейства катионных белков. Эти белки, имеющие высокую изоэлектрическую точку, разрушают бактериальную стенку за счет протеиназного эффекта и за счет непосредственного присоединения к поверхности микроорганизма. Низкие значения рН, устанавливающиеся после слияния фагосомы с лизосомами, лизоцим и лактоферрин представляют собой Кислороднезависимые бактерицидные и бактериостатические факторы, которые могут действовать в анаэробных условиях. Убитые микроорганизмы расщепляются гидролитическими ферментами, и продукты деградации высвобождаются из фагоцитарной клетки. Разные формы реактивности фагоцитов обеспечиваются и проявляются нередко независимо друг от друга. При хроническом грануломатозе макрофаги и нейтрофилы в связи с дефектом цитохромов b—245 не способны образовывать активные метаболиты кислорода. Это сопровождается тем, что бактерии фагоцитируются, но не уничтожаются в клетках. Кроме того, известно, что многие микроорганизмы содержат в большом количестве каталазу и могут легко инактивировать продуцируемую фагоцитами перекись водорода. Фагоциты, дефектные по глюкозо—6—фосфатдегидрогеназе, не способны продуцировать активные метаболиты кислорода и защищать организм от бактериальных инфекций. При синдроме «ленивых лейкоцитов» нарушена реакция нейтрофилов на хемотаксические сигналы.
12. Иммунная система это совокупность органов, тканей и клеток, работа которых направлена непосредственно на защиту организма от различных заболеваний и на истребление уже попавших в организм чужеродных веществ. Данная система является препятствием на пути инфекций (бактериальных, вирусных, грибковых). Когда же в работе иммунной системы происходит сбой, то вероятность развития инфекций возрастает, это также приводит к развитию аутоиммунных заболеваний, в том числе рассеянного склероза. Органы иммунной системы делят на первичные (центральные) и вторичные (периферические). К первичным (центральным) относят вилочковую железу и сумку Фабрициуса, обнаруженную только у птиц. У человека роль сумки Фабрициуса выполняет костный мозг, поставляющий стволовые клетки-предшественники лимфоцитов. Оба центральных органа иммунной системы являются местами дифференцировки популяций лимфоцитов. Вилочковая железа поставляет Т-лимфоциты (тимусзависимые лимфоциты), а в костном мозге образуются В-лимфоциты. К периферическим лимфоидным органам относятся селезенка, лимфатические узлы, миндалины, а также ассоциированная с кишечником и бронхами лимфоидная ткань. К моменту рождения они еще практически не сформированы, поскольку не контактировали с антигенами. Лимфопоэз осуществляется лишь при наличии антигенной стимуляции. Периферические органы иммунной системы заселяются В- и Т-лимфоцитами из центральных органов иммунной системы, причем каждая популяция мигрирует в свою зону - тимусзависимую и тимуснезависимую. После контакта с антигеном в этих органах лимфоциты включаются в рециркуляцию, поэтому ни один антиген не остается незамеченным лимфоцитами. Иммунная система обеспечивает защиту организма от инфекций, а также удаление поврежденных, состарившихся и генетически измененных клеток и молекул собственного организма. Красный костный мозг — центральный орган кроветворения и иммуногенеза. Содержит самоподдерживающуюся популяцию стволовых клеток. Красный костный мозг находится в ячейках губчатого вещества плоских костей и в эпифизах трубчатых костей. Здесь происходит дифференцировка В-лимфоцитов из предшественников. Содержит также Т-лимфоциты. Тимус — центральный орган иммунной системы. В нем происходит дифференцировка Т-лимфоцитов из предшественников, поступающих из красного костного мозга. Лимфатические узлы — периферические органы иммунной системы. Они располагаются по ходу лимфатических сосудов. В каждом узле выделяют корковое и мозговое вещество. В корковом веществе есть В-зависимые зоны и Т-зависимые зоны. В мозговом есть только Т-зависимые зоны. Селезёнка — паренхиматозный зональный орган. Является самым крупным органом иммунной системы, кроме того, выполняет депонирующую функцию по отношению к крови. Селезёнка покрыта капсулой из плотной соединительной ткани, которая содержит гладко-мышечные клетки, позволяющие ей при необходимости сокращаться. Паренхима представлена двумя функционально различными зонами: белой и красной пульпой. Белая пульпа составляет 20 %. Представлена лимфоидной тканью. Здесь имеются В-зависимые и Т-зависимые зоны. И также здесь есть макрофаги. Красная пульпа составляет 80 %. Она выполняет следующие функции: 1. Депонирование зрелых форменных элементов крови. 2. Контроль состояния и разрушения старых и повреждённых эритроцитов и тромбоцитов. 3. Фагоцитоз инородных частиц. 4. Обеспечение дозревания лимфоидных клеток и превращение моноцитов в макрофаги. Кровь и лимфа составляют циркуляторное звено иммунной системы. По кровотоку происходит рециркуляция лимфоцитов и миграция клеток из кроветворных в периферические органы. В лимфу лимфоциты проникают из лимфатических узлов и лимфоидной ткани слизистых оболочек, а из лимфы клетки поступают в кровоток. Таким образом, несмотря на анатомическую разобщенность, отдельные компоненты иммунной системы связаны в единую систему посредством крово- и лимфотока, где происходит постоянный процесс миграции и рециркуляции клеток. Итак, можно сказать, что основной принцип организации иммунной системы органно-циркуляторный. Это означает, что клетки иммунной системы постоянно рециркулируют между органами иммунной системы и нелимфоидными тканями. Такая организация оптимальна для реализации функции иммунологического надзора. Рассматриваемые органы и ткани по принадлежности следует отнести в первую очередь к адаптивной иммунной системе. Нет возможности выделить в качестве самостоятельной ткань или орган врожденной иммунной системы, хотя известно, что огромное число макрофагов сконцентрировано в венозных синусах печени, альвеолах легких и других тканях.
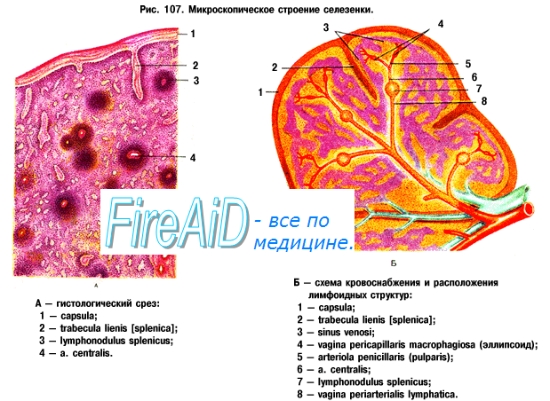
13. Центральными органами иммунной системы называют органы, где происходит формирование и созревание иммуноцитов. К ним относят костный мозг, вилочковую железу (тимус) и сумку Фабрициуса. Периферические органы иммунной системы содержат зрелые лимфоциты. Здесь после антигенного воздействия происходит их дальнейшая пролиферация и дифференцировка, продуцируются антитела и эффекторньш лимфоциты. Сумка Фабрициуса — своеобразный коллектор лимфоидной ткани. Этот орган располагается на задней поверхности клоаки. Удаление у цыплят сумки Фабрициуса приводит к избирательному выключению способности птиц синтезировать антитела, т. е. блокирует В-систему иммунитета. Способность развивать клеточные иммунные реакции (осуществляемые Т-лимфоцитами) при этом полностью сохраняется. тимус, или вилочковая железа, - лимфоэпителиальный орган. Он состоит из долек, каждая из которых содержит корковый и мозговой слой. Клетки-предшественники тимоцитов формируются в костном мозге и через кровь попадают в кору тимуса. Основным элементом коры являются фолликулы Кларка, в которых вокруг приводящего кровеносного сосуда концентрируются эпителиальные и дендритные клетки, макрофаги и лимфоциты. Клетки и их гуморальные продукты (цитокины, гормоны) стимулируют деление незрелых лимфоцитов, поступивших в кору. В процессе деления они созревают. На их поверхности появляются новые структуры, а некоторые стадиоспецифические структуры утрачиваются. Структуры, определяющие особенности клеток иммунной системы, обладают антигенными свойствами. Они получили название «Cluster of differentiation» (показатель дифференцировки) и обозначение CD. Лимфоциты, созревающие в тимусе, - Т-лимфоциты обладают характерными для них молекулами CD2, определяющими их адгезивные свойства и молекулами CD3, являюиимися рецепторами для антигенов. В тимусе Т-лимфоциты дифференцируются на две субпопуляции, содержащие антигены CD4 либо CD8. Лимфоциты CD4 обладают свойствами клеток-помощников - млперов (Тх), лимфоциты CD8 - цитотоксическими свойствами, а также супрессорным эффектом, заключающимся в их способности повалять активность других клеток иммунной системы. За одни сутки в тимусе образуется 300-500 млн. лимфоцитов. При тгом на клетках формируются рецепторы как к чужеродным, так и к собственным антигенам. В ходе созревания Т-лимфоциты проходят позитивную селекцию - отбор клеток, обладающих рецепторами для молекул главного комплекса тканевой совместимости (МНС), обеспечивающих возможность последующих контактов Т-лимфоцитов с клетками, представляющими им чужеродный антиген. В корковом слое тимуса происходит и негативная селекция: клетки с рецепторами для собственных антигенов, вступающие в контакт с ними погибают. В результате в мозговой слой тимуса поступает 3-5% клеток сформировавшихся в корковом слое. Это лимфоциты с рецепторами к чужеродным антигенам способны впоследствии после контакта с соответствующим антигеном реализовать специфическую иммунную реакцию. В мозговом слое дифференцировка лимфоцитов завершается формированием CD4+- и С08+-лимфоцитов. Созревание клеток в тимусе длится 4-6 сут., после чего лимфоциты поступают в кровь, лимфу, ткани, во вторичные органы иммунной системы. Эпителиальные клетки тимуса образуют пептидные гормоны и гормоноподобные пептиды: тимулин, альфа и бета-тимозин, тимопоетин, способствующие созреванию и дифференцировке Т-лимфоцитов в тимусе и вне него. Выделение этих гормонов и создание их синтетических аналогов производится для создания лекарственных средств, регулирующих иммунологические функции. Тимус начинает функционировать у шестинедельного эмбриона человека, к рождению его масса достигает 10-15 г, к началу полового созревания - 30-40 г. Далее происходит постепенная инволюция тимуса с утратой до 3% активной ткани ежегодно. Инволюция тимуса сопровождается снижением продукции Т-лимфоцитов. Их уровень в организме поддерживается за счет долгоживущих клеток, внетимусного созревания части клеток под действием цитокинов. Предполагают, что последствия инволюции тимуса входят в число причин старческой патологии и определяют продолжительность жизни человека. Костный мозг, общая масса которого у человека достигает 3 кг, выполняет несколько иммунологических функций. Как уже упоминалось, костный мозг служит местом происхождения всех клеток иммунной системы. Здесь же происходит созревание и дифференцировка В-лимфоцитов. Костный мозг функционирует и как вторичный орган иммунной системы. Макрофаги костного мозга обладают фагоцитарной активностью, а В-лимфоциты дифференцируются в плазматические клетки, которые продуцируют антитела. Направления дифференцировки стволовых клеток костного мозга определяются клетками стромы костного мозга, макрофагальными клетками, лимфоцитами и образуемыми ими цитокинами. Клетки костного мозга продуцируют гормоноподобный пептидный фактор, способствующий активации В-лимфоцитов. 16. К периферическим органам относятся селезенка, лимфатические узлы, скопления лимфоидной ткани под слизистыми поверхностями желудочно-кишечного, дыхательного, мочеполового трактов (групповые лимфатические фолликулы, тонзиллы, пейеровы бляшки).. Селезёнка. Клетки селезенки отвечают на антигены, поступающие через кровоток, и осуществляют преимущественно адаптивный гуморальный иммунный ответ (антителообразование). Удаление данного органа в связи с ее травмой, в итоге обычно приводит к очень серьезным имунным нарушениям у пациентов, поэтому здоровье селезенки и забота об этом здоровье весьма и весьма важны. Формирование гуморального ответа на антигены, содержащиеся в крови, связано главным образом с селезенкой. Она расположена в левом верхнем квадрате брюшной полости и покрыта капсулой, от которой в паренхиму отходят трабекулы, несущие сосуды. Размеры селезенки у взрослого человека составляют приблизительно 10x15 см. Масса селезенки составляет 200-250 г. В эмбриогенезе данный орган выявляют после 2-го месяца развития, и вначале она представлена стромой, которую затем заселяют клетки иммунной системы. В селезенке плода происходит гемопоэз, который прекращается после рождения. У грызунов после рождения гемопоэтическая функция органа сохраняется. Рассматривая селезенку как периферический орган иммунной системы, следует иметь в виду, что она состоит из красной и белой пульпы с совершенно разными иммуноопосредованными свойствами. Белая пульпа данного органа представлена лимфоидной тканью, связанной с артериолами селезенки, обозначаемой как периартериальные лимфоидные муфты с Т- и В-клеточными зонами. Т-клетки окружают центральную артериолу и формируют тимусзависимую зону селезенки. В-клеточные фолликулы расположены ближе к краю муфты и образуют скопления первичных или вторичных фолликулов с зародышевыми центрами и клетками памяти. По данным анатомии человека красная пульпа состоит из венозных синусов и клеточных тяжей. В синусах наряду с форменными элементами крови расположены губчатые скопления ткани, в которой имеются макрофаги, Т-лимфоциты, покидающие селезенку через венозные синусы, и плазматические клетки — конечная стадия дифференцировки В-лимфоцитов, вышедших из зародышевых центров белой пульпы. В селезенке создаются оптимальные условия для развития адаптивного гуморального иммунного ответа (антителогенез). Особую роль в реализации иммунных функций данного органа играет так называемая маргинальная зона, окружающая белую пульпу и содержащая уникальные оседлые клетки (В-лимфоциты, ДК, макрофаги). Помимо выполнения иммунных функций, селезенка депонирует тромбоциты, эритроциты и гранулоциты. В красной пульпе разрушаются старые тромбоциты и эритроциты, которые затем фагоцитируются макрофагами. Лимфатические узлы - скопления лимфоидной ткани, расположенные по ходу лимфатических и кровеносных сосудов. У человека имеется 500-1000 лимфатических узлов, а также более мелкие скопления лимфоидной ткани под слизистыми поверхностями и в коже. Лимфатические узлы обеспечивают неспецифическую резистентность организма, выполняя функции барьеров и фильтров, удаляющих из лимфы и крови чужеродные частицы. Вместе с тем лимфатические узлы служат местом формирования антител и клеток, осуществляющих клеточные иммунные реакции. Кожа, эпителиальные и паренхиматозные органы содержат многочисленные лимфатические капилляры, собирающие тканевую жидкость, именуемую лимфой. Лимфа поступает далее в лимфатические сосуды, по ходу которых последовательно располагается множество лимфатических узлов, строма которых служит фильтром, удаляющим из лимфы практически все чужеродные частицы, в том числе и вирусы, и до 2% растворимых антигенных молекул. В лимфоузлах иммунного организма задерживаются практически все водорастворимые антигены. Лимфатический узел покрыт соединительнотканной капсулой, от которой внутрь узла отходят трабекулы, разделяющие его на доли, в которых содержится корковое и мозговое вещество, а между ними лежит паракортикальный слой. Основной структурой коркового вещества являются скопления лимфоидных фолликулов, содержащих лимфоциты, преимущественно В-группы, дендритные клетки и макрофаги. Лимфоидные фолликулы могут быть первичными и вторичными. Первичные фолликулы преобладают в покоющемся лимфоузле, содержащиеся в них клетки малоактивны, митозы встречаются редко. В случаях формирования реакции на антиген первичные фолликулы превращаются во вторичные фолликулы, называемые также зародышевыми центрами. Функции периферических органов иммунной системы выполняют также лимфоидные структуры глоточного кольца, кишечника, мочеполовых органов, кожи, бронхов и легких. Структуры, обеспечивающие защиту слизистых, получили название - лимфоидная ткань, ассоциированная со слизистыми - MALT (Mucosa-associated lymphoid tissue). В состав MALT входят GALT, BALT - лимфоидные ткани, «ссоциированные с кишечником, с бронхолегочной системой. К ним примыкают лимфоидные структуры кожи-SALT (Skin associated lymphoid tissue). Клеточные структуры этих лимфоидных образований, а также лимфоциты, находящиеся в тканях, имеют то же происхождение, что и структуры других периферических органов иммунной системы. 17. Клетки селезенки отвечают на антигены, поступающие через кровоток, и осуществляют преимущественно адаптивный гуморальный иммунный ответ (антителообразование). Удаление данного органа в связи с ее травмой, в итоге обычно приводит к очень серьезным имунным нарушениям у пациентов, поэтому здоровье селезенки и забота об этом здоровье весьма и весьма важны. Формирование гуморального ответа на антигены, содержащиеся в крови, связано главным образом с селезенкой. Она расположена в левом верхнем квадрате брюшной полости и покрыта капсулой, от которой в паренхиму отходят трабекулы, несущие сосуды. Размеры селезенки у взрослого человека составляют приблизительно 10x15 см. Масса селезенки составляет 200-250 г. В эмбриогенезе данный орган выявляют после 2-го месяца развития, и вначале она представлена стромой, которую затем заселяют клетки иммунной системы. В селезенке плода происходит гемопоэз, который прекращается после рождения. У грызунов после рождения гемопоэтическая функция органа сохраняется. Рассматривая селезенку как периферический орган иммунной системы, следует иметь в виду, что она состоит из красной и белой пульпы с совершенно разными иммуноопосредованными свойствами. Белая пульпа данного органа представлена лимфоидной тканью, связанной с артериолами селезенки, обозначаемой как периартериальные лимфоидные муфты с Т- и В-клеточными зонами.
По данным анатомии человека красная пульпа состоит из венозных синусов и клеточных тяжей. В синусах наряду с форменными элементами крови расположены губчатые скопления ткани, в которой имеются макрофаги, Т-лимфоциты, покидающие селезенку через венозные синусы, и плазматические клетки — конечная стадия дифференцировки В-лимфоцитов, вышедших из зародышевых центров белой пульпы. В селезенке создаются оптимальные условия для развития адаптивного гуморального иммунного ответа (антителогенез). Особую роль в реализации иммунных функций данного органа играет так называемая маргинальная зона, окружающая белую пульпу и содержащая уникальные оседлые клетки (В-лимфоциты, ДК, макрофаги). Помимо выполнения иммунных функций, селезенка депонирует тромбоциты, эритроциты и гранулоциты. В красной пульпе разрушаются старые тромбоциты и эритроциты, которые затем фагоцитируются макрофагами. 18. Лимфатические узлы - скопления лимфоидной ткани, расположенные по ходу лимфатических и кровеносных сосудов. У человека имеется 500-1000 лимфатических узлов, а также более мелкие скопления лимфоидной ткани под слизистыми поверхностями и в коже. Лимфатические узлы обеспечивают неспецифическую резистентность организма, выполняя функции барьеров и фильтров, удаляющих из лимфы и крови чужеродные частицы. Вместе с тем лимфатические узлы служат местом формирования антител и клеток, осуществляющих клеточные иммунные реакции. Кожа, эпителиальные и паренхиматозные органы содержат многочисленные лимфатические капилляры, собирающие тканевую жидкость, именуемую лимфой. Лимфа поступает далее в лимфатические сосуды, по ходу которых последовательно располагается множество лимфатических узлов, строма которых служит фильтром, удаляющим из лимфы практически все чужеродные частицы, в том числе и вирусы, и до 2% растворимых антигенных молекул. В лимфоузлах иммунного организма задерживаются практически все водорастворимые антигены. Лимфатический узел покрыт соединительнотканной капсулой, от которой внутрь узла отходят трабекулы, разделяющие его на доли, в которых содержится корковое и мозговое вещество, а между ними лежит паракортикальный слой. Основной структурой коркового вещества являются скопления лимфоидных фолликулов, содержащих лимфоциты, преимущественно В-группы, дендритные клетки и макрофаги. Лимфоидные фолликулы могут быть первичными и вторичными. Первичные фолликулы преобладают в покоющемся лимфоузле, содержащиеся в них клетки малоактивны, митозы встречаются редко. В случаях формирования реакции на антиген первичные фолликулы превращаются во вторичные фолликулы, называемые также зародышевыми центрами. В-лимфоциты, находившиеся в первичном фолликуле, в ответ на поступивший в узел антиген активируются с помощью Т-клеток, начинают быстро делиться и дифференцироваться в антителообразующие клетки - зрелые лимфоциты и плазматические клетки, а также клетки иммунологической памяти, обеспечивающие быстрый ответ на новое поступление антигена. Часть антителообразующих лимфоузлов перемещается в мозговой слой лимфоузла, в другие лимфоузлы, где продолжают продуцировать антитела. Пространство между фолликулами коркового слоя и паракортикальные зоны мозгового слоя алолнены преимущественно Т-лимфоцитами, из которых при иммунной реакции формируются цитотоксические и другие эффекторные лимфоциты, осуществляющие клеточные реакции иммунной защиты. В мозговом слое лимфатического узла содержится большое количество макрофагов, осуществляющих фагоцитоз поступающих в лим-фоузел микроорганизмов и других чужеродных частиц. 19. Данный вид лимфоидной ткани располагается под слизистой оболочкой. Сюда относятся аппендикс, лимфоидное кольцо, лимфатические фолликулы кишечника, а также аденоиды. Скопления лимфоидной ткани в кишечнике – пейеровы бляшки. Эта лимфоидная ткань является барьером на пути проникновения микробов через слизистые оболочки. Функции лимфоидных скоплений в кишечнике и миндалинах: 1) распознавательная – общая площадь поверхности миндалин у детей очень большая (почти 200 см2). На этой площади происходит постоянное взаимодействие антигенов и клеток иммунной системы. Именно отсюда информация о чужеродном агенте следует в центральные органы иммунитета: тимус и костный мозг; 2) защитная – на слизистой оболочке миндалин и пейеровых бляшек в кишечнике, в аппендиксе расположены Т-лимфоциты и В-лимфоциты, лизоцим и другие вещества, обеспечивающие защиту.
21. А теперь остановимся подробнее на рассмотрении клеток, обеспечивающих слаженную работу иммунитета. Непосредственными исполнителями иммунных реакций являются лейкоциты. Их назначение – распознавать чужеродные вещества и микроорганизмы, осуществлять борьбу с ними, а также фиксировать информацию о них. Различают следующие виды лейкоцитов: 1) лимфоциты (Т-киллеры, Т-хелперы, Т-супрессоры, В-лимфоциты); 2) нейтрофилы (палочкоядерные и сегментоядерные); 3) эозинофилы; 4) базофилы. Лимфоциты – главные фигуры в иммунологическом надзоре. В костном мозге предшественники лимфоцитов делятся на две крупные ветви. Одна из них (у млекопитающих) заканчивает свое развитие в костном мозге, а у птиц – в специализированном лимфоидном органе – бурсе (сумке). Это В-лимфоциты. После того как В-лимфоциты покидают костный мозг, они короткое время циркулируют в кровяном русле, а затем происходит внедрение их в периферические органы. Они как бы торопятся осуществить свое предназначение, поскольку срок жизни этих лимфоцитов невелик – всего 7-10 дней. Разнообразие В-лимфоцитов формируется уже во время внутриутробного развития, причем каждый из них направлен против определенного антигена. Другая часть лимфоцитов из костного мозга переселяется в тимус, центральный орган иммунной системы. Эта ветвь – Т-лимфоциты. После завершения развития в тимусе часть зрелых Т-лимфоцитов продолжает находиться в мозговом слое, а часть покидает его. Значительная часть Т-лимфоцитов становится Т-киллерами, меньшая часть выполняет регуляторную функцию: Т-хелперы усиливают иммунологическую реактивность, а Т-супрессоры, напротив, ослабляют ее. Хелперы способны узнавать антиген и активизировать соответствующий В-лимфоцит (непосредственно при контакте или на расстоянии с помощью специальных веществ – лимфокинов). Наиболее известным лимфокином является интерферон, который применяется в медицине при лечении вирусных болезней (например, гриппа), но он эффективен только на начальном этапе возникновения заболевания. Супрессоры обладают способностью выключать иммунный ответ, что очень важно: если иммунная система не будет подавлена после обезвреживания антигена, составные части иммунитета будут истреблять собственные здоровые клетки организма, что приведет к развитию аутоиммунных заболеваний. Киллеры являются главным звеном клеточного иммунитета, так как они распознают антигены и эффективно их поражают. Киллеры выступают против клеток, которые поражены вирусными инфекциями, а также опухолевых, мутированных, стареющих клеток организма. Нейтрофилы, базофилы и эозинофилы – это разновидности лейкоцитов. Названия свои они получили за способность по-разному воспринимать красящие вещества. Эозинофилы реагируют в основном на кислые красители (конго красный, эозин) и в мазках крови имеют розово-оранжевый цвет; базофилы – щелочные (гематоксилин, метиловый синий), поэтому в мазках выглядят сине-фиолетовыми; нейтрофилы воспринимают и те, и другие, поэтому окрашиваются серо-фиолетовым цветом. Ядра зрелых нейтрофилов сегментированы, т. е. имеют перетяжки (поэтому их называют сегментоядерными), ядра незрелых клеток называют палочкоядерными. Одно из названий нейтрофилов (микрофагоциты) указывает на их возможность фагоцитировать микроорганизмы, но в меньших количествах, чем это делают макрофаги. Нейтрофилы защищают от проникновения в организм бактерий, грибов и простейших. Эти клетки ликвидируют погибшие клетки тканей, удаляют старые эритроциты и очищают раневую поверхность. При оценке развернутого анализа крови признаком воспалительного процесса является сдвиг лейкоцитарной формулы влево с увеличением числа нейтрофилов. Эозинофилы принимают участие в уничтожении паразитов (выделяют специальные ферменты, которые оказывают на них повреждающее действие), в аллергических реакциях. Макрофаги (они же фагоциты) – «пожиратели» инородных тел и самые древние клетки иммунной системы. Макрофаги происходят из моноцитов (разновидности лейкоцитов). Первые стадии развития они проходят в костном мозге, а затем покидают его в виде моноцитов (округлых клеток) и определенное время циркулируют в крови. Из кровяного русла они попадают во все ткани и органы, где изменяют свою округлую форму на другую, с отростками. Именно в таком виде они приобретают подвижность и способны прилипать к любым потенциально чужеродным телам. Они распознают некоторые чужеродные вещества и сигнализируют о них Т-лимфоцитам, а те в свою очередь – В-лимфоцитам. Затем В-лимфоциты начинают продуцировать антитела – иммуноглобулины против того агента, о котором «сообщили» клетка-фагоцит и Т-лимфоцит. Оседлые макрофаги можно найти практически во всех тканях и органах человека, что обеспечивает равносильный ответ иммунной системы на любой антиген, попавший в организм в любом месте. Макрофаги ликвидируют не только микроорганизмы и чужеродные химические яды, которые попадают в организм извне, но и умершие клетки или токсины, произведенные собственным организмом (эндотоксины). Миллионы макрофагов окружают их, впитывают и растворяют, чтобы вывести из организма. Снижение фагоцитарной активности клеток крови способствует развитию хронического воспалительного процесса и возникновению агрессии против собственных тканей организма (появлению аутоиммунных процессов). При угнетении фагоцитоза также наблюдается дисфункция разрушения и выведения из организма иммунных комплексов. 22.Т- лимфоциты. Локализация. Обычно локализуются в так называемых Т- зависимых зонах периферических лимфоидных органов (периартикулярно в белой пульпе селезенки и паракортикальных зонах лимфоузлов). Функции. Т- лимфоциты распознают процессированный и представленный на поверхности антиген- представляющих (А) клеток антиген. Они отвечают за клеточный иммунитет, иммунные реакции клеточного типа. Отдельные субпопуляции помогают В- лимфоцитам реагировать на Т- зависимые антигены выработкой антител. Происхождение и созревание. Родоначальницей всех клеток крови, в том числе лимфоцитов, является единая стволовая клетка костного мозга. Она генерирует два типа клеток- предшественников- лимфоидную стволовую клетку и предшественника клеток красной крови, от которой происходят и клетки- предшественники лейкоцитов и макрофагов. Образование и созревание иммунокомпетентных клеток осуществляется в центральных органах иммунитета (для Т- лимфоцитов- в тимусе). Клетки- предшественники Т- лимфоцитов попадают в тимус, где пре- Т- клетки (тимоциты) созревают, пролиферируют и проходят дифференцировку на отдельные субклассы в результате взаимодействия с эпителиальными и дендритными клетками стромы и воздействия гормоноподобных полипептидных факторов, секретируемых эпителиальными клетками тимуса (альфа1- тимозин, тимопоэтин, тимулин и др.). При дифференцировке Т- лимфоциты приобретают определенный набор мембранных CD- маркеров. Т-клетки разделяют на субпопуляции в соответствии с их функцией и профилем CD- маркеров. Т- лимфоциты распознают антигены с помощью двух типов мембранных гликопротеинов- Т- клеточных рецепторов (семейство Ig- подобных молекул) и CD3, нековалентно связанных между собой. Их рецепторы, в отличие от антител и рецепторов В- лимфоцитов, не распознают свободно циркулирующие антигены. Они распознают пептидные фрагменты, представляемые им А- клетками через комплекс чужеродных веществ с соответствующим белком главной системы гистосовместимости 1 и 2 класса. Выделяют три основные группы Т- лимфоцитов- помощники (активаторы), эффекторы, регуляторы. Первая группа- помощники ( активаторы ), в состав которых входят Т- хелперы1, Т- хелперы2, индукторы Т- хелперов, индукторы Т- супрессоров. 1. Т- хелперы1 несут рецепторы CD4 (как и Т- хелперы2) и CD44, отвечают за созревание Т- цитотоксических лимфоцитов (Т- киллеров), активируют Т- хелперы2 и цитотоксическую функцию макрофагов, секретируют ИЛ-2, ИЛ-3 и другие цитокины. 2. Т- хелперы2 имеют общий для хелперов CD4 и специфический CD28 рецепторы, обеспечивают пролиферацию и дифференцировку В- лимфоцитов в антителпродуцирующие (плазматические) клетки, синтез антител, тормозят функцию Т- хелперов1, секретируют ИЛ-4, ИЛ-5 и ИЛ-6. 3. Индукторы Т- хелперов несут CD29, отвечают за экспрессию антигенов HLA класса 2 на макрофагах и других А- клетках. 4. Индукторы Т- супрессоров несут CD45 специфический рецептор, отвечают за секрецию ИЛ-1 макрофагами, активацию дифференцировки предшественников Т- супрессоров. Вторая группа- Т- эффекторы. В нее входит только одна субпопуляция. 5. Т- цитотоксические лимфоциты (Т- киллеры). Имеют специфический рецептор CD8, лизируют клетки- мишени, несущие чужеродные антигены или измененные аутоантигены (трансплантант, опухоль, вирус и др.). ЦТЛ распознают чужеродный эпитоп вирусного или опухолевого антигена в комплексе с молекулой класса 1 HLA в плазматической мембране клетки- мишени. Третья группа- Т-клетки- регуляторы. Представлена двумя основными субпопуляциями. 6. Т- супрессоры имеют важное значение в регуляции иммунитета, обеспечивая подавление функций Т- хелперов 1 и 2, В- лимфоцитов. Имеют рецепторы CD11, CD8. Группа функционально разнородна. Их активация происходит в результате непосредственной стимуляции антигеном без существенного участия главной системы гистосовместимости. 7. Т- контсупрессоры. Не имеют CD4, CD8, имеют рецептор к особому лейкину. Способствуют подавлению функций Т- супрессоров, вырабатывают резистентность Т- хелперов к эффекту Т- супрессоров. 23. Антигенраспознающие Рц Т-лимфоцитов — TCR принадлежат к надсемейству иммуноглобулинов. Выступающий над поверхностью клетки Аг-распознающий участок TCR — гетеродимер (т.е. состоит из двух разных полипептидных цепей) — аналог одного Fab-фрагмента Ig. Известны два варианта TCR, обозначаемые как TCRaP и TCRyb; эти варианты различаются составом полипептидных цепей Аг-распознающего участка. Каждый Т-лимфоцит несёт только один вариант Рц. ТаB стали известны раньше и изучены подробнее, чем Туb; поэтому строение Рц Т-лимфоцитов для Аг удобнее описывать на примере TCRap. Полностью трансмембранно расположенный TCR состоит из 8 или 10 (одна или две пары a + (3 плюс комплекс «2е + 5 + у + 2С») полипептидных цепей.• Трансмембранные цепи аир TCR. Это 2 примерно равновеликие полипептидные цепи — а (молекулярная масса 40-60 тыс., кислый гликопротеин) и р (молекулярная масса 40—50 тыс., нейтральный или основный гликопротеин). Каждая из этих цепей имеет по два гликозилированных домена во внеклеточной части Рц, гидрофобную (положительно заряженную за счёт остатков лизина и аргинина) трансмембранную часть и короткий (из 5—12 остатков АК) цитоплазматический участок. Внеклеточные части обеих цепей соединены одной дисульфидной связью. ♦ У-область. Наружные внеклеточные (дистальные) домены обеих цепей имеют вариабельный АК-состав. Они гомологичны V-области молекул Ig, это V-область TCR. Именно V-области а- и Р-цепей вступают в связь с комплексом «МНС-I/II—пептид». В связывании Аг участвуют ионные, водородные, ван-дер-вааль-совы и гидрофобные силы, конформация Рц при этом существенно изменяется. Каждый TCR потенциально способен связывать порядка 105 разных Аг, причём не только родственные по строению (перекрёстно реагирующие), но и не имеющие гомологии в структуре. 24. Корецепторные молекулы CD4 и CD8 • CD4 вступает в связь с инвариантной частью (Р2-доменом) молекулы MHC-II. CD4 имеет молекулярную массу 55 тыс. и 4 домена во внеклеточной части. При активации Т-лимфоцита одну молекулу TCR «обслуживают» две молекулы CD4 (вероятно, происходит димеризация молекул CD4). 25. В- лимфоциты. Существует несколько подтипов В- лимфоцитов. Основная функция В- клеток- эффекторное участие в гуморальных иммунных реакциях, дифференциация в результате антигенной стимуляции в плазматические клетки, продуцирующие антитела. Образование В- клеток у плода происходит в печени, в дальнейшем- в костном мозге. Процесс созревания В- клеток осуществляется в две стадии- антиген - независимую и антиген - зависимую. Антиген -независимая фаза. В- лимфоцит в процессе созревания проходит стадию пре- В- лимфоцита- активно пролиферирующей клетки, имеющей цитоплазменные H- цепи типа C мю (т.е. IgM). Следующая стадия- незрелый В- лимфоцит характеризуется появлением мембранного (рецепторного) IgM на поверхности. Конечная стадия антигеннезависимой дифференцировки- образование зрелого В- лимфоцита, который может иметь два мембранных рецептора с одинаковой антигенной специфичностью (изотипа) - IgM и IgD. Зрелые В- лимфоциты покидают костный мозг и заселяют селезенку, лимфоузлы и другие скопления лимфоидной ткани, где их развитие задерживается до встречи со “своим” антигеном, т.е. до осуществления антиген- зависимой дифференцировки. Антиген- зависимая дифференцировка включает активацию, пролиферацию и дифференцировку В- клеток в плазматические клетки и В- клетки памяти. Активация осуществляется различными путями, что зависит от свойств антигенов и участия других клеток (макрофагов, Т- хелперов). Большинство антигенов, индуцирующих синтез антител, для индукции иммунного ответа требуют участия Т- клеток- тимус- зависимые пнтигены.Тимус- независимые антигены (ЛПС, высокомолекулярные синтетические полимеры) способны стимулировать синтез антител без помощи Т- лимфоцитов. В- лимфоцит с помощью своих иммуноглобулиновых рецепторов распознает и связывает антиген. Одновременно с В- клеткой антиген по представлению макрофага распознается Т- хелпером (Т- хелпером 2), который активируется и начинает синтезировать факторы роста и дифференцировки. Активированный этими факторами В- лимфоцит претерпевает ряд делений и одновременно дифференцируется в плазматические клетки, продуцирующие антитела. Пути активации В- клеток и кооперации клеток в иммунном ответе на различные антигены и с участием популяций имеющих и не имеющих антиген Lyb5 популяций В- клеток отличаются. Активация В- лимфоцитов может осуществляться: - Т- зависимым антигеном при участии белков МНС класса 2 Т- хелпера; - Т- независимым антигеном, имеющим в составе митогенные компоненты; - поликлональным активатором (ЛПС); - анти- мю иммуноглобулинами; - Т- независимым антигеном, не имеющим митогенного компонента. 27. Естественные киллеры, натуральные киллеры (англ. Naturalkillercells(NK cells)) — большие гранулярные лимфоциты, обладающие цитотоксичностью против опухолевых клеток и клеток, зараженных вирусами. В настоящее время NK-клетки рассматривают как отдельный класс лимфоцитов. NK выполняют цитотоксические и цитокин-продуцирующие функции. NK являются одним из важнейших компонентов клеточного врождённого иммунитета. Эти клетки были названными естественными киллерами, поскольку, по ранним представлениям, они не требовали активации для уничтожения клеток, не несущих маркеров главного комплекса гистосовместимости I типа. Основная функция NK - уничтожение клеток организма, не несущих на своей поверхности MHC1 и таким образом недоступных для действия основного компонента противовирусного иммунитета - Т-киллеров. Уменьшение количества MHC1 на поверхности клетки может быть следствием трансформации клетки в раковую или действием вирусов, таких как папилломавирус и ВИЧ. Дата добавления: 2014-12-12 | Просмотры: 1796 | Нарушение авторских прав |
 Т-клетки окружают центральную артериолу и формируют тимусзависимую зону селезенки. В-клеточные фолликулы расположены ближе к краю муфты и образуют скопления первичных или вторичных фолликулов с зародышевыми центрами и клетками памяти.
Т-клетки окружают центральную артериолу и формируют тимусзависимую зону селезенки. В-клеточные фолликулы расположены ближе к краю муфты и образуют скопления первичных или вторичных фолликулов с зародышевыми центрами и клетками памяти.