|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология
|
Механизм заболевания аллергией
Современная медицина трактует механизм заболевания аллергией следующим образом. В ответ на внедрение в организм, или воздействие на организм, аллергена в нем начинают развиваться и происходить аллергические реакции, которые могут быть специфическими и неспецифическими. Развитию специфической реакции предшествует скрытый период, в течение которого развивается повышенная чувствительность организма к впервые попавшему в него аллергену - так называемая сенсибилизация.
Сенсибилизация происходит в результате выработки в организме антител - белковых веществ, образующихся в ответ на введение только данного аллергена, или появления лимфоцитов. способных взаимодействовать с данным аллергеном. Если к моменту их появления аллерген был удален из организма, то никаких болезненных проявлений не отмечается.
При повторном воздействии аллергена на уже сенсибилизированный к нему организм, развивается аллергическая реакция - взаимодействие антител или лимфоцитов с вызвавшим их образование аллергеном. В результате этого взаимодействия происходит ряд биохимических процессов с выделением химических веществ (гистамин, серотонин и др.), вызывающих повреждение клеток, тканей и органов, которое лежит в основе аллергических заболеваний.
Повышенная чувствительность организма в таких случаях специфична, т. е. она повышается к тому аллергену, с которым уже ранее был контакт, и который вызвал состояние сенсибилизации.
Неспецифические аллергические реакции возникают при первичном контакте с аллергеном. При этом нет периода сенсибилизации. Попадающий в организм аллерген сам вызывает образование веществ, повреждающих клетки, ткани и органы. К числу таких реакций относится идиосинкразия - некоторые случаи непереносимости пищевых продуктов и лекарственных веществ.
В большинстве случаев у человека, склонного к аллергии, развиваются специфические аллергические реакции. По времени проявления аллергические реакции принято делить на два типа: немедленный и замедленный.
Реакциями немедленного типа считают кожные и системные аллергические реакции (дыхательной, пищеварительной и других систем), возникающие через 15-20 минут после воздействия на больного специфического аллергена. Такими реакциями являются кожный волдырь, спазм бронхов, расстройство функции желудочно-кишечного тракта и др.
К аллергическим реакциям немедленного типа относят анафилактический шок, поллиноз, крапивницу, бронхиальную астму, сывороточную болезнь, отек Квинке. Сывороточная болезнь развивается при определенной настроенности организма через 2-12 дней после введения сыворотки или гамма-глобулина и проявляется появлением сыпи с мучительным зудом, припухлостью лимфатических узлов, повышением температуры, другими симптомами. Отек Квинке - преходящий ограниченный отек кожи, подкожной клетчатки и слизистых оболочек при попадании в организм любого аллергена; чаще встречается на лице, однако может наблюдаться на слизистой оболочке рта, гортани, желудочно-кишечного тракта. Реакции замедленного типа развиваются в течение многих часов, иногда суток. К ним относятся повышенная чувствительность к бактериям (например, при туберкулезе, бруцеллезе, сапе, туляремии и др.), контактные дерматиты у работников химической промышленности, фармацевтов, медицинского персонала.
60. РЕАКЦИИГИПЕРЧУВСТВИТЕЛЬНОСТИIТИПА -АНАФИЛАКТИЧЕСКИЕРЕАКЦИИ
Реакции гиперчувствительности I типа бывают системными и местными. Системная реакция развивается обычно в ответ на внутривенное введение антигена, к которому организм хозяина уже сенсибилизирован. При этом часто спустя несколько минут развивается шоковое состояние, которое может стать причиной смерти. Местные реакции зависят от места, в которое попадет антиген, и носят характер локализованного отека кожи (кожная аллергия, крапивница), выделений из носа и конъюнктивы (аллергический ринит и конъюнктивит), сенной лихорадки, бронхиальной астмы или аллергического гастроэнтерита (пищевая аллергия).
Схема 25. РеакциигиперчувствительностиIтипа— анафилактическиереакции
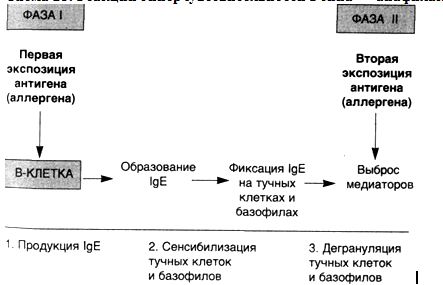
Известно, что реакции гиперчувствительности I типа проходят в развитии две фазы (схема 25). Первая фаза инициального ответа характеризуется расширением сосудов и повышением их проницаемости, а также, в зависимости от локализации, спазмом гладкой мускулатуры или секрецией желез. Эти признаки появляются через 5—30 мин после экспозиции аллергена. Во многих случаях вторая (поздняя) фаза развивается через 2—8 ч, без дополнительной экспозиции антигена и продолжается несколько дней. Эта поздняя фаза реакции характеризуется интенсивной инфильтрацией эозинофилами, нейтрофилами, базофилами и моноцитами, а также деструкцией ткани в виде повреждения эпителиальных клеток слизистых оболочек.
Тучные клетки и базофилы играют главную роль в развитии реакций гиперчувствительности I типа; они активируются посредством перекрестно реагирующих высокоаффинных рецепторов к IgE. Кроме того, тучные клетки активируются компонентами комплемента С5а и С3а (анафилатоксины), а также цитокинами макрофагов (интерлейкин-8), некоторыми лекарственными веществами (кодеин и морфин) и физическими воздействиями (тепло, холод, солнечный свет).
У человека реакции гиперчувствительности I типа вызываются иммуноглобулинами класса IgE. Аллерген стимулирует продукцию IgE В-лимфоцитами в основном в слизистых оболочках в месте попадания антигена и в регионарных лимфатических узлах. IgE-антитела, образованные в ответ на аллерген, атакуют тучные клетки и базофилы, которые обладают высокочувствительными рецепторами для Fc-порции IgE. После того как тучные клетки и базофилы, атакованные цитофильными IgE-антитела-ми, повторно встречаются со специфическим антигеном, развивается серия реакций, приводящая к выбросу ряда сильных медиаторов, ответственных за клинические проявления гиперчувствительности I типа.
Вначале антиген (аллерген) связывается с IgE-антителами. При этом мультивалентные антигены связывают более одной молекулы IgE и вызывают перекрестное связывание соседних IgE-антител. Связывание молекул IgE инициирует развитие двух независимых процессов: 1) дегрануляцию тучных клеток с выбросом первичных медиаторов; 2) синтез de novo и выброс вторичных медиаторов, таких как метаболиты арахидоновой кислоты. Эти медиаторы непосредственно ответственны за начальные симптомы реакций гиперчувствительности I типа. Кроме того, они включают цепь реакций, которые приводят к развитию второй (поздней) фазы инициального ответа.
Первичные медиаторы содержатся в гранулах тучных клеток. Их делят на четыре категории.
▲ Биогенные амины включают гистамин и аденозин. ГистамиН вызывает выраженный спазм гладкой мускулатуры бронхов, усиление сосудистой проницаемости, интенсивную секрецию носовых, бронхиальных и желудочных желез. Аденозин стимулирует тучные клетки к выбросу медиаторов, вызывающих бронхоспазм и торможение агрегации тромбоцитов.
▲ Медиаторы хемотаксиса включают эозинофильный хемотаксический фактор и нейтрофильный хемотаксический фактор.
▲ ферменты содержатся в матриксе гранул и включают протезы (химаза, триптаза) и некоторые кислые гидролазы. Ферменты вызывают образование кининов и активацию компонентов комплемента (СЗа), воздействуя на их предшественников.
▲ Протеогликан — гепарин.
Вторичные медиаторы включают два класса соединений: липидные медиаторы и цитокины.
▲ Липидные медиаторы образуются благодаря последовательным реакциям, происходящим в мембранах тучных клеток и приводящим к активации фосфолипазы А2. Она воздействует на фосфолипиды мембран, вызывая появление арахидоновой кислоты. Из арахидоновой кислоты в свою очередь образуются лейкотриены и простагландины.
Лейкотриены играют исключительно важную роль в патогенезе реакций гиперчувствительности I типа. Лейкотриены С4 и D4 — самые сильные из известных вазоактивных и спазмогенных агентов. Они действуют в несколько тысяч раз активнее гистамина при повышении сосудистой проницаемости и сокращении гладкой мускулатуры бронхов. Лейкотриен В4 обладает сильным хемотаксическим действием в отношении нейтрофилов, эозинофилов и моноцитов.
Простагландин D2 образуется в тучных клетках и вызывает интенсивный бронхоспазм и повышенную секрецию слизи.
Фактор активации тромбоцитов (ФАТ) — вторичный медиатор, вызывающий агрегацию тромбоцитов, выброс гистамина, бронхоспазм, повышение сосудистой проницаемости и расширение кровеносных сосудов. Кроме того, он обладает выраженным провоспалительным эффектом. ФАТ оказывает токсическое действие в отношении нейтрофилов и эозинофилов. В высоких концентрациях он активирует клетки, участвующие в воспалении, вызывая их агрегацию и дегрануляцию.
▲ Цитокины играют важную роль в патогенезе реакций гиперчувствительности I типа благодаря их способности рекрутировать и активировать воспалительные клетки. Полагают, что тучные клетки продуцируют ряд цитокинов, включая фактор некроза опухоли а (ФНО-а), интерлейкины (ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6) и гранулоцитарно-макрофагальный колониестиму-лирующий фактор (ГМ-КСФ). В экспериментальных моделях показано, что ФНО-а является важным медиатором IgE-зависимых кожных реакций. ФНО-а считают сильным провоспалительным цитокином, который может привлекать нейтрофилы и эозинофилы, способствуя их проникновению через стенки сосудов и активируя их в тканях. Наконец, ИЛ-4 необходим для рекрутирования эозинофилов. Воспалительные клетки, накапливающиеся в местах развития реакции гиперчувствительности I типа, являются дополнительным источником цитокинов и гистаминвысвобождающих факторов, которые вызывают дальнейшую дегрануляцию тучных клеток.
Таким образом, гистамин и лейкотриены быстро выделяются из сенсибилизированных тучных клеток и ответственны за немедленно развивающиеся реакции, характеризующиеся отеком, секрецией слизи, спазмом гладкой мускулатуры. Многие другие медиаторы, представленные лейкотриенами, ФАТ и ФНО-а, включаются в позднюю фазу ответа, рекрутируя дополнительное количество лейкоцитов — базофилов, нейтрофилов и эозинофилов.
Среди клеток, которые появляются в позднюю фазу реакции, особенно важны эозинофилы. Набор медиаторов в них столь же велик, как и в тучных клетках. Таким образом, дополнительно рекрутированные клетки усиливают и поддерживают воспалительный ответ без дополнительного поступления антигена.
эозинофилы.
Системнаяиместнаяанафилаксия
Системная анафилаксия возникает после введения гетерологичных белков, например антисывороток, гормонов, ферментов, полисахаридов и лекарственных веществ. Тяжесть заболевания зависит от уровня сенсибилизации. Шоковая доза антигена, однако, может быть исключительно мала. Например, для кожного тестирования различных форм аллергии достаточно минимального количества антигена. Спустя несколько минут после экспозиций появляются зуд, крапивница и кожная эритема, затем через короткое время развивается спазм респираторных бронхиол и появляется респираторный дистресс. Рвота, спазмы в животе, понос и обструкция гортани могут закончиться шоком и смертью больного. На вскрытии в одних случаях обнаруживаются отек и кровоизлияние в легких, тогда как в других — острая эмфизема легких с расширением правого желудочка сердца.
Местную анафилаксию называют атопической аллергией. Около 10 % населения страдает от местной анафилаксии, возникающей в ответ на попадание в организм аллергенов: пыльцы растений, перхоти животных, домашней пыли и т.п. К заболеваниям, в основе которых лежит местная анафилаксия, относят крапивницу, ангионевротический отек, аллергический ринит (сенная лихорадка) и некоторые формы астмы. Существует семейная предрасположенность к этому типу аллергии.
61. РЕАКЦИИГИПЕРЧУВСТВИТЕЛЬНОСТИIIТИПА -ЦИТОТОКСИЧЕСКИЕРЕАКЦИИ
При реакциях гиперчувствительности II типа в организме появляются антитела, которые направлены против антигенов, расположенных на поверхности клеток или других компонентов тканей. Антигенные детерминанты могут быть связаны с клеточной мембраной или представляют собой экзогенный антиген, адсорбированный на поверхности клеток. В любом случае реакция гиперчувствительности возникает как следствие связывания антител с нормальными или поврежденными антигенами на поверхности клетки. Описаны три антителозависимых механизма развития реакции этого типа.
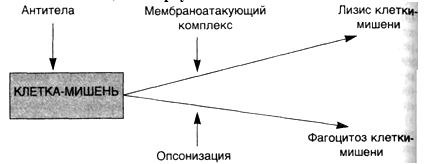
Комплементзависимые реакции (схема 26). Существует два механизма, с помощью которых антитело и комплемент могут вызывать реакции гиперчувствительности II типа: прямой лизис и опсонизация. В первом случае антитело (IgM или IgG) реагирует с антигеном на поверхности клетки, вызывая активацию системы комплемента и приводя в действие мембраноатакующий комплекс, который нарушает целостность мембраны, "продырявливая" липидный слой. Во втором случае клетки сенсибилизированы к фагоцитозу посредством фиксации антитела или СЗЬ — фрагмента комплемента к поверхности клетки (опсонизация). При этом варианте реакции гиперчувствительности II типа чаще всего затрагиваются клетки крови (эритроциты, лейкоциты и тромбоциты), но антитела могут быть направлены также против внеклеточных структур, например против гломерулярной ба-зальной мембраны.
Клинически такие реакции возникают в следующих случаях:
▲припереливаниинесовместимойкрови, когдаклеткидонорареагируютсантителамихозяина;
▲ при эритробластозе плода, когда имеются антигенные различия между матерью и плодом, а антитела (IgG) матери, проникая сквозь плаценту, вызывают разрушение эритроцитов плода;
Схема 26. РеакциягиперчувствительностиIIтипа— комплементзависимыереакции
▲ при аутоиммунной гемолитической анемии, агранулоцитозе и тромбоцитопении, когда происходит образование антител против собственных клеток крови, которые затем разрушаются;
▲принекоторыхреакцияхна лекарства образующиеся антитела реагируют с препаратами, образуя комплексы с эритроцитарным антигеном.
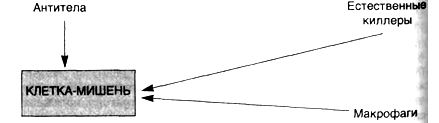
Антителозависимая связанная с клетками цитотоксичность (схема 27) не сопровождается фиксацией комплемента, однако вызывает кооперацию лейкоцитов. Клетки-мишени, покрытые IgG-антителами в низких концентрациях, уничтожаются несенсибилизированными клетками, которые обладают Fc-рецепторами. Несенсибилизированные клетки связывают клетки-мишени рецепторами для Fc-фрагмента IgG, а лизис клеток происходит без фагоцитоза. В этом виде цитотоксичности участвуют моноциты, нейтрофилы, эозинофилы и естественные киллеры (NK). Хотя в большинстве случаев в данном типе реакции участвуют антитела IgG; иногда (например, при связанной с эозинофилами цитотоксичности против паразитов) задействованы IgE-антитела. Этот вид цитотоксичности также имеет значение при реакции отторжения трансплантата.
Схема 27. РеакциягиперчувствительностиIIтипа— антителозависимаясвязаннаясклеткамицитотоксичность
Антителоопосредованная клеточная дисфункция. В некоторых случаях антитела, направленные против рецепторов на поверхности клеток, нарушают их функционирование, не вызывая повреждения клеток или развития воспаления. Например, при миастении антитела вступают в реакцию с ацетилхолиновыми рецепторами в двигательных концевых пластинках скелетных мышц, нарушая нервно-мышечную передачу и вызывая таким образом мышечную слабость. Наоборот, при антителоопосредованной стимуляции функций клетки развивается базедова болезнь. При этом заболевании антитела против рецепторов тиреотропного гормона на эпителиальных клетках щитовидной железы стимулируют клетки, что приводит к гипертиреозу. Этот же механизм лежит в основе реакций инактивации и нейтрализации.
62. РЕАКЦИИГИПЕРЧУВСТВИТЕЛЬНОСТИIIIТИПА -ИММУНОКОМПЛЕКСНЫЕРЕАКЦИИ
Развитие реакций гиперчувствительности III типа вызывают комплексы антиген — антитело, которые повреждают ткань в связи с их способностью активировать различные медиаторы сыворотки крови, главным образом систему комплемента (схема 28). Токсическая реакция возникает тогда, когда антиген связывается с антителом или в кровеносном русле (циркулирующие иммунные комплексы), или вне сосудов, где антиген может осаждаться (иммунные комплексы in situ). Отдельные формы гломе-рулонефрита, при которых иммунные комплексы образуются in situ, начинаются с имплантации антигена в гломерулярную ба-зальную мембрану. Комплексы, образованные в кровотоке, вызывают повреждение тогда, когда они попадают в стенки кровеносных сосудов или оседают в фильтрующих структурах, таких как гломерулярный фильтр. Образование комплексов антиген — антитело еще не означает болезнь, так как они встречаются при многих иммунных процессах и могут представлять собой нормальный механизм элиминации антигена.
Известны два типа иммунокомплексных повреждений: 1) при поступлении в организм экзогенного антигена (чужеродный белок, бактерия, вирус) и 2) при образовании антител против собственных антигенов (эндогенные). Заболевания, развитие которых обусловлено иммунными комплексами, могут быть генерализованными, если иммунные комплексы образуются в крови и осе-Дают во многих органах, или местными, когда иммунные комплексы локализованы в отдельных органах, таких как почки (гломе-РУлонефрит), суставы (артрит) или мелкие кровеносные сосуды к°Жи (местная реакция Артюса).
Схема 28. РеакциигиперчувствительностиIIIтипа— иммунокомплексныереакции
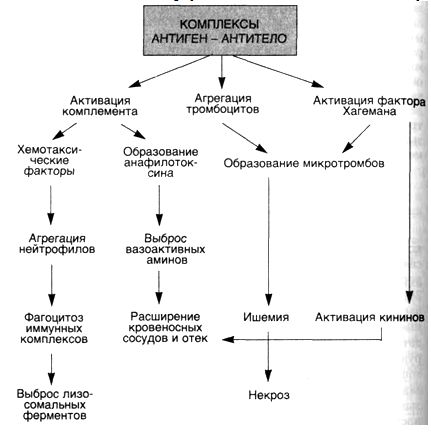
Системнаяиместнаяиммунокомплексная болезнь
Системная иммунокомплексная болезнь. Одной из ее разновидностей является острая сывороточная болезнь, которая часто возникает в результате многократного введения большого количества чужеродной сыворотки крови, используемой для пассивной иммунизации.
Патогенез системной иммунокомплексной болезни складывается из трех фаз:
▲образованиевкровикомплексов антиген — антитело;
▲осаждениеиммунныхкомплексоввразличныхтканях;
▲воспалительнаяреакциявразныхчастяхтела.
Перваяфазаначинаетсяспопаданияантигенавкровьиеговзаимодействиясиммунокомпетентнымиклетками, приводящегокобразованиюантител. Приблизительно через 5 дней после введения сыворотки вырабатываются антитела против ее компонентов, которые, еще находясь в кровотоке, образуют комплексы антиген — антитело. Во вторую фазу эти комплексы оседают в различных тканях. Дальнейшее течение болезни определяют два фактора: 1) размеры иммунных комплексов и 2) состояние системы моноцитарных фагоцитов (СМФ).
Очень крупные комплексы образуются при значительном избытке антител, быстро удаляются из кровотока клетками СМФ и относительно безвредны. Наиболее патогенны мелкие и средних размеров комплексы, которые образуются при незначительном избытке антител, дольше циркулируют и не так жадно захватываются фагоцитирующими клетками.
В связи с тем что СМФ в норме разрушает циркулирующие иммунные комплексы, ее перегрузка или существенная дисфункция увеличивает возможность персистенции иммунных комплексов в кровотоке и их осаждение в тканях.
Кроме того, такие факторы, как заряд иммунных комплексов (анионный или катионный полюс комплекса), валентность антигена, авидность антитела, аффинность антигена к компонентам различных тканей, трехмерная структура комплексов (решетка) и гемодинамические факторы, влияют на осаждение иммунных комплексов в тканях. Чаще всего иммунные комплексы оседают в почечных клубочках, а также в суставах, коже, сердце, серозных оболочках и мелких кровеносных сосудах.
Для того чтобы комплексы покинули систему кровообращения и осели в тканях, должна увеличиться проницаемость сосудистого русла. Во-первых, IgE-антитела, образовавшиеся вскоре после поступления в кровь антигена, связываются с циркулирующими базофилами, и происходит выброс гистамина и ФАТ. Эти медиаторы раздвигают эндотелиальные клетки, и иммунные комплексы проходят сквозь стенку сосудов. Как только иммунные комплексы оседают в тканях, они вызывают острую воспалительную реакцию. В эту фазу (приблизительно через 10 дней после введения антигена) наблюдаются клинические проявления болезни, такие как лихорадка, крапивница, артралгии, увеличение лимфатических узлов и протеинурия. Вслед за осаждением иммунных комплексов происходит активация системы комплемента с образованием его биологически активных компонентов.
Активация системы комплемента сопровождается провоспалительными эффектами: выбросом С3b-опсонина, способствующего фагоцитозу; образованием хемотаксических факторов, вызывающих миграцию полиморфно-ядерных лейкоцитов и моноцитов (С5, С5Ь67); выбросом анафилотоксинов (С3а и С5а), которые увеличивают проницаемость сосудов и вызывают сокращение гладких мышц; образованием мембраноатакующего комплекса (С5—9), вызывающего разрушение клеточных мембран и цитолиз.
Фагоцитоз комплексов антиген — антитело лейкоцитами приводит к выбросу или образованию различных дополнительных провоспалительных веществ, включая простагландины, сосудорасширяющие белки и хемотаксические вещества, например некоторые лизосомальные ферменты, в том числе протеазы, способные растворять базальную мембрану, коллаген, эластин и хрящ. Повреждение тканей опосредуется также свободными радикалами кислорода, продуцируемыми активированными нейтрофилами.
Иммунные комплексы вызывают агрегацию тромбоцитов и активацию фактора Хагемана, что приводит к усилению воспалительного процесса и образованию микротромбов. В результате развиваются васкулит, гломерулонефрит, артрит и т.п.
Все эти повреждения возникают при участии комплементсвязанных антител (IgG и IgM). Однако, так как IgA может активировать комплемент по альтернативному пути, IgA-содержащие комплексы также могут вызывать тканевые повреждения. Важная роль комплемента в патогенезе тканевых повреждений подтверждается наблюдением, что истощение комплемента в сыворотке крови (в эксперименте) обычно уменьшает выраженность повреждений.
В морфологической картине иммунокомплексного повреждения доминирует острый некротизирующий васкулит с образованием фибриноида и экссудацией нейтрофилов. Например, пораженные клубочки почки всегда увеличены вследствие набухания и пролиферации эндотелиальных и мезангиальных клеток, инфильтрации нейтрофилами и моноцитами. При иммунофлюоресцентной микроскопии иммунные комплексы видны в виде гранулярных депозитов иммуноглобулина и комплемента, а под электронным микроскопом — в виде электронно-плотных депозитов вдоль гломерулярной базальной мембраны. Если заболевание возникает после разовой массивной экспозиции антигена, например при остром постстрептококковом гломерулонефрите и острой сывороточной болезни, то все повреждения имеют тенденцию к разрешению благодаря катаболизму иммунных комплексов.
Для развития хронической иммунокомплексной болезни необходима постоянная антигенемия, так как иммунные комплексы чаще всего оседают в сосудистом русле. Это наблюдается при некоторых заболеваниях, таких, как системная красная волчанка, которая обусловлена персистенцией аутоантигенов. Часто, однако, несмотря на наличие характерных морфологических изменений и других признаков, свидетельствующих о развитии иммунокомплексной болезни, антиген остается неизвестным, например при ревматоидном артрите, узелковом периартериите, мембранозном гломерулонефрите и некоторых васкулитах.
Местная иммунокомплексная болезнь. Ее еще называют реакцией Артюса. Она заключается в местном некрозе ткани, возникающем вследствие острого иммунокомплексного васкулита. реакцию можно вызвать в эксперименте путем внутрикожного введения антигена иммунному животному, которое имеет циркулирующие антитела против антигена. Вследствие избытка антител, когда антиген проникает в стенки сосудов, образуются крупные иммунные комплексы, которые вызывают воспалительную реакцию. В отличие от IgE-опосредованных реакций гиперчувствительности I типа, которые возникают немедленно, реакция Артюса развивается в течение нескольких часов и достигает пика через А —10 ч после инъекции. При иммунофлюоресцентном окрашивании удается выявить комплемент, иммуноглобулины и фибриноген, осажденные в стенках сосудов, обычно венул; при светооптическом исследовании — фибриноидный некроз сосудов. Разрыв сосудов приводит к возникновению кровоизлияний, но чаще наблюдается тромбоз, способствующий развитию местных ишемических повреждений.
63. РЕАКЦИИГИПЕРЧУВСТВИТЕЛЬНОСТИIVТИПАИММУНОКЛЕТОЧНЫЕРЕАКЦИИ
Реакции гиперчувствительности IV типа вызывают специфически сенсибилизированные Т-лимфоциты. К реакциям этого типа относятся классические замедленные реакции гиперчувствительности, вызываемые СD4+Т-лимфоцитами, и прямая клеточная цитотоксичность, опосредованная СD8+Т-лимфоцитами. Это основной тип иммунного ответа на различные внутриклеточные патогенные агенты, особенно микобактерии туберкулеза, а также на многие вирусы, грибы, простейшие и паразиты. Другими примерами являются контактная кожная чувствительность к химическим веществам и реакция отторжения. Описаны два варианта реакций гиперчувствительности IV типа.
Гиперчувствительность замедленного типа (схема 29). Хорошо известным примером такого варианта является реакция на введенный внутрикожно туберкулин — белково-липополисахаридный компонент микобактерии туберкулеза. У сенсибилизированного пациента через 8—12 ч возникают покраснение и уплотнение в месте введения, а пик реакции наступает через 24—72 ч. сильно сенсибилизированных больных в месте инъекции может развиться некроз. Гиперчувствительность замедленного типа (ГЗТ) характеризуется накоплением мононуклеарных клеток в дерме и подкожной основе (подкожно-жировая клетчатка). Наблюдается преимущественное накопление клеток вокруг мелких вен и венул с образованием характерных периваскулярных манжеток. Увеличение сосудистой проницаемости сопровождается образованием пор между эндотелиальными клетками. Выход белков плазмы за пределы сосудистого русла увеличивает отек дермы и сопровождается оседанием фибрина в интерстиции. С помощью иммунопероксидазного метода в участках повреждений обнаруживается преобладание СD4+Т-лимфоцитов-хелпе-ров.
Схема 29. РеакциигиперчувствительностиIVтипа— гиперчувствительностьзамедленноготипа
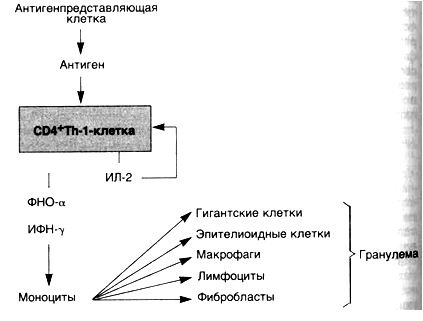
При персистенции антигена макрофаги часто трансформируются в эпителиоидные клетки, которые окружает вал из лимфоцитов — формируется гранулема. Такой тип воспаления характерен для реакций гиперчувствительности IV типа и называется гранулематозным воспалением.
Последовательность событий при ГЗТ можно рассмотреть на примере туберкулиновой реакции, которая начинается с первой встречи индивидуума с микобактериями туберкулеза. CD4+T-лимфоциты распознают белки туберкулезной микобактерий, связанные с молекулами II класса на поверхности моноцитов или других антигенпредставляющих клеток. Эта первая встреча вызывает дифференцировку СD4+Т-клеток в Th-1-клетки. Образование Th-1 -клеток является важным звеном в патогенезе ГЗТ, так как ее дальнейшее развитие зависит от цитокинов, которые секретируются Th-1-клетками. У неиммунизированного хозяина микроорганизмы впервые подвергаются атаке макрофагами, что приводит в некоторых случаях к продукции ИЛ-12. Этот цитокин регулирует дифференцировку СD4+Т-клеток в Th-1. Таким образом, развитие ГЗТ может быть связано с продукцией ИЛ-12. Сенсибилизированные Th-1-клетки поступают в кровоток и остаются там длительное время, иногда годами. В ответ на инъекцию туберкулина индивидууму, который имел раньше контакт с микобактериями туберкулеза, сенсибилизированные Th-1-клетки взаимодействуют с антигеном на поверхности антигенпредставляющих клеток и активируются, например подвергаются бласттрансформации и пролиферации. Эти изменения сопровождаются секрецией цитокинов, ответственных за ГЗТ.
ИФН-7 является наиболее важным медиатором ГЗТ и сильным активатором макрофагов. Активированные макрофаги обладают способностью к фагоцитозу и уничтожают микроорганизмы. На поверхности макрофагов имеются молекулы II класса, с помощью которых они способствуют представлению антигена. Возрастает их активность, направленная на элиминацию опухолевых клеток. Макрофаги секретируют некоторые полипептидные факторы роста, такие как тромбоцитарный фактор роста и трансформирующий фактор роста. Последний стимулирует пролиферацию фибробластов и усиливает синтез коллагена. Таким образом, активированные макрофаги обеспечивают элиминацию антигена, а если активация продолжается, то способствуют развитию фиброза и его отграничению.
ИЛ-2 вызывает аутокринную и паракринную пролиферацию Т-клеток, которые аккумулируются в местах развития ГЗТ, причем включение в инфильтрат антигенспецифических CD4+T-лимфоцитов активируется ИЛ-2.
ФНО-а и лимфотоксин являются цитокинами, оказывающими воздействие на эндотелиальные клетки. Повышенная секреция простациклина эндотелиальными клетками приводит к увеличению кровотока в результате вызываемого им расширения сосудов. Наблюдается усиление экспрессии адгезивной молекулы Е-селектина (ELAM-1), что способствует прикреплению пришлых лимфоцитов и моноцитов. Происходит усиление секреции низкомолекулярных хемотаксических факторов, например ИЛ-8. Все эти изменения в эндотелии способствуют выходу лимфоцитов и моноцитов за пределы сосудистого русла в места развития реакции ГЗТ. ФНО-а также играет важную роль в образовании гранулем.
Этот тип гиперчувствительности является главным механизмом защиты от различных внутриклеточных патогенных агентов, включая микобактерии, грибы и некоторых паразитов, а также может участвовать в отторжении трансплантата и опухолевом иммунитете.
Цитотоксичность, опосредованная Т-лимфоцитами. При данной цитотоксичности сенсибилизированные СD8+Т-лимфоциты уничтожают клетки-мишени, которые являются носителями антигена. Такие эффекторные клетки называют цитотоксическими Т-лимфоцитами (ЦТЛ). Т-лимфоциты, направленные против антигенов гистосовместимости на поверхности клеток, играют важную роль в отторжении трансплантата. Они также участвуют в защите от вирусных инфекций. В клетках, пораженных вирусом, вирусные пептиды связываются с молекулами I класса и в виде комплексов транспортируются к поверхности клетки. Этот комплекс распознается CD8+ЦТЛ. Лизис зараженных клеток завершается до репликации вируса, что приводит к уничтожению инфекции. Полагают, что многие опухолевые антигены также могут быть представлены на поверхности клеток, а ЦТЛ могут участвовать и в противоопухолевом иммунитете.
Отторжениетрансплантата
В отторжении трансплантата принимают участие некоторые реакции гиперчувствительности (схема 30). Реакция отторжения зависит от распознавания хозяином пересаженной ткани как чужеродной. Антигенами, ответственными за такое отторжение у человека, являются антигены главного комплекса гистосовместимости (HLA). Отторжение трансплантата — сложный процесс, во время которого имеют значение как клеточный иммунитет, так и циркулирующие антитела.
Схема 30. Отторжениетрансплантата
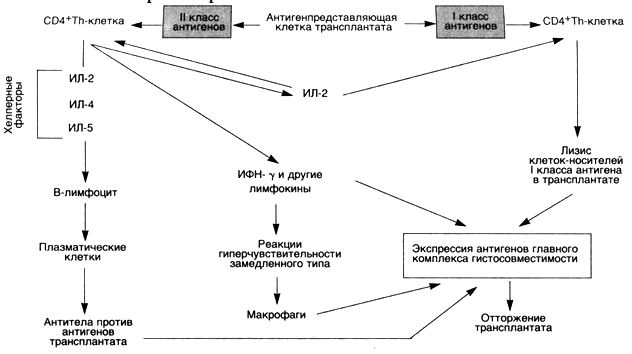
Реакции, обусловленные Т-лимфоцитами. Активированные СD4+Т-хелперы участвуют в активации CD8+ ЦТЛ. Развитие реакций, опосредованных Т-лимфоцитами, происходит при встрече лимфоцитов реципиента с антигенами HLA донора. Полагают, что наиболее важными иммуногенами являются дендритические клетки в донорских органах. Т-клетки хозяина встречаются с дендритическими клетками в пересаженном органе, а затем мигрируют в регионарные лимфатические узлы. Предшественники СШ+ЦТЛ (прекиллеры Т-клеток), обладающие рецепторами к HLA-антигенам I класса, дифференцируются в зрелые ЦТЛ. Процесс дифференцировки сложен и не совсем понятен. В нем участвуют антигенпредставляющие клетки, Т-лимфоциты и цитокины ИЛ-2, ИЛ-4 и ИЛ-5. Зрелые ЦТЛ лизируют пересаженную ткань. Кроме специфических ЦТЛ, образуются лимфокинсекретирующие СО4+Т-лимфоциты, которые играют исключительно важную роль в отторжении трансплантата. Как и при замедленной реакции гиперчувствительности, активированные СО4+Т-лимфоциты выделяют цитокины, вызывающие повышение сосудистой проницаемости и местное скопление мононуклеарных клеток (лимфоцитов и макрофагов). Считают, что ГЗТ, проявляющаяся повреждением микрососудов, ишемией и деструкцией тканей, является наиболее важным механизмом деструкции трансплантата. Более вероятно, однако, что относительная важность цитотоксичности, связанной с СБ8+Т-лимфоцитами, по сравнению с реакциями, обусловленными СО4+Т-лимфоцитами, зависит от природы несоответствия HLA донора и HLA реципиента.
Реакции, обусловленные антителами. Эти реакции могут протекать в двух вариантах. Сверхострое отторжение развивается в том случае, если в крови реципиента имеются антитела против донора. Такие антитела могут встречаться у реципиента, у которого уже было отторжение трансплантата. Предшествующие переливания крови от HLA-неидентифицированных доноров также могут привести к сенсибилизации вследствие того, что тромбоциты и лейкоциты особенно богаты HLA-антигенами. В таких случаях отторжение развивается немедленно после трансплантации, так как циркулирующие антитела образуют иммунные комплексы, которые оседают в эндотелии сосудов пересаженного органа. Затем происходит фиксация комплемента и развивается реакция Артюса.
У реципиентов, которые не были предварительно сенсибилизированы к антигенам трансплантата, экспозиция донорских HLA-антигенов I и II класса сопровождается образованием антител. Антитела, образованные реципиентами, могут вызывать повреждение с помощью нескольких механизмов, в том числе комплементзависимой цитотоксичности, антителозависимого, обусловленного клетками цитолиза и выпадения комплексов антиген — антитело. Изначально мишенью для этих антител служат сосуды трансплантата, поэтому феномен антителозависимого отторжения (например, в почке) представлен васкулитом.
64. Иммунодефициты — это нарушения нормального иммунного статуса, обусловленные дефектом одного или нескольких механизмов иммунного ответа.
Различают первичные, или врожденные (генетические), и вторичные, или приобретенные, иммунодефициты.
Первичные, или врожденные, иммунодефициты.
В качестве первичных иммунодефицитов выделяют такие состояния, при которых нарушение иммунных гуморальных и клеточных механизмов связано с генетическим блоком, т. е. генетически обусловлено неспособностью организма реализовывать то или иное звено иммунологической реактивности. Расстройства иммунной системы могут затрагивать как основные специфические звенья в функционировании иммунной системы, так и факторы, определяющие неспецифическую резистентность. Возможны комбинированные и селективные варианты иммунных расстройств. В зависимости от уровня и характера нарушений различают гуморальные, клеточные и комбинированные иммунодефициты.
Врожденные иммунодефицитные синдромы и заболевания представляют собой довольно редкое явление. Причинами врожденных иммунодефицитов могут быть удвоение хромосом, точечные мутации, дефектферментов обмена нуклеиновых кислот, генетически обусловленные нарушения мембран, повреждения генома в эмбриональном периоде и др. Как правило, первичные иммунодефицита проявляются на ранних этапах постнатального периода и наследуются по аутосомно-рецессивному типу. Проявляться первичные иммунодефициты могут в виде недостаточности фагоцитоза, системы комплемента, гуморального иммунитета (В-системы), клеточного иммунитета (Т-системы) или же в виде комбинированной иммунологической недостаточности.
Вторичные, или приобретенные, иммунодефициты
Вторичные иммунодефициты в отличие от первичных развиваются у лиц с нормально функционировавшей от рождения иммунной системой. Они формируются под воздействием окружающей среды на уровне фенотипа и обусловлены нарушением функции иммунной системы в результате различных заболеваний или неблагоприятных воздействий на организм. При вторичных иммунодефицитах могут поражаться Т- и В-системы иммунитета, факторы неспецифической резистентности, возможны также их сочетания. Вторичные иммунодефициты встречаются значительно чаще, чем первичные. Вторичные иммунодефицита, как правило, преходящи и поддаются иммунокоррекции, т. е. восстановлению нормальной деятельности иммунной системы.
Вторичные иммунодефицита могут быть: после перенесенных инфекций (особенно вирусных) и инвазий (протозойные и гельминтозы); при ожоговой болезни; при уремии; при опухолях; при нарушении обмена веществ и истощении; при дисбиозах; при тяжелых травмах, обширных хирургических операциях, особенно выполняемых под общим наркозом; при облучении, действии химических веществ; при старении, а также медикаментозные, связанные с приемом лекарств.
По времени возникновения выделяют антенатальные (например, ненаследственные формы синдрома ДиДжорджи), перинатальные (например, нейтропения новорожденного, вызванная изосенсибилизацией матери к антигенам нейтрофилов плода) и постнатальные вторичные иммунодефицита.
По клиническому течению выделяют компенсированную, субкомпенсированную и декомпенсированную формы вторичных иммунодефицитов. Компенсированная форма сопровождается повышенной восприимчивостью организма к инфекционным агентам, вызывающим оппортунистические инфекции. Субкомпенсированная форма характеризуется склонностью к хронизации инфекционных процессов. Декомпенсированная форма проявляется в виде генерализованных инфекций, вызванных условно-патогенными микробами (УПМ) и злокачественными новообразованиями.
Известно разделение вторичных иммунодефицитов на:
Физиологические, новорожденные,пубертатного периода, беременности и лактации,старения,биоритмичности,экологические, сезонные, эндогенные интоксикации, радиационные,СВЧ, патологические, постинфекционные, стрессовые, регуляторно-метаболические, медикаментозные, онкологические.
Иммунодефициты, как первичные, так иособенно вторичные, широко распространены среди людей. Они являются причиной проявления многих болезней и патологических состояний, поэтому требуют профилактики и лечения с помощью иммунотропных препаратов.
65. Онкопатология занимает второе место после сердечно-сосудистых заболеваний среди причин смерти в цивилизованных странах. Опухоли (новообразования) возникают, когда по каким-либо причинам наблюдается неконтролируемая избыточная пролиферация клеток. Обычно во всех органах и тканях поддерживается баланс между процессами гибели клеток и их новообразованием. Это обеспечивается механизмами контроля и регуляции гомеостаза тканей.
Главной отличительной особенностью опухолевых клеток от нормальных является способность к неограниченному росту и потеря механизмов аутокринной и паракринной регуляции. Для злокачественных клеток также характерна инвазия окружающих тканей и метастазирование в отдаленные участки организма. Распространение опухолевых клеток происходит по лимфатическим путям и через кровоток.
Опухоли способны возникать спонтанно, без видимых на то причин, а также могут быть индуцированы. У человека, как правило, появляющиеся опухоли – это спонтанные, хотя отличить спонтанно возникшую опухоль от индуцированной чрезвычайно трудно. Опухоли, искусственно вызванные, называются индуцированными. Индуцировать канцерогенез способны различные химические вещества (метилхолантрен, бензпирен, афлатоксин В1), физические факторы (ультрафиолетовый свет, ионизирующая радиация), вирусы (папова-, герпес-, адено- и ретровирусы). У человека 3 типа вирусов тесно связаны с опухолями, это вирус Эпштейна-Барр (лимфома Беркита), цитомегаловирус (саркома Капоши) и вирус папилломы.
Иммунологические исследования показали, что на опухолевых клетках могут быть представлены два вида антигенов: опухолеспецифические антигены и опухолеассоциированные антигены. Опухолеспецифические антигены являются уникальными молекулами для организма и не присутствуют ни в один из периодов развития, в том числе и эмбриональный, на нормальных клетках организма. Полагают, они являются результатом мутаций в геноме опухолевых клеток, приводящих к формированию новых клеточных белков, которые, подвергаясь процессингу в цитозоле клетки, дают начало опухолевым пептидам, представленным на клеточной поверхности в комплексе с молекулами HLA-1 класса. Опухолеассоциированные белки (антигены), в свою очередь, не являются строго специфическими для опухолевых клеток, и, как правило, являются белками, которые были экспрессированы на нормальных клетках в эмбриональный период или являются молекулами, которые экспрессированы обычно на нормальных клетках, но в очень малых количествах, а при злокачественной трансформации клеток экспрессируются в высокой плотности. Реэкспресия эмбриональных генов или чрезмерная активация регуляторных генов в нормальных зрелых клетках, вероятно, является результатом тех изменений, которые происходят в геноме при злокачественной трансформации клеток. Известные к настоящему времени некоторые опухолеспецифические антигены суммированы в таблицах
Исследования показали, что гены, кодирующие опухолеспецифические антигены, часто отличаются от нормальных генов только одной точечной мутацией. Преобладающее большинство опухолевых антигенов не являются мембранными белками клеток, а представляют собой пептиды, прошедшие процессинг в цитозоле клетки и представленные молекулами HLA- 1 класса
Специфические антигены вирусиндуцированных опухолей, как правило, представлены вирусными пептидами. Это подтверждается множеством данных. Так, установлено, что отдельный штамм вируса (например, SV-40)индуцирует одинаковые опухолевые антигены на различных тканях и у различных видов организмов. Эти антигены одинаковы для всех трансформированных клеток. Другой пример – мыши, которым были ранее введены убитые клетки из опухоли, индуцированной вирусом полиомы, при повторном введении им живых клеток любой другой опухоли, индуцированной этим же вирусом, способны элиминировать их с помощью иммунных механизмов. Более того, при переносе лимфоцитов от животных с вирус-индуцированной опухолью нормальным сингенным животным, у последних развивалась невосприимчивость к трансплантатам всех опухолей, индуцированных тем же вирусом. У человека клетки лимфомы Беркета экспрессируют ядерный антиген вируса Эпштейн-Барра, который, как полагают, является опухолеспецифическим для этого вида опухоли. На раковых клетках шейки матки более чем в 90% случаев выявляются белки Е6 и Е7 вируса папилломы человека (HPV).
Опухолеассоциированные белки (антигены) не являются уникальными для опухолевых клеток. Они представлены антигенами двух типов. Представителями первого типа являются раково-эмбриональные антигены. Из них наиболее изучены альфа-фетопротеин (АФП) и раковоэмбриональный антиген (РЭА). Эти антигены (белки) появляются в норме в эмбриональном периоде развития индивидуума и участвуют как регуляторные белки в дифференцировке тканей и развитии органов.
Альфа-фетопротеин впервые был обнаружен в фетальной сыворотке теленка. Он вырабатывается преимущественно гепатоцитами, а также клетками желудочно-кишечного тракта. Представляет собой гликопротеин м.м. 70 кD. У плода человека его концентрация составляет 3000 мкг/мл, у взрослого 0,02 мкг/мл. Повышение содержания АФП в сыворотке больного в 80 % случаев свидетельствует о первичном раке печени. Повышение концентрации АФП может также выявляться у 20% лиц, страдающих гепатитом и циррозом печени. Повышение его количества во время беременности может служить сигналом нарушения развития плода.
Раково-эмбриональный антиген (РЭА) является мембранным гликопротеином. Экспрессируется в норме на гастроинтестинальных клетках и клетках печени плода на 2-6 месяце внутриутробного развития. У взрослых в норме не выявляется. Его появление в сыворотке свидетельствует с 90% вероятностью о карциноме толстой кишки, а также карциноме поджелудочной железы.
Другая категория опухолеассоциированных белков, как правило, представлена факторами роста и рецепторами для этих факторов. Известно, что рецепторы к факторам роста в повышенной плотности почти всегда экспрессированы на опухолевых клетках. Например, различные опухолевые клетки экспрессируют в 100 раз больше рецепторов к эпидермальному фактору роста, чем нормальные клетки. Клетки рака груди человека в повышеном количестве продуцируют белок HER2, кодируемый онкогеном Neu, являющийся структурным компонентом рецептора эпидермального фактора роста. На нормальных клетках этот белок экспрессируется в следовых количествах. Клетки меланомы экспрессируют порядка 50 000 – 500 000 молекул белка р97, участвующего в транспорте железа в клетку. На обычной клетке этих молекул содержится порядка 8 000.
Следует заметить, что тип опухолевых антигенов определяет иммуногенность и антигенность опухолей.
66. Аутоиммунные заболевания — это класс разнородных по клиническим проявлениям заболеваний, развивающихся вследствие патологической выработки аутоиммунных антител или размножения аутоагрессивных клонов киллерных клеток против здоровых, нормальных тканей организма, приводящих к повреждению и разрушению нормальных тканей и к развитию аутоиммунного воспаления.
Дата добавления: 2014-12-12 | Просмотры: 1497 | Нарушение авторских прав
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|






