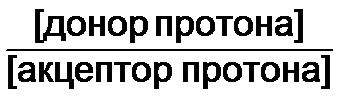|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Уравнение буферной системыУравнение буферной системы выражает зависимость рН буферного раствора от состава буферной системы. рН = рК а – ℓg Анализ уравнения показывает, что величина рН буферного раствора зависит от природы веществ, образующих буферную систему, соотношения концентраций компонентов и температуры (т.к. от нее зависит величина рК а). Для кислотной буферной системы рН зависит от показателя константы диссоциации слабой кислоты рК а и отношения концентраций акцептора протона (соли) и донора протона (кислоты) в растворе. Для основной буферной системы рН зависит от величины рК а сопряженной кислоты данного основания и отношения концентраций акцептора протона (основания) и донора протона (соли) в растворе. При разбавлении буферных растворов концентрации всех компонентов уменьшаются. Но так как они изменяются одинаково, то их отношение остается неизменным. Величина константы диссоциации слабого электролита не изменяется при разведении. Поэтому рН буферного раствора, согласно уравнению, при разбавлении не меняется. (В действительности это наблюдается до тех пор, пока концентрация компонентов буферных растворов не станет меньше 0,01 моль/л). Добавление небольших количеств сильной кислоты или щелочи в буферный раствор моментально вызывает защитную реакцию протолитической буферной системы по поддержанию постоянного значения рН среды. Это происходит за счет связывания добавляемых ионов Н + или ОН – соответствующими компонентами буферной системы с образованием малодиссоциирующих соединений. Катионы Н + связываются акцептором протона буферной системы, анионы ОН – связываются донором протона. Активная кислотность (АК) характеризуется концентрацией свободных ионов водорода в растворе. Потенциальная кислотность (ПК) - кислотность, обусловленная наличием в растворе недиссоциированных молекул кислоты. Общая кислотность (ОК) учитывает активную и потенциальную кислотности.
Дата добавления: 2014-05-20 | Просмотры: 1085 | Нарушение авторских прав |