|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Иммунотерапия опухолейИсследования механизмов естественного и адаптивного противоопухолевого иммунитета легли в основу нескольких серьезных попыток иммунотерапии спонтанных опухолей человека и животных с помощью активированных компонентов преимущественно системы врожденного иммунитета (макрофаги, NK-клетки), но также в смеси с Т-лимфоцитами (LAK-клетки-limphokin-activated killers, TIL-клетки – tumor-infiltrated lymphocytes). LAC-клетки больных выращиваемые в огромных количествах in vitro в присутствии ИЛ-2 или большие дозы только ИЛ-2 вводились пациентам с запущенными формами рака. При этом в отдельных случаях наблюдалась частичная регрессия первичной опухоли и её метастазов. Однако ограниченный и, как правило, временный успех, тяжелейшие осложнения (почти непереносимость) такой терапии, её индивидуальный характер и исключительная дороговизна сделали невозможным дальнейшее использование этого метода. Затем в качестве альтернативного источника более цитотоксичных эффекторных клеток позднее были предложены TIL-клетки, размножаемые в присутствии ИЛ-2; такие клетки обладают в 100 раз более высоким уровнем цитотоксического действия на опухоль и, следовательно, могут быть введены в меньших дозах. Однако применение и этого материала для иммунотерапии опухолей оказалось недостаточно эффективным. Многочисленные попытки использования активированных макрофагов, естественных и Т-киллеров, а также дендритных клеток для иммунотерапии опухоли, начатые еще в 60-е гг., продолжаются и усовершенствуются до настоящего времени. В последние годы для этих целей предложены различные способы активации макрофагов, дендритных клеток и NK-клеток in vivo.
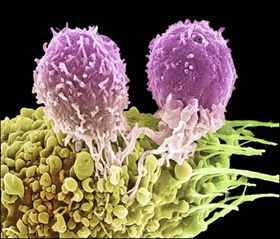
Рисунок 1.Опухолевая клетка и Т-лимфоциты киллеры.
Несколько более широкое применение получило сочетание неспецифической иммунотерапии опухоли (в частности, введение некоторых цитокинов) с другими методами лечения онкологических больных. При некоторых формах лейкоза у детей, а также при раке почки человека, использование α-интерферона отдельно, а также в сочетании с химиотерапией, оказалось эффективным у некоторых из таких пациентов. Ряд ранних публикаций о классическом успехе применения вакцины БЦЖ для неспецифической иммунотерапии опухолей человека не были подтверждены при последующих испытаниях и, более того, в эксперименте на животных было показано, что введение БЦЖ подавляет адаптивный противоопухолевый иммунитет. Специфическая иммунизация против опухоли может быть эффективна лишь при определенных ограничивающих условиях: а) в период, когда опухолевых клеток в организме очень мало и все они иммуночувствительны, то есть экспрессируют СТОА; б) если в момент иммунизации иммунная система хозяина не подавленна (способна к ответу); в) если имеется соответствующий препарат для эффективной иммунизации. Очевидно, что такие условия в лучшем случае складываются лишь до появления опухоли, на самом раннем этапе первичного опухолевого процесса, индуцируемого известным онкогенным вирусом, что возможно только в эксперименте на животных. Для спонтанных опухолей эти условия реализовать невозможно, поскольку этиология индивидуальных опухолей и стадия канцерогенеза (до момента возникновения опухоли) остаются неизвестными. Для естественного предотвращения таких опухолей представляется важным сохранение функциональной активности всех типов эффекторов системы врожденного естественного противоопухолевого иммунитета. Таким образом, на сегодняшний день существует два основных направления биотерапии опухолей: специфическая иммунотерапия и неспецифическая иммунотерапия. К специфической иммунотерапии относится использование противоопухолевых вакцин и моноклональных антител к конкретному виду опухолей или факторов роста клеток. Высокая эффективность моноклональной терапии связана с механизмами действия антител. Оказалось, что МКА к определенным антигенам способны не только вызывать иммуно–опосредованную (антитело– и комплемент–зависимую) цитотоксичность, но и непосредственно вызывать апоптоз в клетках–мишенях. Примером подобного препарата является Эрбитукс( Цетуксимаб), который представляет собой химерное моноклональное антитело IgGl, направленное против рецептора эпидермального фактора роста (РЭФР). Сигнальные пути РЭФР контролируют выживание клетки, развитие клеточного цикла, ангиогенез, миграцию клеток и клеточные инвазии/метастазы. Цетуксимаб связывается с РЭФР с афинностью, приблизительно в 5–10 раз превышающую характерную для эндогенных лигандов. Цетуксимаб блокирует связывание эндогенных лигандов РЭФР, что приводит к ингибированию функций рецепторов. Цетуксимаб также сенсибилизирует цитотоксические иммунные эффекторные клетки по отношению к экспрессирующим РЭФР опухолевым клеткам (зависимая от антител клеточно-опосредованная цитотоксичность (ЗАКЦ)).В опытах in vitro и in vivo цетуксимаб ингибирует пролиферацию и индуцирует апоптоз опухолевых клеток человека, которые экспрессируют РЭФР. In vitro цетуксимаб ингибирует продукцию ангиогенных факторов в опухолевых клетках и блокирует миграцию эндотелиальных клеток. In vivo цетуксимаб ингибирует продукцию ангиогенных факторов в опухолевых клетках и снижает активность неоваскуляризации и метастазирования опухолей.В настоящее время в арсенале врача находятся более 10 препаратов на основе моноклональных антител. Наиболее известные из них – Мабтера, Герцептин, Авастин и другие. Успешные испытания препаратов направленного действия на основе МКА и низкая токсичность большинства из них позволяют надеяться на скорое появление в клинической практике высокоэффективных препаратов, способных не только увеличить эффективность лечения и продолжительность жизни, но и значительно улучшить качество жизни больных злокачественными новообразованиями.
Дата добавления: 2014-12-12 | Просмотры: 1042 | Нарушение авторских прав |