 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Механизмы мышечного сокращения
Вверху слева - к головке миозина присоединилась АТФ. Этап 1. АТФазный участок головки миозина гидролизует АТФ, и головка переходит в активированное состояние (вверху справа). Однако если концентрация Са2+ в цитоплазме низка, то поперечный мостик не возникает - тропомиозин закрывает активный центр актина. Этап 2. Соединение Са2+ с тропонином С приводит к открыванию активного центра, и тогда возникает поперечный мостик (активный комплекс, внизу справа). Этап 3. При отсоединении от головки миозина АДФ осуществляется "гребковое движение" - головка сгибается, нить актина скользит относительно нити миозина, и происходит сокращение. Именно на этом этапе энергия, запасенная при расщеплении АТФ, преобразуется в механическую энергию. При этом образуется низкоэнергетический, так называемый ригорный комплекс (rigor mortis - трупное окоченение) (внизу слева). Этап 4. Присоединение к головке миозина АТФ ведет к распаду мостика, цикл завершается. Далее он повторяется, пока Са2+ связан с тропонином С. Когда же Са2+ удаляется обратно в саркоплазматический ретикулум, мышца расслабляется, а головки миозина переходят в активированное состояние. Ф - фосфат. Сокращение мышечного волокна происходит при поступлении по аксонам двигательных нейронов к нервно-мышечным синапсам волны возбуждения в виде нервных импульсов (потенциалы действия нервных волокон). Это непрямое сокращение, оно опосредовано нервно-мышечной синаптической передачей возбуждения. Возможно и прямое сокращение мышцы. Под ним понимают сокращение групп мышечных волокон, происходящее при возбуждении любого звена последовательности событий после секреции нейромедиатора из терминалей аксона в нервно-мышечном синапсе. Прямое сокращение мышцы (например, мышечные подёргивания, или фибрилляции) — всегда патология. скелетные мышцы иннервируются спинно-мозговыми и черепными нервами. Каждое мышечное волокно иннервируется аксоном или его ветвью. Двигательный аксон несет импульс к сокращению мышцы, при этом он контактирует с сарколеммой, образуя синапсоподобное нервно-мышечное окончание. Нервный импульс передается по Т-трубочкам, а с них на конечные цистерны саркоплазматической сети, вызывая изменение проницаемости последних, что ведет к выходу ионов кальция в цитоплазму. Это приводит к взаимодействию актина с миозином и мышечному сокращению. Согласно теории X. Хэксли и Т. Хэнсона, мышечное сокращение - это результат скольжения тонких (актиновых) филаментов относительно толстых (миозиновых), благодаря чему длина филаментов диска А изменяется, в то время как диск I уменьшается в размерах и исчезает. В осуществлении мышечного сокращения принимают участие несколько белков: актин, миозин, тропо-миозин и тропонин (рис. 125). В основе мышечного сокращения лежит взаимодействие между актином и миозином. Источником движущейся силы мышечного сокращения является освобождение энергии в результате гидролиза АТФ, катализируемого миозином, который является актин-зависимой АТФ-азой. Этим свойством обладают миозиновые "головки" только при условии их активации Са2+. Напомним, что благодаря наличию в молекуле миозина двух "шарнирных" устройств "головки" могут сгибаться, прикрепляясь к актину и подтягивая актиновые филаменты на 10 нм. Это возможно благодаря тому, что белок актинин, расположенный в области линии Z, закрепляет концы тонких (актиновых) миофиламентов. Скелетные мышцы иннервируются спинно-мозговыми и черепными нервами. Каждое мышечное волокноиннервируется аксоном или его ветвью. Двигательный аксон несет импульс к сокращению мышцы, при этом он контактирует с сарколеммой, образуя синапсоподобное нервно-мышечное окончание. Нервный импульс передается по Т-трубочкам, а с них на конечные цистерны саркоплазматической сети, вызывая изменение проницаемости последних, что ведет к выходу ионов кальция в цитоплазму. Это приводит к взаимодействию актина с миозином и мышечному сокращению. Согласно теории X. Хэксли и Т. Хэнсона, мышечное сокращение - это результат скольжения тонких (актиновых) филаментовотносительно толстых (миозиновых), благодаря чему длина филаментов диска А изменяется, в то время как диск I уменьшается в размерах и исчезает. В осуществлении мышечного сокращения принимают участие несколько белков: актин, миозин, тропо-миозин и тропонин (рис. 125). В физиологии мышц термин "сокращение" не обязательно следует понимать как "укорочение"; прежде всего имеется в виду активация поперечных мостиков - участков генерирования силы в мышечном волокне. После сокращения механизм, инициирующий развитие силы, выключается, напряжение (tension) уменьшается и мышечное волокно расслабляется. Дата добавления: 2015-02-02 | Просмотры: 1622 | Нарушение авторских прав |
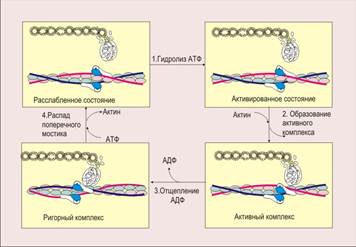 Механизм мышечного сокращения (упрощенно разбит на 4 этапа).
Механизм мышечного сокращения (упрощенно разбит на 4 этапа).