|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
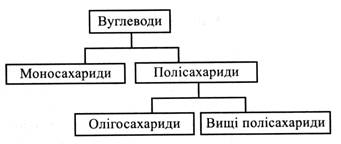
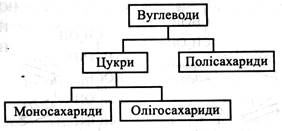
Загальна характеристика. ФункціїВуглеводи – важливий клас природних органічних сполук. Особливо високим вмістом вуглеводів відрізняються рослинні організми (до 85 – 90 % від маси рослини). Вуглеводи у великій кількості накопичуються в запасаючих органах (насіння, бульби, корені), оболонки рослинних клітин майже цілком складаються з вуглеводів. Учені підрахували, що в природі вуглеводів більше, ніж усіх інших органічних сполук, разом узятих. Функції вуглеводів у рослині важливі та різноманітні: 1. Енергетична. Вуглеводи є головними продуктами фотосинтезу, у хімічних зв'язках яких запасається сонячна енергія. Ця енергія здобувається рослинами при диханні та використовується у процесах їхньої життєдіяльності. 2. Пластична. У процесі дихання з універсальної хімічної сполуки – глюкози утворюються різні метаболіти (вуглецеві скелети), необхідні для синтезу величезної кількості різноманітних органічних сполук живої клітини. 3. Опорна (структурна). Клітинні оболонки складаються вуглеводів. Вони є опорою як для окремих клітин, так і для рослин у цілому. 4. Запасна. Вуглеводи (крохмаль, цукри, інулін, геміцелюлози) є найважливішими запасними речовинами рослин. Вони накопичуються у насінні, плодах, коренях, бульбах, кореневищах і використовуються при проростанні насіння, розпусканні листків тощо. 5. Осмотична. Цукри, розчинені у клітинному соку, беруть участь у створенні його концентрації, тобто осмотичних властивостей рослинної клітини. 6. Регуляторна. Наприклад, зв'язування з цукрами знижує активність фітогормонів, що регулюють процеси життєдіяльності рослин. 7. Сигнальна. Наприклад, вважається, що деякі білки – глікопротеїди (лектини), до складу молекул яких входять моно- і олігосахариди, беруть участь у розпізнанні патогену, що проникає в клітину. 8. Захисна. Ця функція виявляється, наприклад, при стресі. Розчинні цукри зв'язують воду, утримуючи її в клітині, та з'єднуються з білками і нуклеїновими кислотами, стабілізуючи їхні молекули у несприятливих умовах. Термін «вуглеводи» було введено у 1844 р. професором Юр'ївського університету Карлом Шмідтом. У той час вважали, що всі сполуки цього класу складаються з вуглецю, водню та кисню і що водень та кисень у їх молекулах міститься в тому ж співвідношенні, що й у воді, тобто 2:1. Пізніше з'ясували, що, дійсно, таке співвідношення водню і кисню характерне для більшості вуглеводів (наприклад, глюкоза – С6Н12О6, сахароза – С12Н22О11). Однак виявилося, що існує цілий ряд сполук, які за своїми властивостями належать до вуглеводів, але мають інше співвідношення водню і кисню (наприклад, рамноза – С6Н12О5, дезоксирибоза – С5Н10О4). У 1927 р. Міжнародна комісія з реформи хімічної номенклатури запропонувала замінити назву «вуглеводи» терміном «глюциди» (або «гліциди»), що підкреслює першорядне значення глюкози в утворенні багатьох біологічно важливих вуглеводів. Однак він не набув поширення, тому термін «вуглеводи» зберігається в науці як назва даного класу сполук. Пізніше були виявлені вуглеводи, до складу яких, крім вуглецю, водню і кисню, входить також азот. Наприклад, глюкозамін, галактозамін. Класифікація Усі вуглеводи поділяють на дві групи: моносахариди і полісахариди. Останні, у свою чергу, також поділяють на дві групи: олігосахариди і вищі полісахариди. Іноді в біохімії рослин олігосахариди називають полісахаридами 1-го порядку, а вищі полісахариди – полісахаридами 2-го порядку.
Моносахариди (монози) – це прості цукри, молекули яких не гідролізуються до ще простіших цукрів. Моносахариди, з’єднуючись один з одним, утворюють більш складні вуглеводи полісахариди (поліози). Олігосахариди мають у молекулі від двох до десяти залишків моносахаридів, вищі полісахариди – десятки, сотні та тисячі залишків. Моносахариди та олігосахариди зазвичай розчиняються у воді й мають більш-менш солодкий смак. їх об'єднують в одну групу – цукри. На цьому ґрунтується ще одна класифікація вуглеводів.
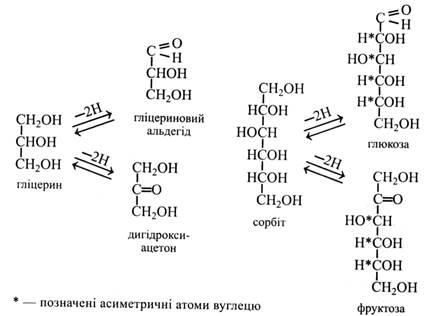
До моносахаридів належать глюкоза, фруктоза, ксилоза, рибоза тощо, до олігосахаридів – сахароза, мальтоза, трегалоза, рафіноза та ін. Вищі полісахариди є високомолекулярними сполуками. Як правило, вони не розчиняються у воді або утворюють колоїдні розчини. Це – крохмаль, інулін, целюлоза, ліхенін тощо. Моносахариди Структура молекул. Моносахариди – це сполуки, що містять одночасно гідроксильні групи (-он) та альдегідну (–СОН) або кетонну (=С=О) Моносахариди утворюються в результаті окислення багатоатомних спиртів. При окисленні первинної спиртової групи (–СН2ОН) утворюються альдози, а при окисленні вторинної спиртової групи (–СНОН) – кетози. Утворення найпростіших моносахаридів – тріоз: гліцеринового альдегіду і дигідроксиацетону можна розглянути на прикладі окислення (дегідрування) триатомного спирту гліцерину. При окисленні шестиатомного спирту сорбіту, що міститься у багатьох плодах, утворюються гексози – глюкоза або фруктоза.
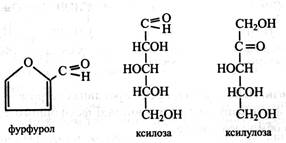
У назвах альдоз використовується суфікс «-оза» (глюкоза, галактоза, рибоза, ксилоза), а у назвах кетоз – суфікс «-улоза» (рибулоза, ксилулоза, седогептулоза). Значний внесок у вивчення будови і перетворення вуглеводів, особливо моносахаридів, зробив великий німецький вчений-хімік Еміль Фішер. Ним також були запропоновані лінійні формули моносахаридів. Глюкоза, фруктоза та інші моносахариди містять асиметричні атоми вуглецю, у яких усі 4 валентності заміщені різними атомами і групами. Це визначає їхню оптичну активність, тобто здатність в розчині обертати площину поляризації праворуч (+) або ліворуч (–), а також наявність стереоізомерів, що розрізняються за своїми фізичними і хімічними властивостями. Кількість стереоізомерів даного моносахариду дорівнює 2n, де n – число асиметричних атомів вуглецю в молекулі. Глюкоза має 4 асиметричні атоми і 24=16 стереоізомерів, а фруктоза – 3 симетричні атоми і 23=8 стереоізомерів. Серед стереоізомерів моносахаридів більш відомі D і L, або, як часто говорять, моносахариди можуть мати D- і L-конфігурацію. При визначенні конфігурації того чи іншого моносахариду як стандарт використовують гліцериновий альдегід, що містить тільки один асиметричний атом вуглецю і, отже, має тільки одну пару стереоізомерів – D i L.
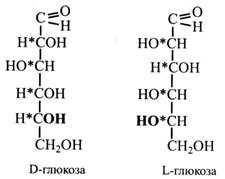
Гліцериновий альдегід може існувати в трьох формах: у вигляді право- і лівообертальних D- та L-стереоізомерів та у вигляді суміші їх рівних кількостей. Така суміш називається рацемічною, вона позбавлена оптичної активності. Моносахариди, у яких розташування –Н і –ОН біля найближчого до первинної спиртової групи вуглецевого атому таке ж саме, у D-гліцеринового альдегіду, мають D-конфігурацію, а ті, у яких –Н і –ОН розташовані біля того ж вуглецевого атому, як у L-гліцеринового альдегіду, відносять до L-стереоізомерів. Інакше кажучи, для визначення конфігурації даного моносахариду розглядають розташування –Н і –ОН біля асиметричного атому вуглецю, найбільш віддаленого від карбонільної групи =С=О або –СОН. Звичайно цей вуглецевий атом є найближчим до первинної спиртової групи. Якщо вуглецевий ланцюг цукру зображений зверху вниз і карбонільна група розташована вгорі, то у D-стереоізомерів група –ОН біля останнього асиметричного атома знаходиться праворуч, а у L-стереоізомерів – ліворуч.
D i L-стереоізомери відносяться один до одного, як предмет і його дзеркальне відображення. Тому в L-глюкози –Н і –ОН біля всіх асиметричних вуглецевих атомів мають протилежне D-глюкозі розташування, а місце групи –ОН біля 5-го вуглецевого атому є лише ознакою для класифікації стереоізомерів. У рослинах містяться і засвоюються в основному D-форми цукрів. L-форми зустрічаються дуже рідко. Тому далі ми будемо позначати лише L-форми, маючи на увазі, що всім іншим моносахаридам притаманна D-конфігурація. На перших етапах вивчення моносахаридів їхні відомі властивості добре пояснювалися формулами Фішера. Пізніше виявилися нові ознаки цукрів, які вже не можна було пояснити цими формулами. Наприклад, було показано, що моносахариди не завжди виявляють альдегідні властивості (не дають реакції з фуксинсульфітною кислотою, не утворюють бісульфітної сполуки з NaHSO3). При розчиненні моносахаридів спостерігалася зміна питомого обертання, яке лише через деякий час досягало постійної величини. Це явище назвали мутаротацією. Крім того, виявилося, що один із гідроксилів молекули моносахариду відрізняється більш високою реакційною активністю. Для пояснення цих і ряду інших особливостей московський професор-хімік М. А. Коллі у 1870 р. запропонував гіпотезу, відповідно до якої моносахариди існують не тільки в альдо- і кето-, але й у циклічній формі. Це припущення у 1883 р. підтвердив і розвинув німецький хімік Б. Толленс. Згідно з його гіпотезою, моносахариди існують не тільки у формі альдо- і кетоспиртів, а й у вигляді циклічних напівацеталей. Напівацеталі утворюються в результаті реакції альдегідів зі спиртами.
Подібна реакція між альдо- або кетогрупою і гідроксилом спиртової групи може відбуватися й усередині молекули моносахариду, в результаті чого утворюються циклічні напівацеталі.
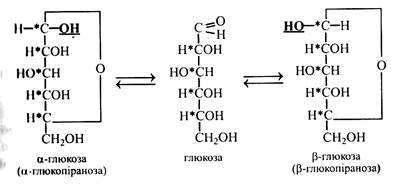
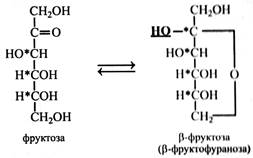
І наведених формул циклічних напівацеталей глюкози видно, що у них немає альдегідної групи, це пояснює відсутність альдегідних властивостей. До того ж у циклічних форм з'являється ще один асиметричний атом вуглецю, це приводить до виникнення ще однієї пари стереоізомерів, які позначають α і β. Встановлення між цими стереоізомерами рівноважного стану пояснює мутаротація. Новий гідроксил, що з'явився при циклізації у молекулі цукру, назвали напівацетальним, а пізніше глікозидним. Цей гідроксил і виявився найбільш реакційноздатним. При написанні формули моносахариду зверху вниз у α-стереоізомерів напівацетальний гідроксил розташовується праворуч, а у β-стереоізомерів – ліворуч.
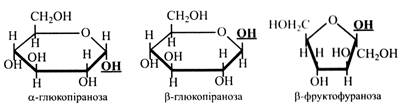
Наведені вище циклічні формули моносахаридів є похідними гетероциклічних сполук – шестичленною пірану і п’ятичленного фурану – піранози і фуранози (глюкопіраноза, фруктофураноза). В. Хеуорс запропонував зображати циклічні моносахариди у вигляді перспективних формул. У цих формулах товстими лініями зображують зв'язки між вуглецевими атомами, які на площині потрапляють на передній план.
Атомів вуглецю в кільці перспективних формул зазвичай не пишуть. α-Форми і β-форми розрізняються за положенням –ОН (напівацетального гідроксилу) відносно площини кільця. У α-стереоізомерів -ОН розташовується під площиною кільця, а у β-ізомерів – над площиною. У живих організмах молекули моносахаридів завжди мають циклічну форму, у такому ж вигляді залишки цукрів входять до складу полісахаридів. У твердому стані цукри також мають циклічну будову. Тільки в розчині з'являються, крім циклічних, ще і нециклічні форми молекул. При цьому останніх у розчині мало – до 1 %. У природі серед циклічних форм цукрів в основному зустрічаються піранози, фураноз дуже мало (фруктоза, рибоза). Хімічні властивості Моносахариди легко окислюються з утворенням кислот. Причому окислення може відбуватися як у кислому, так і в лужному середовищі. У цукрів легше за все окислюється альдегідна група.
У лужному середовищі моносахариди можуть окислюватися оксидами металів (міді, вісмуту, срібла). При цьому цукор окислюється до кислоти, а оксиди металів відновлюються. Оксид міді (II), відновлюючись, утворює оксид міді (І). Ця реакція використовується для кількісного визначення цукрів за кількістю оксиду міді (І). При взаємодії цукрів з оксидами вісмуту і срібла останні відновлюються до вільних металів. Реакція «срібного дзеркала» використовується для сріблення ялинкових прикрас, колб, посудин Дюара та термосів.
Однак так, як написано, реакція з оксидом міді (II) йти не може, бо СuО – нерозчинний у воді порошок. У зв'язку з цим для реакції беруть сіль двовалентної міді – СuSO4. Оскільки окислювання цукрів відбувається в лужному середовищі, до розчину СuSO4 необхідно додати луг.
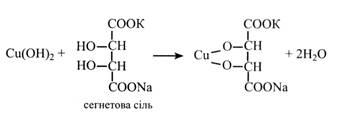
Але й у цьому разі виникає перешкода: Сu(ОН)2 являє собою драглеподібний осад і не може далі реагувати з цукром. Для подальшого ходу реакції необхідно утримувати катіони двовалентної міді в лужному середовищі в розчині. Для цього до лужного розчину міді додають сегнетову сіль (К, Na-виннокислий), яка зв'язує іони міді й утримує їх у лужному середовищі в розчині.
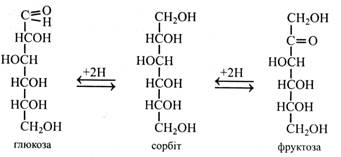
Цей розчин синього кольору, що містить СuSO4, NaОН і сегнетову сіль, називають фелінговою рідиною і використовують для кількісного визначення цукрів. Фелінгову рідину нагрівають із розчином цукру. При цьому випадає червоний осад Сu2O, кількість якого відповідає кількості цукру. Фелінгову рідину відновлюють цукри, що мають вільний напівацетальний (глікозидний) гідроксил. Це усі моносахариди і деякі олігосахариди. Їх називають відновними цукрами на відміну від тих, що не містять вільного напівацетального (глікозидного) гідроксилу і не здатні відновлювати фелінгову рідину. При відновленні моносахариди утворюють відповідні багатоатомні спирти. Так, при відновленні глюкози і фруктози утворюється шестиатомний спирт – сорбіт.
У рослинах кислоти і спирти утворюються з моносахаридів ферментативним шляхом. Моносахариди можуть взаємодіяти з кислотами, утворюючи складні ефіри. Особливо велике значення в живих клітинах мають складні ефіри цукрів і фосфорної кислоти – сахарофосфати.
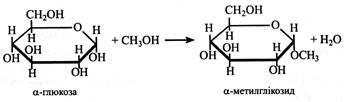
Сахарофосфати є активованими формами моносахаридів, оскільки містять багатий на енергію фосфорноефірний зв'язок. Тому вони легко вступають у біохімічні реакції. По суті, весь вуглеводний обмін у рослинах – це реакції між сахарофосфатами або з неодмінною їхньою участю. Важливою властивістю цукрів є їхня здатність утворювати глікозиди. Це відбувається в результаті реакції напівацетального (глікозидного) гідроксилу з будь-якою сполукою, частіше невуглеводної природи (агліконом), α- і β-стереоізомери утворюють, відповідно, α- і β-глікозиди, які відрізняються за хімічними властивостями і на які діють різні ферменти. У рослинах частіше зустрічаються β-глікозиди. Одними з найпростіших глікозидів є метилглікозиди.
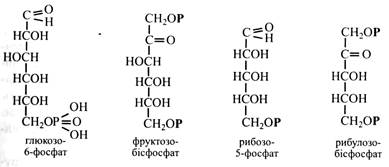
Глікозиди дуже поширені в рослинах. Їх агліконами можуть бути різні речовини (спирти, кислоти, фенольні сполуки). Цукри, що входять до складу глікозидів, дуже різноманітні й часто у вільному стані не зустрічаються. Глікозиди нерідко мають гіркий смак і специфічний аромат. У рослинах петрушки міститься глікозид апіїн, у листках і насінні хрестоцвітих – глікозид синігрин, що надає специфічного запаху та гіркого смаку гірчиці. Відома ароматична речовина ванілін є агліконом глікозиду кори ванільного дерева. У насінні рослин із родини розових є глікозид амігдалін, що містить в агліконі залишок синільної кислоти. Саме цей глікозид надає запаху гіркого мигдалю кісточкам персиків, абрикосів, слив, вишень тощо. Деякі глікозиди застосовуються у медицині, наприклад, група серцевих глікозидів. Вони позитивно впливають на роботу серцевого м'яза. Серцевих глікозидів багато, наприклад у наперстянці. Характеристика окремих моносахаридів Моносахариди – білі кристалічні речовини, добре розчинні у воді, які мають більш-менш солодкий смак. Вони дуже поширені в природі, особливо їх багато в рослинах. Моносахариди в рослинах знаходяться у вільному стані, у вигляді фосфорних ефірів, вони входять до складу полісахаридів та інших сполук (глікозидів, гліколіпідів, глікопротеїдів). Моносахариди класифікують за числом вуглецевих атомів у ланцюжку (С3-С9) на тріози, тетрози, пентози, гексози, гептози, октози і нанози. Тріози. До них належать найпростіші моносахариди – гліцериновий альдегід і дигідроксиацетон. У вільному стані вони не зустрічаються, а у вигляді фосфорних ефірів (ФГА і ФДА) є важливими проміжними сполуками обміну вуглеводів (фотосинтез, дихання, бродіння).
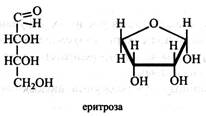
Тетрози. Найбільш поширена у рослинах тетроза – еритроза, що має фуранозну форму й у вигляді фосфорного ефіру бере участь в обміні вуглеводів.
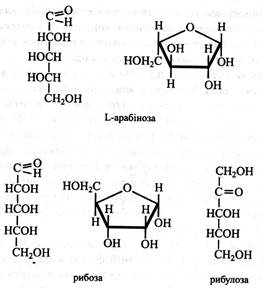
Пентози. Рослини характеризуються високим вмістом пентоз. При нагріванні з розбавленою Н2SO4 або НС1 пентози утворюють леткий гетероциклічний альдегід фурфурол, що з НС1 і аніліном дає інтенсивне червоне забарвлення. Ця реакція служить для якісного і кількісного визначення пентоз. Серед пентоз найбільш відомими є ксилоза, арабіноза і рибоза. Ксилоза. Її ще називають деревним цукром. Вона входить до складу полісахаридів (геміцелюлози, гумі, слизи). Ксилозу одержують шляхом гідролізу деревини, соломи, висівок, бавовняного і соняшникового лушпиння. На розчинах гідролізної ксилози вирощують мікроорганізми Torula і Manilia, що дають багатий білком корм худобі. Ксилозу також використовують у кондитерській промисловості. Для цього її одержують гідролізом кукурудзяних качанів, які містять до 12 % цього цукру. Ксилоза входить до складу глікозидів, а у вигляді фосфорних ефірів бере участь в обміні вуглеводів. Вона не зброджується дріжджами і не засвоюється людським організмом. У рослинах в обміні вуглеводів бере участь ізомер ксилози – ксилулоза у вигляді фосфорного ефіру.
L-арабіноза знаходиться в рослинах у фуранозній формі та входить до складу полісахаридів (геміцелюлози, гумі, слизи). Арабінозу одержують шляхом кислотного гідролізу вишневого клею або бурячного жому. Дріжджі арабінозу не зброджують, людський організм її не засвоює. Рибоза відіграє дуже важливу роль у живих організмах. Вона входить до складу РНК, нуклеотидів, вітамінів, коферментів. її фосфорні ефіри беруть участь в обміні вуглеводів. Зустрічається рибоза у фуранозній формі. Ізомер рибози, її кетоформа – рибулоза у вигляді фосфорного ефіру бере участь в обміні вуглеводів, а її подвійний ефір – рибулозобісфосфат є акцептором СО2 при фотосинтезі.
Гексози, поряд з пентозами, найбільш поширені моносахариди у рослинах. Це глюкоза, фруктоза, галактоза, маноза. Глюкоза (декстроза, або виноградний цукор) – найпоширеніший у природі моносахарид. У вільному стані глюкоза міститься в зелених частинах рослин, у насінні, ягодах, фруктах, складає половину від загальної кількості цукрів нектару і меду. Глюкоза входить до складу олігосахаридів (сахароза, мальтоза, рафіноза), багатьох вищих полісахаридів (крохмаль, глікоген, целюлоза, ліхенін), глікопротеїдів, деяких ліпоїдів, багатьох глікозидів. Фосфорні ефіри глюкози беруть участь у метаболізмі вуглеводів. Глюкоза зброджується дріжджами і добре засвоюється тваринним організмом. Кут питомого обертання глюкози +52,5°. Глюкозу одержують шляхом гідролізу крохмалю, частіше кукурудзяного або рисового. Глюкозу широко застосовують: вона є частиною нашої їжі (фрукти, мед), використовується у харчовій промисловості та медицині. Так, глюкоза складає велику частку патоки, що застосовується в кондитерській промисловості. З неї в промислових масштабах синтезують вітамін С. На глюкозі, яку одержують при гідролізі деревини, вирощують кормові дріжджі. Крім того, зброджуючи таку глюкозу, одержують гідролізний спирт, який використовують для технічних цілей. Фруктоза (левулоза, плодовий цукор) – найважливіший представник кетоз. У природі вона зустрічається у фуранозній формі в основному у вигляді β-стереоізомера. Обертає площину поляризації вліво, кут питомого обертання -–92,4°. Фруктоза є найсолодшим цукром. Вона міститься у всіх зелених частинах рослин, у плодах, складає половину цукрів нектару і меду. її фосфорні ефіри беруть участь в обміні вуглеводів. Фруктоза входить до складу олігосахаридів (сахароза, рафіноза), вищих полісахаридів (інулін), глікопротеїдів, глікозидів. Одержують фруктозу шляхом гідролізу інуліну. Вона зброджується дріжджами і засвоюється тваринним організмом. Галактоза у вільному стані в рослинах зустрічається вкрай рідко. Наприклад, у кристалічній формі вона виділяється на плодах плюща. Головним чином галактоза входить до складу олігосахаридів (лактоза, рафіноза), вищих полісахаридів (геміцелюлози, гумі, слизи), глікопротеїдів, глікозидів. Зброджується дріжджами.
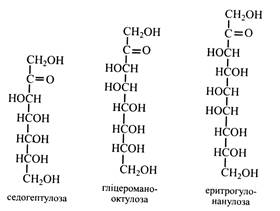
Маноза у вільному стані майже не зустрічається. Звичайно вона входить до складу вищих полісахаридів (геміцелюлози, гумі, слизи), глікопротеїдів, глікозидів. Зброджується дріжджами. Гептози. У рослинах поширена в основному одна гептоза – седогептулоза.
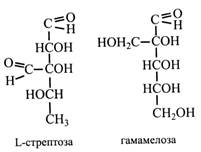
Седогептулоза в певних кількостях міститься в рослинах з родини товстянкових. Вперше її одержали з очитка (Sedum), звідси й назва. Фосфорні ефіри седогептулози беруть участь у перетворенні вуглеводів. Дріжджі седогептулозу не зброджують. Октози і нанози. Ці моносахариди знайдені головним чином у плодах авокадо. Всі вони є кетозами. Прикладом октоз може бути гліцероманооктулоза, а наноз – еритрогулонанулоза. Моносахариди з розгалуженим ланцюгом. Зазвичай моносахариди мають нерозгалужений ланцюг. Розгалужені цукри зустрічаються вкрай рідко і, як правило, у зв'язаному стані. Апіоза – моносахарид, що входить до вкладу глікозиду апіїну, який міститься в рослині петрушки. L-стрептоза має в розгалуженні альдегідну групу. Вона входить до складу антибіотика стрептоміцину. Ще однією особливістю стрептози є відсутність кисню в 5-го вуглецевого атома, тобто вона являє собою дезоксицукор. Гамамелоза у бічному ланцюжку має первинну спиртову групу. Вона входить до складу ряду дубильних речовин.
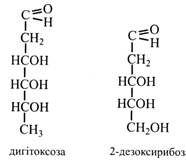
Дезоксицукри. У рослинах зустрічаються моносахариди, у яких при одному, рідше при двох, вуглецевих атомах відсутній кисень. Це дезоксицукри. L-рамноза міститься в багатьох глікозидах, у гумі, слизах, у пектинових речовинах. У вільному стані рамноза зустрічається в листках сумаху. Фукоза знайдена у водоростях (фукус, ламінарія), а також у глікозидах та деяких геміцелюлозах.
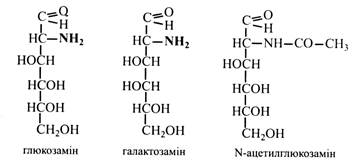
Дигітоксоза – двічі дезоксицукор, що міститься у глікозидах (наперстянка). Дезоксирибоза у формі фосфорного ефіру входить до складу дезоксирибонуклеотидів ДНК. Аміноцукри – це моносахариди, що містять аміногрупу. Наприклад, глюкозамін, галактозамін, у яких біля 2-го вуглецевого атома замість гідроксильної міститься аміногрупа. У природі аміноцукри зустрічаються зазвичай у складі полісахаридів (хітин), глікопротеїдів, глікозидів. Вони мають сильно виражені основні властивості та можуть утворювати солі. У рослинах глюкозамін та інші аміносахариди знаходяться в основному у вигляді N-ацетильних похідних, тобто в аміногрупі один водень заміщений ацетильним залишком.
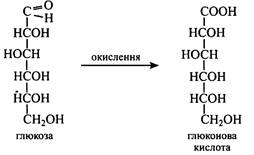
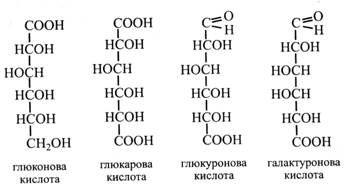
Деякі похідні моносахаридів До них належать кислоти та багатоатомні спирти, що утворюються з моносахаридів, мають деякі спільні з ними властивості та беруть участь у їх метаболізмі. Кислоти виникають при окисленні моносахаридів. Залежно від того, яка група в молекулі цукру окислюється, утворюються кислоти трьох типів: 1. При окисленні альдегідної групи до карбоксильної утворюються альбомові кислоти: з глюкози – глюконова, з галактози – галактонова, з рибози – рибонова тощо. 2. При одночасному окисленні альдегідної та первинної спиртової груп утворюються дикарбонові кислоти, що називаються альдаровими: з глюкози – глюкарова, з галактози – галактарова тощо.
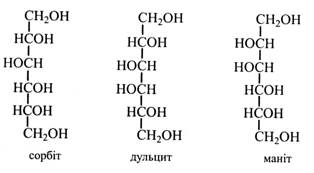
3. При окисленні тільки первинної спиртової групи утворюються альдокислоти – урокові кислоти: з глюкози – глюкуронова, з галактози – галактуронова, з манози – мануронова тощо. Усі ці кислоти легко утворюються в рослинах і беруть участь у вуглеводному обміні, входять до складу деяких полісахаридів (геміцелюлози, гумі, слизи), глікопротеїдів, глікозидів. Багатоатомні спирти утворюються в рослинах шляхом відновлення моносахаридів, їх альдо- або кетогруп. Найбільш поширені в рослинах сорбіт, маніт, дульцит (галактит). Сорбіт виникає при відновленні глюкози і фруктози. Він дуже поширений у рослинах. Багато його в плодах – фруктах і ягодах (яблука, груші, сливи, вишні, абрикоси, персики). Особливо багато сорбіту в плодах горобини – до 7 %, звідки його було вперше виділено. Маніт утворюється при відновленні манози або фруктози. Його багато в овочах і плодах (морква, цибуля, оливки, ананаси), у грибах (до 11 %), у водоростях (5-20 %). Звичайно маніт одержують із морської капусти (бура водорость). Він виділяється на корі деяких дерев у вигляді «манни» (олива, деякі види ясена, тамарикса). Дульцит (галактит) утворюється при відновленні галактози. Він міститься в багатьох рослинах і у виділеннях на корі та листках деяких дерев. Наприклад, «мадагаскарська манна» являє собою майже чистий дульцит.
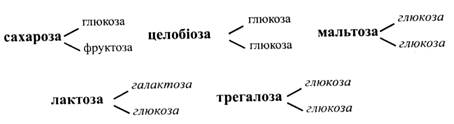
Полісахариди Олігосахариди. Олігосахариди – це зазвичай білі кристалічні речовини. Вони добре розчиняються у воді і мають більш-менш солодкий смак. Олігосахариди містяться в рослинах у вільному стані, входять до складу вищих полісахаридів, глікозидів, глікопротеїдів. Іх молекули мають від двох до десяти залишків моносахаридів, але частіше зустрічаються цукри із 2-5 залишками. За числом залишків олігосахариди поділяють на ди-, три-, тетра- та пентасахариди тощо. Д исахариди. Це найбільш поширена група олігосахаридів. Їх молекули складаються з двох залишків гексоз, із двох пентоз або з гексози і пентози. Частіше зустрічаються дві гексози. Дисахариди побудовані за типом глікозидів, тобто з'єднання двох молекул моносахаридів відбувається за рахунок глікозидного гідроксилу одного моносахариду і одного з гідроксилів іншого. Найбільш важливі дисахариди рослин складаються із залишків таких моносахаридів:
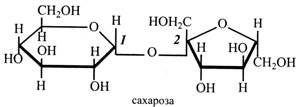
Із наведеного складу дисахаридів зрозуміло, що різні цукри можуть будуватися з однакових залишків. При цьому неоднакові властивості таких дисахаридів обумовлюються, по-перше, тим, що до їх складу входять різні ізомери моносахариду (α-форми або β-форми), по-друге, різними зв'язками між залишками. Дисахариди поділяють на дві групи: відновні і невідновні. Відновні дисахариди мають вільний глікозидний гідроксил, тому що зв'язок між залишками моносахаридів здійснюється за рахунок одного глікозидного, а іншого звичайного гідроксилу. У невідновних дисахаридів у зв'язку зайняті обидва глікозидні гідроксили. З перерахованих вище дисахаридів невідновними є сахароза і трегалоза, інші – відновні. Відновні дисахариди, як і всі моносахариди, відновлюють фелінгову рідину, можуть існувати у формі α-і β-стереоізомерів, отже, виявляти в розчині мутаротацію. Сахароза (буряковий, або тростинний цукор) – найбільш поширений і важливий рослинний дисахарид. Молекула сахарози побудована із залишків α-глюкози і β-фруктози, зв'язаних (α1→β2)-зв'язком. Оскільки у зв'язку беруть участь два глікозидні гідроксили, сахароза не відновлює фелінгову рідину. Сахароза добре зброджується дріжджами і засвоюється людським організмом. Кут питомого обертання розчину сахарози +66,5°. У невеликих кількостях сахароза міститься в усіх тканинах рослин. Вона є основним транспортним цукром, що рухається ситоподібними трубками флоеми. Крім того, сахароза може накопичуватися в клітинному соку в плодах, коренях, бульбах як запасний вуглевод. Найбільше сахарози міститься в коренеплодах цукрового буряка (14-20 %) і в соку стебел цукрової і ростини (14-25 %).
Сахароза має найбільше практичне значення серед інших цукрів, тому що вона є основним цукром, який використовується людиною в їжу. Сахарозу одержують із цукрової тростини (65 % світової потреби) і з цукрового буряка (30-35 %). Джерелом цукру в тропіках для місцевого населення є пальми – кокосова, цукрова і винна. Перед цвітінням у пальм підрізають головну вісь суцвіття і збирають сік, що витікає. Його випарюють і одержують коричневий цукор. Сік також зброджують у вино. Цукрова кукурудза і цукрове сорго в стеблах містять 10-12 % сахарози. Використовувати ці рослини для виробництва цукру нівигідно, але з них готують солодкий сироп, який використовують у кондитерській промисловості. У Північній Америці росте цукровий клен. Навесні з підрізаного стебла збирають солодкий сік, що містить близько 4 % цукру. Сік упарюють до сиропу, що нагадує мед, і застосовують його як загальнозміцнювальний засіб. Очищена сахароза негативно впливає на кровоносні судини, викликаючи їхній склероз, тому не рекомендується вживати більше двох столових ложок цукру на день. Жовтий і коричневий цукор менш шкідливий, бо дія сахарози у них пом'якшується домішками. Сахароза легко гідролізується при нагріванні з кислотами або під дією ферменту сахарази. При цьому утворюється суміш рівних кількостей глюкози і фруктози. Цю суміш називають інвертним цукром, тому що в результаті гідролізу праве обертання розчину змінюється на ліве. Кут питомого обертання розчину сахарози +66,5°, а глюкози і фруктози, що утворилися, відповідно +52,5° і -92,4°. Звідси кут питомого обертання суміші буде негативним, дорівнюватиме -39,9°. Крім того, інвертний цукор більш солодкий (на 30 %), ніж сахароза, тому в кондитерській промисловості його часто використовують замість сахарози. Мальтоза (солодовий цукор) складається з двох залишків глюкози з (α1→4)-зв'язком. Вона міститься у солоді – пророслому зерні. Мальтоза має вільний глікозидний гідроксил, отож відновлює фелінгову рідину. Вона зброджується дріжджами.
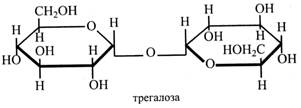
Трегалоза (грибний цукор) має два залишки α-глюкози, пов'язаних (α1→α1)-зв'язком, у якому зайняті обидва глікозидні гідроксили, тому цей цукор є невідновним. Трегалоза міститься у грибах, водоростях, деяких вищих рослинах. У дріжджах кількість трегалози досягає 18 %.
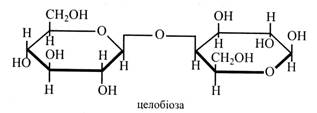
Целобіоза – це основна структурна одиниця целюлози. У вільному стані вона зустрічається у пасоці деяких дерев. Якщо целобіоза в рослинах виявляється рідко й у невеликих кількостях, то фермент целобіаза, що її гідролізує, досить поширений. Мабуть, целобіоза дуже швидко розщеплюється, тому визначити її відчутний вміст в тканинах рослин важко. Молекула целобіози складається з двох залишків глюкози, пов'язаних (β1→4)-зв'язком. При цьому один залишок повернутий на 180°. Целобіоза є відновним цукром. Вона не зброджується дріжджами і не засвоюється тваринним організмом.
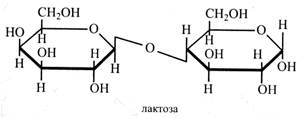
Лактоза (молочний цукор). Молочним цукром лактозу навівають тому, що вона міститься у молоці ссавців (4-5 %). При цьому молоко не має солодкого смаку, тому що лактоза в 6 разів менш солодка, ніж сахароза. У рослинах лактоза частіше знаходиться у зв'язаному стані (глікозиди, глікопротеїди).
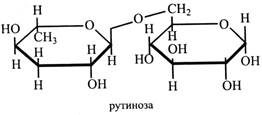
Молекула лактози складається з β-галактози і глюкози, (β1→4)-зв'язок. Це відновний цукор, що зброджується дріжджами. Одержують лактозу на сироварних заводах із сироватки, яка є відходом виробництва. Її використовують для приготування живильних мікробіологічних середовищ, у фармацевтичній промисловості в якості наповнювача при виготовленні порошків і таблеток. У Норвегії із сироватки, що багата на лактозу, готують сир брюност. Він має коричневий колір тому, що при тривалому кип'ятінні сироватки відбувається карамелізація лактози. Рутиноза – це дисахарид, що зустрічається тільки у глікозидах, її молекула складається з β-L-рамнози і глюкози, (β1→6)-зв'язок.
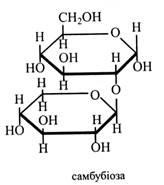
Дисахариди, що мають у своєму складі рамнозу, гіркі на смак і додають гіркості глікозидам. Наприклад, гіркі глікозиди, що містять рамнозу, характерні для грейпфрутів. Самбубіоза – дисахарид, до складу якого входить β-ксилоза і глюкоза, (β1→2)-зв'язок. Вона також зустрічається тільки у глікозидах.
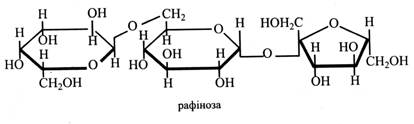
Трисахариди. Найбільш поширений у рослинах трисахарид – рафіноза. Молекула рафінози має залишки α-галактози, α-глюкози і β-фруктози, (α1→6) і (α1→β2)-зв'язки.
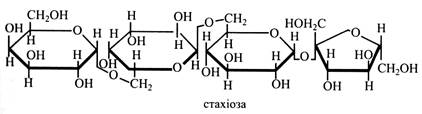
Інакше кажучи, у молекулі рафінози галактоза пов'язана із залишком сахарози. Рафіноза – невідновний цукор, тому що глікозидні гідроксили всіх трьох моносахаридів зайняті у зв'язках. Рафіноза – другий за значенням транспортний цукор у флоемі рослин. Вона зустрічається в насінні (бавовник), у «манні» на корі дерев (евкаліпт). Багато рафінози міститься у коренеплодах цукрового буряка (до 1 % від кількості сахарози). При зберіганні коренеплодів вміст рафінози у них зростає. У процесі виробництва цукру рафіноза накопичується у меласі, звідки її й одержують. Тетрасахариди. Найвідоміший у рослинах тетрасахарид – стахіоза. До складу її молекули входять два залишки галактози, залишок глюкози і фруктози. Зв'язки – (α1→6), (α1→6), (α1→β2). Інакше кажучи, до молекули рафінози приєднується ще один залишок галактози.
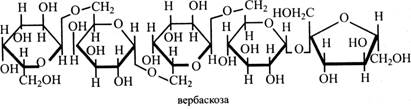
Уперше стахіозу одержали з коренів чистецю (Stachys), звідси її назва. Цей тетрасахарид міститься в насінні багатьох бобових (соя, горох, квасоля, сочевиця, люпин), у «манні» деяких видів ясеня, у зернах жита. Стахіоза є третім за значенням (після сахарози і рафінози) транспортним цукром у ситоподібних трубках флоеми. Ряд харчових продуктів містить багато стахіози (до 1,0 - 1,5 %) – житній хліб, квасоля, горох, боби. У деяких людей відсутній фермент, що розщеплює цей цукор. Тому, коли вони вживають продукти, де багато стахіози, виникає дискомфорт у кишечнику. У таких випадках варто утримуватися від споживання цих продуктів. Пентасахариди. Вербаскоза уперше виділена з коров'яку (Verbascum). До її молекули входять три залишки α-галактози, α-глюкоза і β-фруктоза, зв'язки (α1→6), (α1→6), (α1→6), (α1→β2). Отже, у молекулі цього цукру до стахіози приєднується ще один залишок галактози.
Вербаскоза – теж транспортний цукор, але її в ситоподібних трубках мало, за значенням вона йде за стахіозою. Солодкість цукрів Солодкий смак – одна з найважливіших ознак цукрів та їхніх похідних, які до того ж розрізняються за ступенем солодкості. Було складено таблиці солодкості цукрів та їх похідних, де стандартом для порівняння є сахароза, солодкість якої приймають за 100 одиниць. Нижче наведені показники солодкості деяких цукрів та їхніх похідних:
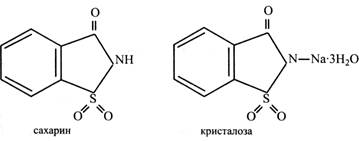
Слід сказати, що солодкий смак не є абсолютною ознакою цукрів. Існує ряд сполук, що не мають нічого спільного з цукрами за хімічною природою, але в той же час солодкі на смак. Наприклад, D-амінокислоти чи солі свинцю. Існують природні речовини і хімічні сполуки, що мають сильний солодкий смак. Деякі з них нешкідливі для людського організму і використовуються як замінники цукру в кондитерській промисловості, при виготовленні напоїв і фруктових вод, при лікуванні діабету. Звичайно солодкий смак таких речовин у багато разів перевищує солодкість сахарози. Сахарин – це імін сульфобензойної кислоти, але частіше використовують кристалогідрат його натрієвої солі, який за аналогією до цукрів називають кристалозою.
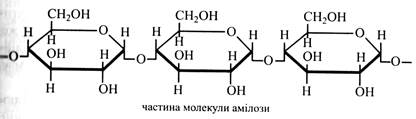
Сахарин у 400-500 разів солодший за сахарозу. Він не засвоюється людським організмом, його використовують як замінник цукру для надання солодкого смаку без збільшення калорійності їжі, а також у тих випадках, коли вживання цукру неприпустимо, наприклад, при діабеті. Інший відомий синтетичний замінник сахарози – аспартам. До його складу входять залишки двох амінокислот– аспарагінової та фенілаланіну. Він солодший за цукор у 180 разів. В організмі людини аспартам розщеплюється на вказані амінокислоти, які використовуються у синтезі білка. Однак при розпаді аспартаму утворюється формальдегід, що є дуже отруйною речовиною. В результаті численних перевірок вчені дійшли висновку, що кількість формальдегіду, який виникає з дози аспартаму, необхідної для підсолоджування однієї склянки чаю, дуже мала. Наприклад, в одному апельсині його у 600 разів більше. Тому аспартам в Європі вважають одним з найбезпечніших підсолоджувачів і широко використовують у виготовленні фруктових вод, кондитерських виробів тощо. У рослинах зустрічаються речовини невуглеводної природи, солодкість яких надзвичайно велика. Прикладом може бути глікозид стевіозид, або, за аналогією до цукру, його називають стевіозою. Він міститься в листках південноамериканської трав'янистої рослини стевії. Глікозид стевіозид у 300 разів солодший за сахарозу і використовується як її замінник. Інший глікозид – гліциризинова кислота – в 100 разів солодший за сахарозу. Він міститься в коренях тропічної ліани хеквериті. Корінь цієї рослини називають «індійською лакрицею». Вищі полісахариди Вищі полісахариди – високомолекулярні речовини, молекули яких містять від декількох десятків до багатьох тисяч залишків моносахаридів. Вивчення цих полісахаридів ускладнюється труднощами їх очищення і одержання у чистому вигляді, оскільки в клітині вони звичайно зв'язані з іншими вуглеводами, білками, мінеральними речовинами. При вивченні вищих полісахаридів використовують метод введення в їхні молекули різних радикалів (–СН3, –СОСН3), що дозволяє легше очистити отриманий препарат, вивчити його будову і зв'язки між залишками моносахаридів. Використовують також метод м'якого кислотного або ферментного гідролізу полісахаридів, що дозволяє встановити склад їх мономерів. Вищі полісахариди поділяють на дві групи: гомо- і гетерополісахариди. Молекули гомополісахаридів побудовані із залишків одного цукру. Так, із залишків глюкози складаються крохмаль, целюлоза, глікоген, калоза, ліхенін, а із залишків фруктози – інулін, леван. До складу молекул гетерополісахаридів входять залишки різних моносахаридів та їхніх похідних – геміцелюлози, гумі, слизи. Молекули вищих полісахаридів можуть бути як лінійними, так і розгалуженими. Усі полісахариди цієї групи не мають відновних властивостей, тому що у зв'язках між залишками цукрів беруть участь глікозидні гідроксили. Крохмаль – головний запасний полісахарид рослин, який відкладається у клітинах органів у вигляді крохмальних зерен (насіння, плоди, корені, бульби, кореневища, стебла). Особливо багато крохмалю в насінні рису (60-80 %), кукурудзи (65-75 %), пшениці (60-70 %), менше у бульбах картоплі (12-22%). Крохмальні зерна не розчиняються у воді, а тільки набрякають. Якщо завись крохмальних зерен у воді поступово нагрівати, і о може бути досягнута температура, при якій крохмаль утворює дуже в'язкий колоїдний розчин – крохмальний клейстер. Температура клейстеризації неоднакова для крохмалю різних рослин. Крохмаль картоплі клейстеризується при температурі 55-65 °С, кукурудзи – при 64-71 °С, пшениці – при 60-80 °С, рису – при 70-80 °С. Характерною властивістю крохмалю є його здатність давати синій колір при додаванні розчину йоду в йодистому калії. Крохмаль на 96-98 % складається з вуглеводів. Інше становлять домішки – мінеральні речовини і жирні кислоти. Вуглеводна частина крохмалю складається з двох полісахаридів: амілози і амілопектину. Амілоза являє собою довгий нерозгалужений ланцюг із залишків α-глюкози, поєднаних (α1→4)-зв'язками. Ланцюги амілози утворюють спіраль, кожен виток якої має 6 залишків глюкози. У молекулі амілози звичайно містяться декілька паралельно розташованих спіралей. Молекулярна маса амілози від 100 000 до 1 000 000. При дії на амілозу розчину йоду його молекули вбудовуються у витки спіралі, утворюючи комплексну з полісахаридом хімічну сполуку, що має синє забарвлення.
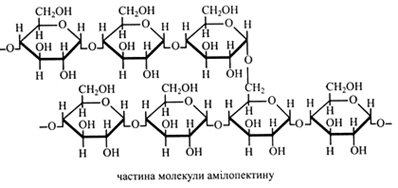
Амілопектин побудований із залишків α-глюкози, поєднаних (α1→4)- і (α1→6)-зв'язками, тобто молекула амілопектину має розгалужену структуру. Точки розгалуження зустрічаються через 25-30 глюкозних залишків. Зовнішні ланцюги амілопектину, якщо вони мають більше шести залишків глюкози, можуть утворювати витки спіралі. Молекулярна маса амілопектину вища, ніж у амілози – від одного до декількох мільйонів. Амілопектин з йодом дає червоно-фіолетове забарвлення, що є результатом адсорбції молекул йоду на полісахариді без утворення хімічних зв'язків.
Як правило, крохмаль містить 10-30 % амілози і 70-90 % амілопектину. Однак це співвідношення може змінюватися в залежності від виду або сорту рослин, а також від органа, з якого отриманий крохмаль. Так, у крохмалі з бульб картоплі міститься 22 % амілози, а з листків – 46 %. Крохмаль з воскоподібних сортів кукурудзи, рису, ячменю складається майже цілком з амілопектину і забарвлюється йодом у червоно-коричневий колір. У той же час крохмаль деяких сортів кукурудзи, гороху і ряду видів лілійних містить більше амілози – 50-70-80 %. Крохмаль яблук має тільки амілозу. При кип'ятінні з кислотами крохмаль гідролізується до глюкози. При більш слабкому впливі – 7,5 % НС1 при кімнатній температурі протягом 7 днів – утворюється так званий «розчинний крохмаль», який часто застосовується у лабораторіях. Крохмаль має широке практичне використання: - він складає велику частину їжі людини (хліб, крупи, овочі, фрукти, кондитерські вироби) і кормів сільськогосподарських тварин; - використовується у багатьох галузях харчової промисловості; - з нього одержують глюкозу, спирт, клей, пластмаси; - його використовують у текстильній промисловості. Глікоген (тваринний крохмаль) міститься в тканинах тварин, у грибах, у ряді рослин (зерно цукрової кукурудзи). У дріжджах глікогену до 40 %. За складом і структурою молекул він близький до амілопектину, але відрізняється від нього більшою розгалуженістю і компактністю молекули, тому що точки розгалуження у глікогену розташовані через 10-18 залишків глюкози. Молекулярна маса його також вища, ніж в амілопектину. Глікоген розчиняється у гарячій воді, створюючи кооїдний розчин, що опалесціює. Глікоген відіграє важливу роль у вуглеводному обміні тварин, грибів, дріжджів, при спиртовому бродінні.
Інуліноподібні фруктозани відкладаються у кореневищах, коренях, бульбах рослин із родини айстрових, дзвоникових (топінамбур, жоржини, цикорій, артишоки, кульбаба). Головним фруктозаном цієї групи є інулін, він містить 30-35 залишків фруктози. Інулін часто супроводжується більш низькомолекулярними фруктозанами. Вони утворюють гомологічний ряд, на початку якого знаходиться дисахарид із двох залишків фруктози – β-левулін, а наприкінці – інулін. З інуліну шляхом кислотного гідролізу одержують фруктозу. Леваноподібні фруктозани характерні для однодольних, у тому числі для рослин з родин лілійних і злакових. Левани містяться в листках, стеблах, коренях і насінні. У злаків левани функціонують як тимчасові запасні полісахариди.
У достигаючому насінні злаків (жито, пшениця, овес, ячмінь) левани містяться у великій кількості (до 30 % на суху речовину), у процесі достигання вони поступово перетворюються на крохмаль, що свідчить про легкість перетворення в рослинах фруктози на глюкозу. Левани мають менше залишків фруктози, ніж інулін (від 7-8 до 13-24). Деякі левани утворюють слабке розгалуження із 2-3 ланцюжків. Крохмаль, глікоген, інулін – це запасні полісахариди. Далі буде розглянута група полісахаридів, що виконують у рослині структурну функцію – компонентів клітинної оболонки. Це целюлоза, геміцелюлози і пектини. Целюлоза (клітковина) – вищий полісахарид, основний компонент клітинної оболонки, що утворює її каркас. У рослинах клітковина завжди пов'язана з іншими речовинами – геміцелюлозами, лігніном, пектином, ліпідами, смолами тощо. Для видалення цих сполук з клітковини вихідну речовину обробляють сумішшю NaHSO3 і Н2SO3. При цьому супутні речовини переходять у розчин, і залишається чиста целюлоза – біла волокниста речовина. Основним джерелом одержання целюлози є волокна бавовнику, луб'яні волокна прядив'яних рослин (льону, коноплі, джута, рамі), а також солома і деревина. Бавовняне волокно містить 95-98 % клітковини, лляне – 80-90 %, деревина – 40-50 %. Целюлоза не розчиняється у воді, а тільки набрякає. Вона є дуже стійкою речовиною: не змінюється під дією слабких кислот і лугів навіть при кип'ятінні, не розчиняється в більшості звичайних розчинників. Клітковина розчиняється тільки в реактиві Швейцера [Сu(NH3)4]•(ОН)2 – розчині комплексної сполуки, що утворюється при розчиненні гідроксиду міді в аміаку. З цього розчину клітковина випадає в осад при підкисленні. Гідролізується клітковина до глюкози при кип'ятінні з концентрованою НСl або Н2SO4.
Молекула целюлози побудована із залишків β-глюкози, з'єднаних (β1→4)-зв'язками. Причому кожний другий залишок і глюкози повернений щодо попереднього на 180°. Це сприяє утворенню водневого зв'язку між гідроксильною групою при С-3 одного глюкозного залишку і киснем сусіднього піранозного кільця. Це перешкоджає обертанню розташованих поруч глюкозних залишків навколо їхніх глікозидних зв'язків і унеможливлює утворення спіралі, подібної до амілози. У результаті утворюється жорстка лінійна структура, у якій усі піранозні кільця розташовуються в одній площині. Це дуже важливо для речовини, що утворює каркас клітинної оболонки та забезпечує її міцність. Целюлоза являє собою суміш гомологічних молекул з У клітинних стінках молекули целюлози зібрані у пучки – мікрофібрили, у яких вони розташовані паралельно одна до одної та пов'язані водневими зв'язками. У поперечному розрізі мікрофібрила має овальну форму. У центрі мікрофібрили молекули (їх приблизно 50) складають так зване «ядро». У ньому молекули розташовані упорядковано, утворюючи кристалічну решітку. Навколо «ядра» приблизно 100 молекул також розташовані паралельно, але менш упорядковано. Це паракристалічна ділянка. У ній міститься деяка кількість молекул матриксу оболонки, частіше геміцелюлоз. Причому вміст їх збільшується у напрямку від «ядра» до периферії паракристалічної зони. У цю зону можуть проникати і молекули води. Лише деякі молекули целюлози проходять по всій довжині мікрофібрили. Тому в мікрофібрилі є місця, де одні молекули закінчуються, а інші починаються. У цих місцях порушується кристалічна решітка. Целюлоза знаходить вельми широке застосування. її використовують у целюлозно-паперовій промисловості. У текстильній промисловості з неї виготовляють бавовняні і лляні тканини. Целюлозу розчиняють у мідно-аміачному розчині, а потім його продавлюють крізь тонке сито у кисле середовище, де вона випадає в осад у вигляді дуже тонких ниток. Із них виробляють натуральний шовк – віскозу. Однак у ньому нитки складаються не з білка, а з вуглеводу – целюлози. У молекули целюлози вводять різні радикали та одержують метил-, ацетил- або нітроцелюлозу, які є сировиною для багатьох галузей хімічної промисловості. З них виготовляють штучне волокно і тканини, шкіру, пластмаси, фарби, лаки, вибухові речовини тощо. Целюлозу почали використовувати для виготовлення целюлозобетону, який одержують змішуванням цементу з волокнистою рослинною сировиною – рисовою соломою, бамбуком, сезалем, кокосовими волокнами, коноплями, джутом. Із суміші готують панелі, що мають усі якості залізобетону, але дешевші, легші й зручніші у житловому будівництві. Геміцелюлози (напівклітковина) – це група вищих полісахаридів, що поряд з целюлозою входять до складу клітинних оболонок, створюючи їх матрикс. У насінні вони можуть частково використовуватися в якості запасних речовин. Досить високий вміст цих сполук у насінні, соломі, деревині, кукурудзяних качанах, висівках. Геміцелюлози нерозчинні у воді, але розчиняються в лугах і гідролізуються кислотами легше, ніж клітковина. При кислотному гідролізі геміцелюлоз утворюються глюкоза, галактоза, маноза, ксилоза, L-арабіноза й уронові кислоти. Молекулярна маса геміцелюлоз складає декілька десятків тисяч. Їх поділяють на три групи, кожна з яких розрізняється за складом та структурою полісахаридів. Групи одержали назву за домінуючим у них моносахаридом: манани, галактани, ксилани. Всі вони відносяться до гетерополісахаридів. Манани містять β-манозу, β-глюкозу і β-галактозу у співвідношенні 3:1:1. Основний ланцюг складається з β-манози і β-глюкози (співвідношення 3:1), поєднаних (β1→4)-зв'язками. До деяких залишків манози приєднані (β1→6)-зв'язками поодинокі залишки галактози. Ряд залишків манози ацетильовані за С-2, рідше за С-3. Такі манани зустрічаються, наприклад, у деревині хвойних і папоротей. Галактани в основному ланцюгу мають залишки β-галактози, поєднані (β1→3)-зв'язками. До залишків галактози (β1→6)-зв'язками приєднуються залишки дисахаридів з двох β-галактоз або двох L-арабіноз. Галактани звичайно містяться в деревині. Ксилани різноманітніші за структурою, у них переважає ксилоза, незалежно від того чи складає вона головний ланцюг, чи розгалуження. Існує декілька груп ксиланів. 1. Основний ланцюг складається з β-ксилози, (β1→4)-зв'язки, 7 з кожних 10 залишків ксилози ацетильований за С-3, рідше за С-2. До деяких ксилозних залишків приєднана галактуронова кислота (α1→2)-зв'язком, яка містить метоксильну групу біля С-4. Іноді такі ксилани у відгалуженнях мають α-L-арабінозу за (α1→3)-зв'язком. Подібні ксилани зустрічаються у хвойних і папоротей. 2. Інший вид ксиланів містить ксилозу головним чином у бічних гілках. Такі ксилани характерні для клітинних стінок дводольних. Вони поділяються на такі підгрупи: а) основний ланцюг складається із залишків глюкози, (β1→4)-зв'язок. Відгалуження – поодинокі залишки ксилози, (α1→6)-зв'язок; б) деякі залишки глюкози основного ланцюга мають розгалуження у вигляді трисахариду з α-ксилози, α-L-фукози, α-галактози. Зв'язок з основним ланцюжком через ксилозу, (α1→6); в) деякі залишки глюкози основного ланцюга мають два відгалуження: зазначений вище трисахарид і L-арабіноза, (α1→2)-зв'язок. Іноді цей ксилан пов'язаний через глюкозу з пектином. Пектини – компоненти матриксу первинних клітинних оболонок. Звичайно вони також є міжклітинною речовиною, що утворює серединну пластинку, яка склеює стінки сусідніх клітин. Вміст пектинів у клітинній оболонці невеликий – менше 5 %. Характерною властивістю пектинів є здатність утворювати гелі при низькій концентрації. Тому їх використовують у харчовій промисловості як желеутворювальні агенти при виготовленні фруктових желе, мармеладу, пастили, джемів, фруктових карамельних начинок і в домашніх умовах при готуванні варення і повидла. Вміст пектинів, %:
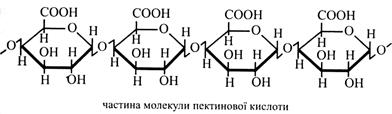
Для утворення пектинового желе необхідні певні умови: 65-70 % цукру (сахарози або гексози), рН 3,1 – 3,5 та від 0,2 до 1,5 % пектину. У стеблах льону, як і в деяких інших прядивних рослин, луб'яні волокна склеєні пектинами. Для їх роз'єднання необхідно зруйнувати пектин, що досягається в процесі вимочування. На рослинах при цьому розвиваються бактерії, які виділяють ферменти, що розщеплюють пектини. В основі структури молекул пектинових речовин лежить пектинова кислота. Вона побудована із залишків галактуронової кислоти, поєднаних (α1→4)-зв'язками.
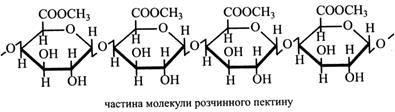
Пектинова кислота може знаходитися в клітинних стінках у цільному стані або у вигляді солей і складних ефірів. У вільному стані пектинова кислота не має желеутворювальних властивостей. Солі пектинової кислоти частіше є пектатами Са і Mg. Причому зв'язки карбоксильних груп з металами можуть утворюватися в одній молекулі й у двох, поруч розташованих молекулах. Тоді зв'язуються два ланцюжки пектинових кислот. Карбоксильні групи в пектиновій кислоті легко утворюють ефіри з метиловим спиртом. Метильована пектинова кислота називається розчинним пектином. Саме розчинний пектин і має желеутворювальні властивості. Його одержують у великих кількостях і використовують у кондитерській промисловості. При одержанні розчинного пектину уникають лужного середовища, яке може викликати омилення ефірів, а також інгібують активність ферменту пектинази, що розщеплює ефірні зв'язки, бо з цих причин втрачаються желеутворювальні властивості.
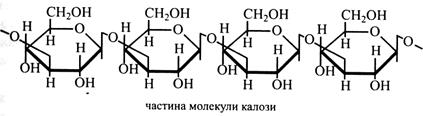
Серед пектинових речовин є також рамногалактурони – пектини, що містять L-рамнозу. Рамногалактурони складаються із фрагментів, що мають 8 залишків галактуронової кислоти, які поєднані трисахаридом із двох залишків галактуронової кислоти і рамнози. Причому рамноза пов'язана з галактуроновою кислотою (α1→2)-зв'язком. Присутність у полісахариді L-рамнози змушує ланцюжок вигинатися. У пектинах у невеликій кількості зустрічаються арабінани і галактани. Арабінани складаються з L-арабінози, (α1→5)-зв'язок. Основний ланцюжок має поодинокі відгалуження із залишків арабінози, (α1→3)-зв'язок. Галактани – лінійні ланцюжки з β-галактози, (β1→4)-зв'язок. Звичайно арабінани і галактани пов'язані з рамногалактуроном. Камеді (гумі) і слизи. Ці полісахариди розчиняються у воді й утворюють дуже в'язкі колоїдні розчини. Камеді (гумі), наприклад, виділяються на гілках і стовбурах вишневих, сливових, абрикосових дерев при їх ушкодженні, утворюючи так званий клей. Слизи містяться у великій кількості в насінні ряду рослин (льону, жита, конюшини, люпину, люцерни та ін.). Будова цих вищих полісахаридів ще не встановлена. Відомо, що при гідролізі вони утворюють глюкозу, галактозу, манозу, ксилозу, арабінозу й уронові кислоти. Причому склад різних камедей і слизів значно різниться. Так, полісахариди вишневого клею складаються із залишків галактози, манози, арабінози, глюкуронової кислоти і незначної кількості ксилози. Слизи житнього зерна майже на 90 % складаються із ксилози й арабінози і дуже невеликої кількості галактози. Саме наявністю слизів пояснюється висока в'язкість відвару з льняного насіння і водяної бовтанки житньої муки. Останню використовують в медицині як кровоспинний і в'яжучий засіб. Калоза – полісахарид, що міститься в ситоподібних трубках флоеми. Він відкладається на ситоподібних пластинках і в перфораціях, перетворюючи останні на вузькі канальці. Восени канальці цілком закупорюються і утворюється наплив калози – калюс. Якщо ситоподібні трубки даної рослини функціонують не один, а два-три сезони, навесні калюс розчиняється. Калоза складається із залишків β-глюкози, пов'язаних (β1→3)-зв'язками.
Калоза відкладається в стінках клітин насіння, що розвивається, і пилкових зерен, коли відбувається формування генеративних ядер (яйцеклітина, генеративна клітина пилкового зерна). При цьому калоза виконує захисну й ізолюючу функції до завершення формування генеративной клітини, а потім полісахарид гідролізується і зникає. Відкладається калоза і в оболонці пилкового зерна, яке потрапило на приймочку несумісної з ним маточки. Калоза ізолює пилок і унеможливлює його проростання. Вона також утворюється в оболонках клітин ушкоджених тканин, ізолюючи рану. Ліхенін – запасний полісахарид лишайників. Вміст його в деяких видах досягає 45-50 % («ісландський мох»). Молекулярна маса ліхеніна близько одного мільйона. Він розчиняється в гарячій воді і має желеутворювальні властивості. Мономером ліхеніна є глюкоза. Припускають, що залишки глюкози в полісахариді пов'язані (1→4)-зв'язками (73 %) і (1→3)-зв'язками (27 %). Лишайники і їх полісахарид ліхенін є основним кормом північних оленів. їхній шлунково-кишковий тракт перетравлює ліхенін завдяки присутності в ньому мікрофлори, що виділяє спеціальні ферменти. Людський організм ліхенін не засвоює. Деякі полісахариди водоростей Мова йтиме лише про полісахариди, що мають практичне застосування. Агар-агар – високомолекулярний полісахарид, який міститься в деяких водоростях, в основному в червоних. Агар складається, принаймні, з двох полісахаридів – агарози й агаропектину. Вважають, що агароза містить галактозу, зв'язки (α1→3) і (β1→4). Зовсім мало відомо про будову агаропектину. Припускають, що він складається з ланцюгів галактози. Деякі галактозні залишки мають складноефірні зв'язки із залишками Н2SO4. Агар-агар розчиняється у воді при нагріванні, а при наступному охолодженні утворює гель. Цей полісахарид у якості желеутворювального агента використовується в кондитерській промисловості при виготовленні желе, пастили, мармеладу, джемів, у парфумерній промисловості при виготовленні кремів, у хлібобулочній – для запобігання швидкого черствіння виробів, у мікробіологічній і біотехнологічній – для приготування твердих живильних середовищ. Альгінова кислота – компонент клітинної стінки багатьох водоростей, особливо бурих. Вона, мабуть, є аналогом пектинової кислоти, але вміст її в клітинній оболонці вище – до 30 %. Побудована альгінова кислота із залишків мануронової та L-гулуронової (уронова кислота з глюкозаміну) кислот, пов'язаних (β1→4)-зв'язками. Альгінова кислота та її солі – альгінати, особливо натрієва, широко застосовуються як стабілізатори емульсій при виготовленні морозива, лаків, фарб. Хітин – головний полісахарид клітинних стінок більшості грибів і основний компонент панцира багатьох безхребетних. Молекули хітину являють собою довгі нерозгалужені ланцюжки, що складаються із залишків N-ацетилглюкозаміну, з'єднаних (β1→4)-зв'язками. Ланцюжки хітину, подібно до целюлози, зібрані в мікрофібрили, де вони пов'язані водневими зв'язками і мають напівкристалічну структуру. Але молекули хітину в мікрофібрилі, на відміну від целюлози, антипаралельні у кристалічному ядрі й паракристалічній зоні. Дата добавления: 2015-11-25 | Просмотры: 1339 | Нарушение авторских прав 12 |

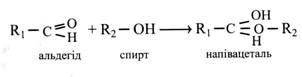
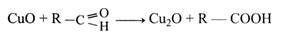
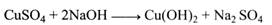
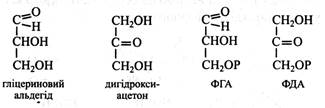
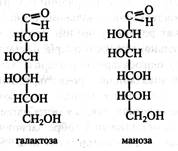



 Фруктозани – полімерні сполуки, що складаються із залишків β-фруктози. Існує два типи фруктозанів – інуліноподібні й леваноподібні. Вони розчиняються у воді й містяться в клітинному соку вакуолі. В інуліноподібних фруктозанах залишки фруктози зв'язані (β2→1)-зв'язками, а у леваноподібних – (β2→6)-зв'язками. Обидва фруктозани на початку молекули мають залишок глюкози.
Фруктозани – полімерні сполуки, що складаються із залишків β-фруктози. Існує два типи фруктозанів – інуліноподібні й леваноподібні. Вони розчиняються у воді й містяться в клітинному соку вакуолі. В інуліноподібних фруктозанах залишки фруктози зв'язані (β2→1)-зв'язками, а у леваноподібних – (β2→6)-зв'язками. Обидва фруктозани на початку молекули мають залишок глюкози.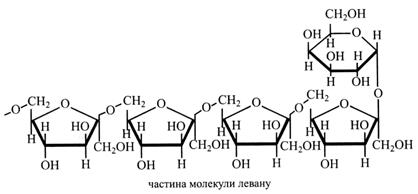
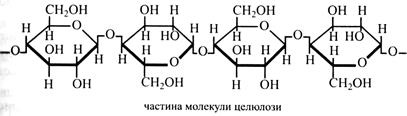
 молекулярною масою від декількох сотень тисяч до декількох мільйонів.
молекулярною масою від декількох сотень тисяч до декількох мільйонів.