|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Синтез гемоглобинаПочти на 85% биосинтез гема происходит в костном мозге и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма. Гем и глобин синтезируются по отдельности. Затем соединяются, и образуется третичная и четвертичная структура гемоглобина. СИНТЕЗ ГЕМА
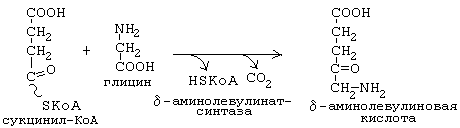
Рисунок 11 Синтез тетрагидропиррольных колец начинается в митохондриях (рис.11,12). Из сукцинил-КоА конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-аминолевулинату (ALA). Отвечающая за эту стадию 5-аминолевулинат-синтаза (ALA-синтаза) [1] является ключевым ферментом всего пути. Коферментом дельта-аминолевулинатсинтазы является пиридоксаль-фосфат (производное витамина В6). Фермент ингибируется по принципу отрицательной обратной связи избытком гема. После синтеза 5-аминолевулинат переходит из митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген (рис.12,13), который уже содержит пиррольное кольцо [2]. Порфобилиногенсинтаза[2] ингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината.
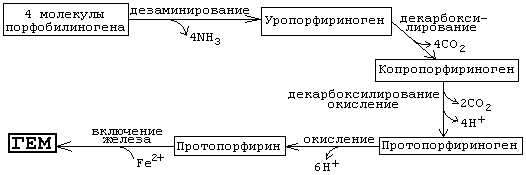
Рисунок 13 Порфобилиногенсинтаза тоже угнетается избытком гема. На последующих стадиях образуется характерная для порфирина тетрапиррольная структура. Связывание четырех молекул порфобилиногена с отщеплением NH2-групп и образованием уропорфириногена III катализируется гидроксиметилбилан-синтазой [3]. Для образования этого промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза [4]. Отсутствие этого фермента приводит к образованию «неправильного» изомера — уропорфириногена I. Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп (5). Образующийся копропорфириноген III снова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под действием оксидазы две
Рисунок 12
пропионатные группы (R2) превращаются в винильные (6). Модификация боковых цепей заканчивается образованием протопорфириногена IX. На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов (7). В заключение с помощью специального фермента, феррохелатазы, в молекулу включается атом двухвалентного железа (8). Образованный таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин, где он связан нековалентно, или в цитохром С, с которым связывается ковалентно. Суммарно этот процесс представлен на рисунке 14.
Рисунок 14 Источник железа - белок ферритин. В комплексе с ферритином в организме хранится (депонируется) резерв железа. Дата добавления: 2015-11-25 | Просмотры: 575 | Нарушение авторских прав |