|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Первичного очага
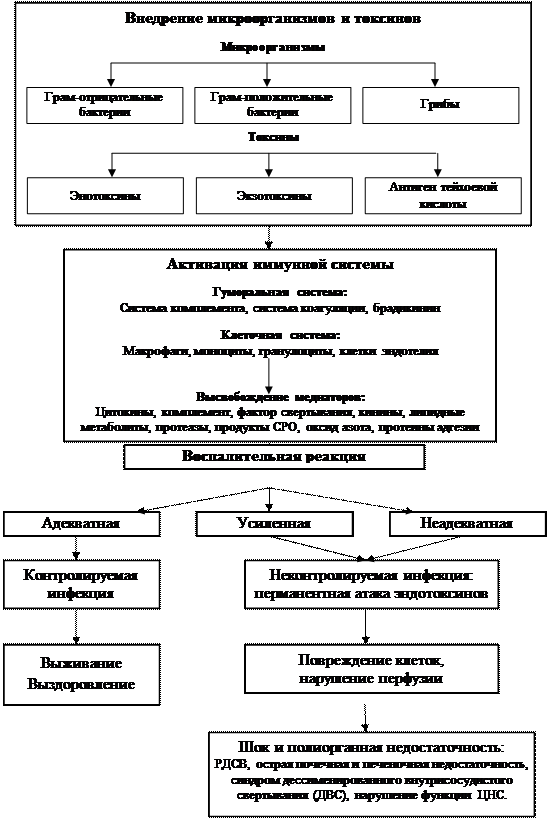
Патогенез Развитие органно-системных повреждений при сепсисе прежде всего связано с неконтролируемым распространением из первичного очага инфекционного воспаления провоспалительных медиаторов эндогенного происхождения, с последующей активацией под их влиянием макрофагов, нейтрофилов, лимфоцитов и ряда других клеток в других органах и тканях, с вторичным выделением аналогичных эндогенных субстанций, повреждением эндотелия и снижением органной перфузии и доставки кислорода. Диссеминация микроорганизмов может вообще отсутствовать или быть кратковременной, трудноуловимой. Однако и этот "проскок" способен запускать выброс провоспалительных цитокинов на дистанции от очага. Экзо- и эндотоксины бактерий также могут активировать их гиперпродукцию из макрофагов, лимфоцитов, эндотелия. Суммарные эффекты, оказываемые медиаторами, формируют ССВР. В ее развитии можно выделить три основных этапа. Этап 1. Локальная продукция цитокинов в ответ на действие микроорганизмов. Особое место среди медиаторов воспаления занимает цитокиновая сеть, которая контролирует процессы реализации иммунной и воспалительной реактивности. Основными продуцентами цитокинов являются Т-клетки и активированные макрофаги, а также в той или иной степени другие виды лейкоцитов, эндотелиоциты посткапиллярных венул (ПКВ), тромбоциты и различные типы стромальных клеток. Цитокины вначале действуют в очаге воспаления и на территории реагирующих лимфоидных органов, выполняя в итоге ряд защитных функций, участвуя в процессах заживления ран и защиты клеток организма от патогенных микроорганизмов. Этап 2. Выброс малого количества цитокинов в системный кровоток. Малые количества медиаторов способны активировать макрофаги, тромбоциты, выброс из эндотелия молекул адгезии, продукцию гормона роста. Развивающаяся острофазовая реакция контролируется провоспалительными медиаторами (IL-1, IL-6, IL-8, TNF и др.) и их эндогенными антагонистами, такими как IL-4, IL-10, IL-13, растворимые рецепторы к TNF и др., получившие название антивоспалительных медиаторов. За счет поддержания баланса и контролируемых взаимоотношений между про- и антивоспалительными медиаторами в нормальных условиях создаются предпосылки для заживления ран, уничтожения патогенных микроорганизмов, поддержания гомеостаза. К системным адаптационным изменениям при остром воспалении можно отнести стрессорную реактивность нейроэндокринной системы; лихорадку; выход нейтрофилов в циркуляцию из сосудистого и костномозгового депо; усиление лейкоцитопоэза в костном мозге; гиперпродукцию белков острой фазы в печени; развитие генерализованных форм иммунного ответа. Этап 3. Генерализация воспалительной реакции. При выраженном воспалении некоторые цитокины:TNF-a, IL-1, IL-6, IL-10, TGF-b, INF-g (при вирусных инфекциях) – могут проникать в системную циркуляцию, накапливаться там в количествах, достаточных для реализации своих эффектов. В случае неспособности ре Репертуар рецепторов мононуклеарного фагоцита (макрофага), через которые эта клетка врожденного иммунитета воспринимает активационные сигналы (CCR — варианты рецепторов для хемокинов; CD14 — рецептор для ЛПС; CR — варианты рецепторов для компонентов комплемента; FcR — рецептор для постоянного фрагмента 1д, TLR — один из вариантов сигнальных (Toll-like) рецепторов; TNFR — рецептор для TNFa). На этой стадии ССВР с позиций взаимодействия про- и антивоспалительных медиаторов возможно условное выделение 2 периодов. Первый, начальный – период гипервоспаления, характеризующийся выбросом сверхвысоких концентраций провоспалительных цитокинов, окиси азота (NO), что сопровождается развитием шока и ранним формированием синдрома полиорганной недостаточности (ПОН). Однако уже в данный момент происходит компенсаторное выделение антивоспалительных цитокинов, скорость их секреции, концентрация в крови и тканях постепенно нарастает, с параллельным снижением содержания медиаторов воспаления. Развивается компенсаторный антивоспалительный ответ, сочетающийся со снижением функциональной активности иммунокомпетентных клеток – период «иммунного паралича».
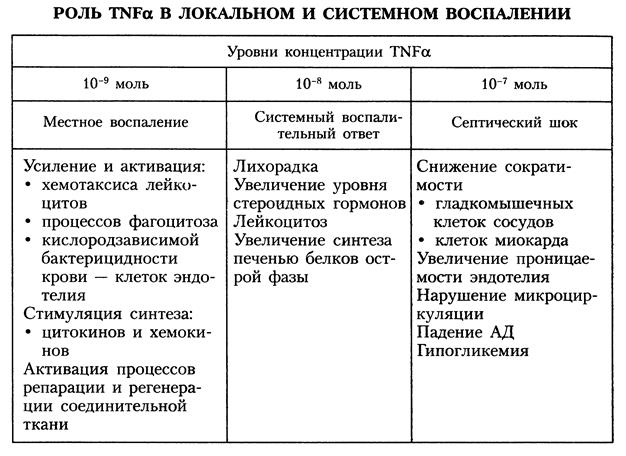
Грамположительные микроорганизмы не содержат в своей клеточной оболочке эндотоксин и вызывают септические реакции через другие механизмы. Запускающими септический ответ факторами могут являться компоненты клеточной стенки, такие как пептидогликан и тейхоевая кислота, стафилококковый протеин А и стрептококковый протеин М, расположенные на поверхности клеток, гликокаликс, экзотоксины. В этой связи комплекс реакций в ответ на инвазию грамположительными микроорганизмами является более сложным. Ключевым провоспалительным медиатором является ТNF (tumor necrosis factor). Стержневая роль TNF в развитии сепсиса связана с биологическими эффектами данного медиатора: повышение прокоагулянтных свойств эндотелия, активация адгезии нейтрофилов, индукция других цитокинов, стимуляция катаболизма, лихорадки и синтеза "острофазных" белков. С практической точки зрения чрезвычайно важно отметить, что скорость реакций септического каскада резко возрастает в условиях гипоксии из-за экспрессии цитокиновых рецепторов на поверхности клеток. В генезе острой сосудистой недостаточности, лежащей в основе септического шокового синдрома, ведущая роль отводится NО, концентрация которой увеличивается в десятки раз в результате стимуляции макрофагов ТNF; IL-1, IFN, а в дальнейшем секреция осуществляется и клетками гладкой мускулатуры сосудов и сами моноциты активируются под действием NО.
Рис. 2. Принципиальная схема патогенеза сепсиса (Никонов В.В., 1999).
В результате дисфункции печени, почек, кишечника появляются новые факторы повреждающего воздействия. В роли таковых выступают промежуточные и конечные продукты нормального обмена в высоких концентрациях (лактат, мочевина, креатинин, билирубин); накопленные в патологических концентрациях компоненты и эффекторы регуляторных систем (калликреин-кининовой, свертывающей, фибринолитической, ПОЛ, нейромедиаторы); продукты извращенного обмена (альдегиды, кетоны, высшие спирты), вещества кишечного происхождения типа индола, скатола, путресцина.
Дата добавления: 2015-11-26 | Просмотры: 751 | Нарушение авторских прав |
 гулирующих систем к поддержанию гомеостаза деструктивные эффекты цитокинов и других медиаторов начинают доминировать, что приводит к нарушению проницаемости и функции эндотелия капилляров, запуску синдрома ДВС, формированию отдаленных очагов системного воспаления, развитию моно- и полиорганной дисфункции. В качестве факторов системного повреждения могут выступать и любые нарушения гомеостаза, способные восприниматься иммунной системой как повреждающие или потенциально повреждающие.
гулирующих систем к поддержанию гомеостаза деструктивные эффекты цитокинов и других медиаторов начинают доминировать, что приводит к нарушению проницаемости и функции эндотелия капилляров, запуску синдрома ДВС, формированию отдаленных очагов системного воспаления, развитию моно- и полиорганной дисфункции. В качестве факторов системного повреждения могут выступать и любые нарушения гомеостаза, способные восприниматься иммунной системой как повреждающие или потенциально повреждающие.