 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Механізми дії гормонівДія гормонів проявляється через їх взаємодію з рецепторами клітин-мішеней, які можуть бути сконцентровані в одній тканині, або в кількох. Клітина-мішень відрізняє відповідний гормон від великої кількості інших молекул завдяки наявності на ній рецепторів із специфічним центром зв’язування з гормоном, що забезпечує їм високий ступінь вибірковості. Рецептори локалізуються у плазматичній мембрані клітин (для гормонів пептидної природи та адреналіну) або в їх цитоплазмі (для глюкокортикоїдів) чи ядрі (для статевих і тиреоїдних гормонів). Кількість рецепторів у клітині мінлива і регулюється кількістю власного гормону, або дією іншого гормону. Мішені – або гормонокомпетентні структури – чутливі до гормону біоструктури, які вибірково відповідають на взаємодію з гормоном певною реакцією. Залежно від ступеня впливу гормону на їх біологічні властивості, розрізняють гормонозалежні та гормоночутливі клітини. Прикладом гормонозалежних структур є тканини периферійних ендокринних залоз (щитоподібної, кори надниркових залоз) відносно дії тропних гормонів гіпофізу (ТТГ та АКТГ, відповідно). Гормоночутливими є клітини органів, що реагують на дію інсуліну, який контролює в них обмін глюкози, ліпідів та амінокислот (клітини м’язів, жирової тканини, лімфоїдної системи). 9.2.1. Типи гормональних рецепторів. Рецептори для фізіологічно активних сполук (гормонів та інших біорегуляторів) за своєю хімічною природою в більшості випадків належать до глікопротеїнів, на вільних поверхнях яких знаходяться олігосахаридні ланцюги (глікозильні групи). Відповідальні за розпізнавання зовнішніх сигналів. У мембранах однієї клітини може бути більше десятка різних типів рецепторів. Зв’язування гормона з рецептором здійснюється за рахунок іонних, ван-дер-ваальсових і гідрофобних взаємодій. Усі рецептори поділяються на два класи – мембранні та внутрішньоклітинні (цитозольні та ядерні), що різняться за своєю молекулярною організацією та послідовністю біохімічних реакцій, які включаються після взаємодії фізіологічно активних сполук (ФАС) із специфічними рецепторними білками. Мембранні рецептори можуть бути іонотропними та метаботропними. Іонотропні рецептори – інтегральні олігомерні білки, які складаються з кількох субодиниць, між якими знаходиться заповнений молекулами води канал. За певних зовнішніх впливів (зміна потенціалу на мембрані, дія медіатора чи гормона) ці рецептори вибірково змінюють проникність мембрани для конкретного виду іонів. У результаті взаємодії з ФАС субодиниці рецептора підтримують канал у відкритому стані, чим створюють умови для транспорту іонів (Са2+, Na+, K+, Cl- тощо). За відсутності стимулу в результаті зміни орієнтації субодиниць одна відносно одної канал закривається, блокуючи рух іонів у цій ділянці. Фізіологічними лігандами для іонотропних рецепторів є нейротрансмітери (ацетилхолін, адреналін, медіаторні амінокислоти тощо), що локалізовані в синапсах нейронів і в нервово-мм’язових пластинках. Метаботропні рецептори зв'язані не з іонними каналами, а з системами внутрішньоклітинних посередників. Зміна їх конформації після зв’язування з лігандом запускає низку біохімічних реакцій і. як наслідок, змінює функціональний стан клітини. Ці рецептори поділяють на дві групи: каталітичні рецептори, що мають власну тирозинкіназну або гуанілатциклазну активність (наприклад, рецептор інсуліну) і рецептори, що після взаємодії з ФАС викликають активацію біохімічних ефекторних систем клітини через G-білок (наприклад, рецептор вазопресину). Зв'язування ліганда (наприклад, гормона) з рецептором на зовнішній поверхні клітинної мембрани призводить до зміни активності цитоплазматичного фермента, який, своєю чергою, ініціює клітинну відповідь (тобто інформація переноситься через мембрану). Реакція ефекторних систем клітини на дію сполук, що взаємодіють з метаботропними рецепторами, є повільною і розвивається впродовж декількох секунд. У структурі мембранних рецепторів можна виділити три функціональних ділянки: перший домен (домен впізнавання) розташовується в N-кінцевій частині поліпептидного ланцюга на зовнішній поверхні клітинної мембрани, він містить глікозильовані ділянки та забезпечує впізнавання та зв’язування гормона; другий домен – трансмембранний – може складатися або з семи a-спіральних поліпептидних послідовностей, або лише з одного a-спірального поліпептидного ланцюга; третій (цитоплазматичний) домен створює хімічний сигнал у клітині, який забезпечує узгодженість між зв’язуванням гормона та певною внутрішньоклітинною відповіддю. Цитоплазматична ділянка рецептора до таких гормонів як інсулін, фактор росту епідермісу, інсуліноподібний фактор росту-1 на внутрішньому боці мембрани володіє тирозиназною активністю. У випадку внутрішньоклітинних рецепторів, які зв’язуються з білками-шаперонами, гормон проходить через мембрану, інформація про присутність гормону в клітині з допомогою рецептора передається в ядро. І цитозольні і ядерні рецептори стероїдних і тиреоїдних гормонів містять ДНК-зв’язуючий домен, вони теж мають три функціональні ділянки: - на С-кінці поліпептидного ланцюга рецептора знаходиться домен впізнавання та зв’язування гормона; - центральна частина рецептора включає домен зв’язування ДНК і містить амінокислотну послідовність, яка утворює 2 «цинкові пальці», у кожному з яких атом цинку зв’язаний із 4 залишками цистеїну; один «цинковий палець» відповідає за зв’язування з ДНК, а інший – за димеризацію рецепторів; - на N-кінці поліпептидного ланцюга розташовується домен, який називають варіабельною ділянкою рецептора. Вона відповідає за зв’язування з тими білками, з якими бере участь у регуляції транскрипції. Деякі рецептори крім основної ділянки (або «сайту») зв’язування можуть мати додаткові регуляторні ділянки, з котрими зв’язуються інші хімічні сполуки, які змінюють реакцію рецептора на основний гормональний сигнал – посилюють або послаблюють її, або заміщають собою основний сигнал. Класичним прикладом такого рецептора є рецептор гама-аміномасляної кислоти підтипу А (ГАМК). Окрім сайту зв’язування для самої ГАМК, він має сайти зв’язування з бензодіазепінами, барбітуратами, нейростероїдами (аллопрегненолоном). 9.2.2. Молекулярно-клітинні механізми дії пептидних гормонів та біогенних амінів. для гормонів поліпептидної будови та похідних амінокислот, які не проникають усередину клітини, характерний мембранно-внутрішньоклітинний механізм дії. Гормони цієї групи здійснюють трансформацію регуляторного сигналу в специфічну функціональну активність клітини-мішені за рахунок таких молекулярних механізмів: – взаємодії гормону на поверхні плазматичної мембрани з білковим рецептором з утворенням гормон-рецепторного комплексу; – передачі хімічного сигналу з рецептора, модифікованого за рахунок взаємодії з лігандом (гормоном, іншим біорегулятором), через трансформуючі білки – трансдуктори (G-білки) на внутрішньоклітинні сигнальні системи; – утворення (або вивільнення) внутрішньоклітинних сигнальних молекул – вторинних посередників (циклічних нуклеотидів - цАМФ, цГМФ, фосфоінозитолів, іонів Са 2+ ); – взаємодії вторинних посередників з ферментами клітини з включенням через активацію специфічних протеїнкіназ, ефекторних систем клітини, тобто послідовнихстадій розвитку клітинної біохімічної реакції на гормональний стимул. 9.2.2.1. Біохімічні системи забезпечення внутрішньоклітинної передачі гормонального сигналу. Система трансдукції хімічного сигналу, що його сприймає клітина від біорегулятора, включає взаємодію модифіковоного гормон-рецепторного комлексу з білками-трансдукторами, які здійснюють трансформацію та подальшу передачу регуляторного сигналу. Білки – трансдуктори (G-білки або N - білки) – внутрішньомембранні білки, які сприймають хімічний сигнал від рецептора, модифікованого за рахунок взаємодії з гормоном або медіатором, та спричиняють зміни функціональної активності ефекторних систем клітини. Відомо понад 200 різноманітних G-білків, які поділяють на декілька типів: Gs – білки (стимулюючі) активують аденілатциклазу, що сприяє утворенню головного вторинного посередника – цАМФ; Gi – білки (інгібуючі) інгібують аденілатциклазу; Gq – білки активують фосфоліпазу С – фермент, який спричинює запуск фосфоінозитолного циклу – ферментної системи, яка підвищує концентрацію Са2+ в цитозолі за рахунок його вивільнення з внутрішньоклітинних депо. За молекулярної будовою вони є тримерами, що складаються з трьох субодиниць (α, β, γ). α-субодиниця володіє ГТФазною активністю: утворення гормон-рецепторного комплексу та передача регуляторного сигналу на каталітичну субодиницю ферменту аденілатциклази супроводжується конформаційними змінами α-субодиниці, гідролізом ГТФ до ГДФ та Фн і відщепленням димера βγ від α-ГТФ. G-білок повертається в неактивну форму. При наступній активації рецептора і заміні молекули ГДФ на ГТФ цикл повторюється. Таким чином, α-субодиниця G-білка здійснює човниковий рух, переносить сигнал від рецептора, активованого первинним посередником (гормоном) на фермент, який каталізує утворення вторинного посередника. Вторинні посередники – циклічні нуклеотиди. Сигнал на подальше включення каскаду біохімічних реакцій передається вторинними посередниками, або месенджерами (messenger – посланець. вісник, англ.) – біомолекулами, що передають інформацію від гормону (первинного месенджера) на ефекторні системи клітини. До вторинних месенджерів належать: циклічні нуклеотиди – циклічний аденозинмонофосфат (3 ',5'-АМФ; цАМФ) і циклічний гуанозинмонофосфат (3',5' -ГМФ, цГМФ), фосфоінозитоли та іони Са2+. Зростання внутрішньоклітинної (цитозольної) концентрації зазначених вторинних посередників здійснюється шляхом: – активації аденілатциклази з утворенням цАМФ; – активації гуанілатциклази з утворенням цГМФ; – активації фосфоліпази С, що призводить до включення фосфоінозитолного каскаду – механізму мобілізації внутрішньоклітинного Са2+; – надходження Са2+ з екстрацелюлярного простору за рахунок відкриття кальцієвих каналів на плазматичній мембрані (механізм, більш притаманний іонотропним рецепторам). Шляхи біосинтезу цАМФ та цГМФ відрізняються й реалізуються через різні регуляторні системи, однак механізми їх дії на клітинну активність подібні і пов’язані з вибірковим фосфорилуванням функціонально важливих клітинних білків. Обмін і функції циклічних нуклеотидів у клітинах забезпечуються комплексом ферментів, що об'єднують в аденілат- і гуанілатциклазні системи. Гормони, взаємодія яких з рецептором клітини-мішені призводить до утворення цАМФ, діють через трикомпонентну систему, яка включає білок-рецептор (Rs або RІ), G-білок (Gs або Gi) і власне фермент аденілатциклазу, яка розташована на внутрішній поверхні мембрани і каталізує утворення цАМФ з АТФ. Фермент аденілатциклаза – ключовий фермент аденілатциклазної системи, містить 12 трансмембранних доменів. На його активність впливають як позаклітинні, так і внутрішньоклітинні регулятори. Позаклітинні регулятори (гормони, ейкозаноїди, біогенні аміни) здійснюють регуляцію через специфічні рецептори, які за допомогою a- субодиниць G-білків передають сигнали на аденілатциклазу. Із 8 вивчених ізоформ аденілатциклази чотири – Са2+-залежні. Регуляція аденілатциклази внутрішньоклітинним кальцієм дозволяє клітині інтегрувати активність двох основних вторинних месенджерів – цАМФ та іонів Са2+. До гормонів, що використовують цАМФ як вторинний посередник, належать адреналін, возопресин, глюкагон, хоріонічний гонадотропін, дофамін (при взаємодії з D1-рецепторами), кальцитонін, кортикотропін, ліпотропін, лютеїнізуючий гормон, меланоцитостимулюючий гормон, норадреналін (при взаємодії з β-рецепторами), тиреотропний гормон, фолікулостимулюючий гормон. Поряд з гормонами та медіаторами, що активують аденілатциклазну каскадну систему (діють через трансдуктор Gs), існує певна група біорегуляторів, що гальмують аденілатциклазу і зменшують внутрішньоклітинний рівень цАМФ (діють через Gi-білок). До біорегуляторів, що інгібують аденілатциклазу, належать ангіотензин ІІ, ацетилхолін (при взаємодії з м-холінорецепторами), дофамін (при взаємодії з D2-рецепторами), норадреналін (при взаємодії з α2-адренорецепторами), опіоїдні пептиди, соматостатин. На аденілатциклазний шлях передачі сигналу в клітину впливають деякі бактеріальні токсини. Наприклад, токсин, який утворює холерний вібріон, каталізує реакцію перенесення АДФ-рибози з НАД на α-ланцюг Gs-білка (реакція рибозилування), що переводить білок у постійно активний стан з втратою чутливості до гормональних сигналів. Унаслідок цього в клітинах кишки зростає рівень цАМФ, який викликає інтенсивну секрецію кишкового соку. Тому при холері швидко розвивається тяжка діарея та дегідратація організму. Отже, дія холерного токсину – незворотного активатора аденілатциклази – ґрунтується на тому, що він викликає активацію Gs-білка, підтримуючи Gs-субодиницю в активному стані. Екзотоксин кашлюка каталізує рибозилування α-субодиниці Gі-білка, що зумовлює блокування передачі гальмівних сигналів від гормональних рецепторів на аденілатциклазу, у результаті активність аденілатциклази та рівень цАМФ у клітинах також зростає. Внаслідок дії гормонів, що активують аденілатциклазу, у клітині підвищується рівень цАМФ. Останній зв'язується з неактивним тетрамером протеїнкінази, внаслідок чого відбувається його дисоціація на 2 регуляторні та 2 каталітичні субодиниці і в такий спосіб активуються каталітичні субодиниці, тобто протеїнкіназа переходить з неактивної форми в активну (рис. 9.2). Активні протеїнкінази каталізують фосфорилування різних білків (у тому числі, ферментів) за схемою:
Білки, що утворилися під час фосфорилування, викликають різноманітні біологічні ефекти. Одні білки після фосфорилування протеїнкіназами активуються, активність інших гальмується. Наприклад, при дії адреналіну та глюкагону – гормонів, що збільшують рівень цАМФ у клітинах, активовані протеїнкінази фосфорилують глікогенфосфорилазу, переводять її із неактивної форми в активну і забезпечують розпад глікогену в печінці та скелетних м'язах. У цей же час у результаті фосфорилування відбувається інактивація ферменту глікогенсинтази, що призводить до гальмування синтезу глікогену.
Зміна кількості цАМФ в клітині під впливом різних гормонів може здійснюватися через фосфодіестеразу, яка каталізує гідроліз цАМФ (або цГМФ) з утворенням неактивного метаболіту АМФ (або ГМФ). Її активаторами є іони Са2+, комплекс 4 Са2+-кальмодулін, цГМФ. Речовини, які інгібують фосфодіестеразу, чинять ефект, подібний до дії гормону, наприклад, інгібітори фосфодіестерази похідні ксантинів (кофеїн, еуфілін, теофілін) підвищують рівень цАМФ, імітуючи ефект, який створюють ендогенні гормони. Аналогічно як у випадку з цАМФ, гормони та інші позаклітинні регулятори стимулюють утворення циклічного нуклеотиду – цГМФ під дією ферменту гуанілатциклази, яка існує в розчинній і мембранозв’язаній формах. Активування гуанілатциклази призводить до утворення цГМФ з ГТФ. Циклічний ГМФ активує цГМФ-залежну протеїнкіназу G, яка фосфорилує білки. На відміну від протеїнкінази А, протеїнкіназа G присутня не у всіх тканинах, її виявляють у легенях, гладких м’язах, мозочку та тромбоцитах. Ізоформи протеїнкінази G можуть бути зв’язані з мембраною або знаходяться в цитоплазмі. Розчинна протеїнкіназа G складається з двох субодиниць, кожна з яких має два центри для зв’язування цГМФ. Приєднання останнього до регуляторних центрів спричинює конформаційні зміни субодиниць і посилює каталітичну активність фермента. Подібно до протеїнкіназ А і С, протеїнкіназа G специфічна до певних білкових субстратів, котрі вона фосфорилує за залишками серину та треоніну. Вторинні посередники – іони кальцію, інозитолтрифосфат і діацилгліцерол. Іони кальцію – внутрішньоклітинні месенджери та регулятори багатьох ферментних систем і фізіологічних функцій клітин, зокрема поділу та росту, клітин, скорочення м'язових та інших скоротливих білків, згортання крові, секреції гормонів і нейромедіаторів, передачі нервового імпульсу тощо. Їх внутрішньоклітинна концентрація дуже низька (10–7 моль/л) порівняно з позаклітинною (10–3 моль/л). Регуляторна функція Са2+ (передавання сигналу від гормону, медіатора та активація ефекторних біохімічних систем) здійснюється шляхом зростання внутрішньоклітинної (цитозольної) концентрації цих іонів (від 10-7 – 10-9 до 10-6 М). Це значне зростання концентрації вільного Са2+ здійснюється шляхом включення зовнішньоклітинним біорегулятором одного з таких механізмів: - відкриття кальцієвих каналів (рецепторчутливих каналів) на плазматичній мембрані та входу в клітину екстрацелюлярного Са2+ (механізм, що реалізується здебільшого при взаємодії нейромедіаторів з іонотропними рецепторами); - виходу іонів кальцію у цитозоль з його внутрішніх депо – мітохондрій і цистерн (канальців) ендоплазматичного (саркоплазматичного) ретикулуму (мобілізація кальцію з внутрішніх депо); включення цього механізму потребує стимуляції гормоном чи іншим біорегулятором фосфоінозитидної системи, інтермедіати якої і спричиняють вихід кальцію з органел. Перехід клітини із стану активації до функціонального спокою відбувається в результаті зменшення цитозольної концентрації кальцію до вихідної, що забезпечується «викачуванням» Са2+ з цитозолю в екстрацелюлярний простір і «закачуванням» іонів у внутрішньоклітинні депо. Цей процес є енергозалежним транспортом проти градієнта концентрації і досягається за рахунок функціонування Са2+-АТФаз плазматичних мембран і мембран внутрішньоклітинних органел. Універсальним акцептором хімічного регуляторного сигналу від іонів Са2+ є кальмодулін (КМ) – білок з молекулярною масою близько 17 000 Да, який може зв'язувати чотири іони кальцію. Специфічне зв'язування Са2+ з молекулою КМ призводить до змін конформації білка, який набуває властивості взаємодіяти з чутливими до КМ білками, у тому числі активувати цАМФ-залежну фосфодіестеразу, Са2+–кальмодулінзалежні протеїнкінази, Са2+-АТФазу плазматичних мембран кардіоміоцитів і еритроцитів, кіназу фосфорилази м'язів й інші ферменти. При підвищенні внутрішньоклітинної концентрації Са2+ підвищується активність гуанілатциклази і синтез цГМФ. Вважають, що швидкі ефекти кальцію пов'язані iз мобілізацією його з органел клітини, а повільні – із надходженням ззовні або зі зменшенням виходу кальцію з клітини. Таким чином, вплив гормонів або медіаторів, що збільшують потік іонів Са2+ всередину клітин, повинен був би спричинити стійке підвищення його концентрації в цитозолі. Однак цього не відбувається, оскільки комплекс Са2+-КМ активує Са2+-помпи, внаслідок чого викачування кальцію з клітини зрівноважує збільшення його потоку всередину клітини. Така циркуляція Са2+ відіграє роль посередника при тривалих клітинних реакціях, оскільки призводить до зміни концентрації Са2+ у “примембранній” зоні. Встановлення біологічної ролі деяких фосфоінозитидів, що спричинюють вихід кальцію із внутрішньоклітинних депо, відкрило додатковий механізм у дії гормонів – фосфоінозитолну систему. Система фосфоінозитолного циклу включає три етапи: 1) взаємодія гормону з рецептором з подальшим зростанням спорідненості до G-білка та утворенням a-ГТФ; 2) метаболізм ліпідного матриксу, зокрема, фосфатидилінозитидів; 3) подальші реакції індукції вивільнення Са2+ з клітинних депо, фосфорилування мембраних і цитозольних білків.
Інший продукт гідролізу – ДАГ активує Са2+-фосфоліпідзалежну протеїнкіназу С, яка переміщається з цитоплазми в плазматичну мембрану, де її чутливість до активації кальцієм збільшується у понад 100 разів. Активність протеїнкінази С додатково стимулюють іони Са2+ та фосфатидилсерин. Спільна дія Са2+-залежних протеїнкіназ і протеїнкінази С зумовлює активацію шляхом фосфорилування низки клітинних білків, які беруть участь у реалізації клітинної відповіді (секреція гормонів, нейромедіаторів, ферментів, скорочення м'язів, агрегації тромбоцитів, транспорту іонів, глюкози та інших речовин через мембрани). Припинення передачі сигналу через фосфоінозитолну систему здійснюється завдяки інактивації вторинних посередників і дефосфорилування білків. Від ІФ3 поступово відщеплюються фосфатні групи. Цей процес інгібують іони літію, надмірне надходження яких в організм призводить до порушень обміну фосфоінозитолів. Цей ефект, очевидно, лежить в основі терапевтичної дії іонів літію при маніакально-депресивних психозах. ДАГ інактивується двома шляхами. Частина його перетворюється на фосфатидну кислоту, а інша розщеплюється до вихідних компонентів – гліцеролу та жирних кислот, зокрема арахідонової – попередника простагландинів і лейкотрієнів. Із фосфатидної кислоти та інозитолу синтезується фосфатидилінозитол і далі фосфатидилінозитол-4,5-дифосфат. Для цього використовуються молекули ЦТФ і АТФ. Через фосфоінозитолну систему реалізується дія катехоламінів (при їх зв'язуванні з α1-адренорецепторами), тиреоліберину, гонадоліберину, вазопресину, ангіотензину ІІ, гастрину, холецистокініну, брадикініну та інших гормонів.
Інсуліновий рецептор – тирозинова протеїнкіназа, яка фосфорилує білки за ОН-групами тирозину. Він складається з двох a- і двох b-субодиниць, з’єднаних між собою дисульфідними зв’язками та нековалентними взаємодіями (рис. 9.4). Субодиниці за хімічною природою належать до глікопротеїнів, вуглеводна частина яких знаходиться на зовнішній поверхні мембрани. Центр зв’язування інсуліну утворений N-кінцевими доменами a-субодиниць. b-Субодиниці пронизують мембранний бішар, вони не беруть участі в зв’язуванні інсуліну, але на їх внутрішньоклітинних доменах знаходиться каталітичний центр тирозинової протеїнкінази. За відсутності інсуліну рецептори не проявляють тирозинкіназної активності. Приєднання інсуліну до a-субодиниць активує фермент, для якого субстратом слугують самі b-субодиниці, тобто відбувається їх трансфосфорилування (одна b-субодиниця фосфорилує іншу) за кількома тирозиновими залишками. Це, своєю чергою, призводить до зміни субстратної специфічності тирозинової протеїнкінази, вона набуває здатності фосфорилувати інші транспортні білки, про що говорилося вище. Дефосфорилування рецептора та його повернення в неактивний стан відбувається за участі тирозинової фосфопротеїн фосфатази; спорідненість між інсуліном і рецептором втрачається у випадку фосфорилування останнього протеїнкіназою А за залишками серину та треоніну. 9.2.3. Молекулярно-клітинні механізми дії стероїдних і тиреоїдних гормонів на генетичний апарат клітини. стероїдні гормони, похідні вітамінів групи D, а також йодтироніни, які за ліпофільністю займають проміжне положення між стероїдами та водорозчинними гормонами, молекули яких здатні проникати через ліпідній бішар плазматичної мембрани клітин, проявляють свою дію за допомогою цитозольного механізму.
Молекулярний механізм дії стероїдних і тиреоїдних гормонів реалізується за рахунок послідовності таких клітинних та біохімічних реакцій: проникнення гормона в клітину → взаємодія гормона з цитозольним рецептором зі зміною конформації останнього та зниження спорідненості до білків-шаперонів, які від’єднуються від комплексу гормон-рецептор → утворення гормон-рецепторного комплексу → транслокація гормон-рецепторного комплексу в ядро → взаємодія комплексу зі специфічною ділянкою ДНК хроматину (енхансером або сайленсером) → зростання (при взаємодії з енхансером) або зниження (при взаємодії з сайленсером) доступності промотора для РНК-полімерази → збільшення (або зменшення) швидкості транскрипції мРНК → збільшення (або зменшення) швидкості трансляції → зміна кількості ферментних білків, які реалізують дію гормона (рис. 9.5). Взаємодія білкових рецепторів гормонів з ДНК відбувається в певних місцях промоторних ділянок геному, що знаходяться "зліва" від сайтів ініціації транскрипції (приблизно 250 нуклеотидів) і регулюють експресію розташованих на відстані генів (справа від промотора та сайта ініціації транскрипції). Ділянки ДНК, які можуть взаємодіяти з доменами гормонального рецептора, мають будову паліндромів і складаються із специфічних для кожного рецептора нуклеотидних послідовностей з 6 пар нуклеотидів, розташованих зліва та справа від проміжної 3-нуклеотидної послідовності (–NNN-)-"спейсера". У взаємодії стероїдних і тиреоїдних рецепторів зі специфічними ділянками ДНК беруть участь певні ділянки рецепторних білків, які мають будову "цинкових пальців" (білки, що містять біля 20 амінокислотних залишків, в яких атоми цинку зв'язуються з радикалами чотирьох амінокислот, переважно з 2-ма залишками цистеїну та 2–ма залишками гістидину) та глобулярних Zn-вмісних доменів, властивих білкам, що виступають як регулятори транскрипції. Отже, на відміну від білкових гормонів, що спричинюють активацію ферментів, дія на клітини-мішені стероїдних гормонів призводить до стимуляції біосинтезу нових ферментних молекул за рахунок активації процесів транскрипції їх мРНК. Підсумовуючи все вищесказане, основні етапи передачі гормонального сигналу можна відобразити наступною схемою:
Рис. 9.6. Порівняльна схема передачі гормонального сигналу через мембранні та внутрішньоклітинні рецептори Зі схеми видно, що в залежності від способу передачі гормонального сигналу в клітинах змінюється швидкість реакцій метаболізму або шляхом зміни активності фермента, або ж шляхом зміни його кількості.
Дата добавления: 2015-11-28 | Просмотры: 3633 | Нарушение авторских прав |
 Аденілатциклазна система каталізує утворення цАМФ з АТФ, а гуанілатциклазна – утворення цГМФ з ГТФ.
Аденілатциклазна система каталізує утворення цАМФ з АТФ, а гуанілатциклазна – утворення цГМФ з ГТФ.
 За допомогою цАМФ можуть здійснюватися два основних шляхи регуляції активності ферментів: перший – зміна активності молекул ферментів, за рахунок їх ковалентної модифікації, тобто фосфорилування. Другий шлях – зміна кількості фермента за рахунок зміни швидкості його біосинтезу та деградації. Встановлено, що деякі цАМФ-залежні протеїнкінази можуть проникати в ядро клітини і фосфорилувати специфічні білки, які, зв'язуючись з певними ділянками хроматину, впливають на транскрипцію генів.
За допомогою цАМФ можуть здійснюватися два основних шляхи регуляції активності ферментів: перший – зміна активності молекул ферментів, за рахунок їх ковалентної модифікації, тобто фосфорилування. Другий шлях – зміна кількості фермента за рахунок зміни швидкості його біосинтезу та деградації. Встановлено, що деякі цАМФ-залежні протеїнкінази можуть проникати в ядро клітини і фосфорилувати специфічні білки, які, зв'язуючись з певними ділянками хроматину, впливають на транскрипцію генів.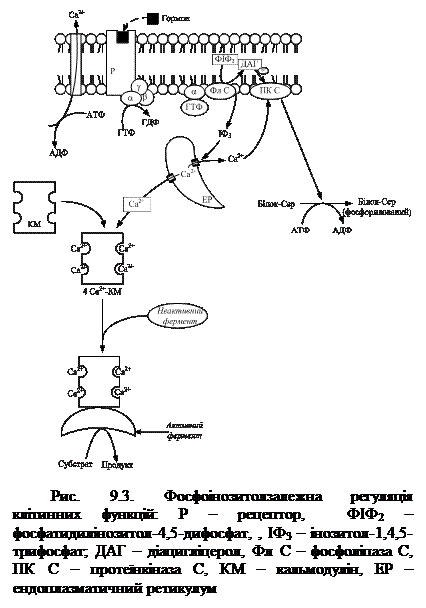 Фосфоліпаза С, яка активується внаслідокзв’язування з нею a-ГТФ, розщеплює фосфатидилінозитол-4,5-дифосфат (ФІФ2), який є одним з компонентів плазматичної мембрани, до інозитол-1,4,5-трифосфату (ІФ3) і діацилгліцеролу (ДАГ), які є вторинними посередниками. ІФ3 спричинює вивільнення іонів кальцію з клітинних депо, що на короткий час збільшує їх концентрацію в цитоплазмі і сприяє утворенню комплексів Са2+-КМ, які активують специфічні протеїнкінази (рис. 9.3).
Фосфоліпаза С, яка активується внаслідокзв’язування з нею a-ГТФ, розщеплює фосфатидилінозитол-4,5-дифосфат (ФІФ2), який є одним з компонентів плазматичної мембрани, до інозитол-1,4,5-трифосфату (ІФ3) і діацилгліцеролу (ДАГ), які є вторинними посередниками. ІФ3 спричинює вивільнення іонів кальцію з клітинних депо, що на короткий час збільшує їх концентрацію в цитоплазмі і сприяє утворенню комплексів Са2+-КМ, які активують специфічні протеїнкінази (рис. 9.3). Мембранний механізм дії гормонів. Існують гормони (наприклад, інсулін, інсуліноподібні фактори росту (ІФР-1, ІФР-2), передача сигналу від яких здійснюється без участі вторинних посередників, для них характерний мембранний механізм дії. Зв’язуючись із рецепторами на поверхні плазматичних мембран адипоцитів, інсулін змінює їх проникність для низки метаболітів (глюкози, амінокислот) та іонів. Така зміна проникності мембрани відбувається внаслідок зв’язування гормону з її транспортними системами, що спричинює або зміну конформації транспортних білків (внаслідок фосфорилування) або збільшення кількості білків-переносників, які містяться всередині клітини, а під впливом гормону переміщаються в плазматичну мембрану. Потрапивши всередину клітини, метаболіти чинять вплив на біохімічні процеси, а іони змінюють електричний потенціал мембрани. Після припинення дії гормону більшість переносників залишають мембрану.
Мембранний механізм дії гормонів. Існують гормони (наприклад, інсулін, інсуліноподібні фактори росту (ІФР-1, ІФР-2), передача сигналу від яких здійснюється без участі вторинних посередників, для них характерний мембранний механізм дії. Зв’язуючись із рецепторами на поверхні плазматичних мембран адипоцитів, інсулін змінює їх проникність для низки метаболітів (глюкози, амінокислот) та іонів. Така зміна проникності мембрани відбувається внаслідок зв’язування гормону з її транспортними системами, що спричинює або зміну конформації транспортних білків (внаслідок фосфорилування) або збільшення кількості білків-переносників, які містяться всередині клітини, а під впливом гормону переміщаються в плазматичну мембрану. Потрапивши всередину клітини, метаболіти чинять вплив на біохімічні процеси, а іони змінюють електричний потенціал мембрани. Після припинення дії гормону більшість переносників залишають мембрану. Специфічні рецептористероїдних та тиреоїдних гормонів містяться в цитоплазмі клітин-мішеней. Вони є білками з молекулярною масою 50 – 190 кДа, мають високу спорідненість до свого гормону за рахунок стереоспецифічності.
Специфічні рецептористероїдних та тиреоїдних гормонів містяться в цитоплазмі клітин-мішеней. Вони є білками з молекулярною масою 50 – 190 кДа, мають високу спорідненість до свого гормону за рахунок стереоспецифічності.