|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
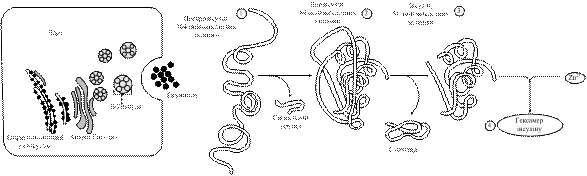
Гормони підшлункової залозиПідшлункова залоза – непарний ендокринний орган, розташований у черевній порожнині. Вона є залозою змішаної секреції: ацинарна частина залози виконує екзокринну функцію – секретує в просвіт дванадцятипалої кишки ферменти та іони, що беруть участь у процесах травлення; ендокринна частина представлена острівцями Лангерганса, що складаються з клітин різних типів, які здійснюють синтез і секрецію низки гормонів: a-клітини секретують глюкагон, β-клітини (70 % острівкової тканини) – інсулін, δ-клітини – соматостатин, F-клітини – панкреатичний поліпептид (ПП). Інсулін (від лат. insula – острівець) – це простий глобулярний білок із молекулярною масою 5 700 Да. Його молекула містить 51 амінокислотний залишок і побудована з двох поліпептидних ланцюгів, з'єднаних між собою двома дисульфідними містками. А ланцюг складається з 21 амінокислотного залишка, а В ланцюг – з 30. Попередником інсуліну є препроінсулін (104 амінокислотних залишки), він містить на N-кінці молекули сигнальний пептид – гідрофобну послідовність із 23 амінокислот, що спрямовує пептидний ланцюг всередину ендоплазматичного ретикулуму. Після відщеплення сигнального пептиду (під впливом протеїназ) відбувається замикання дисульфідних містків і утворюється проінсулін (78 – 86 амінокислотних залишків, у залежності від виду організму). Останній надходить в апарат Гольжді і депонується в клітинних везикулах (β-гранулах), де шляхом відщеплення С-пептиду (35 амінокислотних залишків) утворюється зрілий інсулін, який зберігається в формі цинквмісного гексамера аж до процесу секреції шляхом екзоцитозу (рис. 14.8).
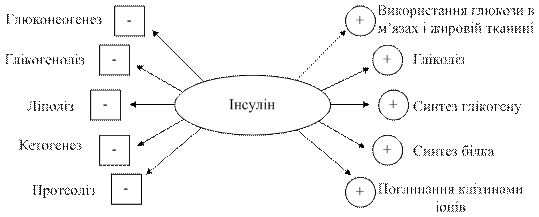
Рис. 14.8. Схема біосинтезу інсуліну Щодоби підшлункова залоза людини секретує в кров 40 – 50 од. інсуліну, що становить 15 – 20 % від усього його запасу в залозі. Період його розпаду становить 3 – 5 хв. Основним сигналом для синтезу та секреції інсуліну є підвищення рівня глюкози в крові. Секреція інсуліну у відповідь на підвищення рівня глюкози носить двофазний характер: негайна відповідь (І фаза) розпочинається в межах 1 хв після зростання концентрації глюкози і триває впродовж 5 – 10 хв, після чого настає повільніша та триваліша ІІ фаза, яка припиняється після нормалізації рівня глюкози. На секрецію інсуліну впливають також швидкість зміни концентрації глюкози в плазмі та гормони травного тракту – секретин, холецистокінін, гастрит, ентероглюкагон і, особливо, шлунковий інгібувальний поліпептид. Тривалий вплив надлишкової кількості гормону росту, кортизолу, естрогенів і прогестинів посилює секрецію інсуліну. Низка лікарських препаратів, особливо похідні сульфонілсечовини, теж стимулюють секрецію інсуліну. Для лікування цукрового діабету ІІ типу широко застосовують фармпрепарат тол бутамід, який стимулює секрецію інсуліну відмінним від глюкози способом. Інсулін не має специфічного білка-переносника в плазмі крові. Частина гормону зв'язується з глобулінами, тому в крові він знаходиться в двох формах – вільній і зв'язаній. Руйнування інсуліну відбуваються, в основному, у печінці, нирках і плаценті і забезпечується двома ферментними системами: інсулінспецифічною протеїназою і печінковою глутатіонінсулінтрансгідрогеназою, яка відновлює дисульфідні зв'язки і забезпечує протеоліз відокремлених один від одного А- і В-ланцюгів інсуліну. Інсулін діє, зв’язуючись зі специфічними рецепторами цитоплазматичних мембран інсулінозалежних тканин. Кількість мембранних рецепторів у гепатоцитах досягає 250 000, але у зв’язуванні інсуліну бере участь 10 – 13 % від їх загальної кількості у клітині. Молекулярний механізм дії інсуліну реалізується за мембранним типом з утворенням інсулін-рецепторного комплексу, який підвищує проникність клітинних мембран до глюкози, амінокислот тощо, про що було сказано раніше. Інсулін також полегшує проникнення іонів кальцію в клітини. Це збільшує активність гуанілатциклази та призводить до синтезу цГМФ. За участі останнього та іонів кальцію інсулін впливає на реплікацію, прискорюючи синтез ДНК і РНК, що призводить до посилення синтезу білків. Одночасно іони кальцію активують фосфодіестеразу, яка гідролізує цАМФ. Зниження концентрації кальцію призводить до гальмування глікогенолізу, глюконеогенезу, а також ліполізу. Порушення структури або спорідненості рецептора до інсуліну, активації протеїнкінази або порушення з’єднання між субодиницями є основною причиною цукрового діабету ІІ типу. Інсулін впливає на низку процесів у клітинах органів-мішеней, але найважливішу роль він відіграє в регуляції вуглеводного обміну (рис. 9.10).
Рис. 9.10. Дія інсуліну на метаболічні процеси: «+» - стимуляція; «-» пригнічення
Вплив гормону на метаболізмвуглеводів виявляється передусім у зниженні рівня глюкози в крові. Інсулін - єдиний гормон гіпоглікемічної дії, в цей час як адреналін, глюкагон, кортизол є антагоністами інсуліну відносно їх впливу на концентрацію глюкози в крові. Цей ефект гормону реалізується як на мембранному рівні, так і шляхом посилення внутрішньоклітинної утилізації глюкози. Взаємодія інсуліну з рецепторами збільшує проникність мембран м'язових і жирових клітин для глюкози, яка проникає в клітини шляхом полегшеної дифузії за допомогою білків-переносників. На відміну від жирової і м'язової тканин, транспорт глюкози через мембрани гепатоцитів не є інсулінозалежним. Однак опосередковано (за рахунок збільшення швидкості фосфорилування глюкози та зниження концентрації вільної глюкози в клітині) він посилює її транспорт в гепатоцити шляхом простої дифузії за градієнтом концентрації. Утилізація глюкози в м'язах, печінці, жировій тканині відбувається кількома шляхами: – гліколізом (за рахунок активіації синтезу глюкокінази – ферменту, що перетворює глюкозу на глюкозо-6-фосфат, а також фосфофруктокінази та піруваткінази); – пентозофосфатним шляхом (за рахунок активації глюкозо-6-фосфатдегідрогенази); – синтезом глікогену (за рахунок активації глюкокінази, що призводить до утворення додаткової кількості глюкозо-6-фосфату, який може перетворюватися на глюкозо-1-фосфат – субстрат глікогенезу). Гальмування глюконеогенезу в печінці під впливом інсуліну зумовлено пригніченням активності фосфоенолпіруваткінази, фр-1,6-дифосфатази та глюкозо-6-фосфатази. Вплив інсуліну та обмін ліпідів характеризується стимуляцією анаболічних процесів, що зумовлено таким ефектами: – активацією синтезу жирних кислот із субстратів метаболізму глюкози - ацетил-КоА та НАДФ; – активацією синтезу тріацилгліцеролів із жирних кислот і гліцерол-3-фосфату, який утворюється при розщепленні глюкози (з діоксіацетонфосфату в гліцерол-3-фосфатдегідрогеназній реакції); – гальмуванням ліполізу в адипоцитах внаслідок зменшення концентрації цАМФ, необхідного для активації тригліцеридліпази, протидії ліполітичному впливу катехоламінів і глюкагону. Вплив інсуліну на обмін білків найпомітніший у м'язах, печінці, нирках, сполучній тканині і характеризується: – стимуляцією транспорту амінокислот через плазматичні мембрани (особливо у м'язах); – активацією процесів рибосомальної трансляції синтезу рРНК та деяких мРНК (у печінці, м'язах, нирках, сполучній тканині). Інсулін має виражені рістстимулюючі ефекти, що обумовлено, з одного боку, посиленим надходження у клітину енергетичних і пластичних субстратів для росту (глюкози, жирних кислот, амінокислот), а з іншого - безпосереднім впливом на біосинтез ДНК, прискорення переходу клітин у S-фазу. подібно до фактора росту епідермісу, фактора росту фібробластів, тромбоцитарного фактора росту (дія яких посилюється інсуліном) інсулін посилює процеси проліферації. Він підтримує ріст і реплікацію багатьох клітин епітеліального походження, у тому числі гепатоцитів, клітин гепатоми, клітин пухлини кори надниркових залоз і клітин карциноми молочної залози Нестача інсуліну призводить до розвитку цукрового діабету, про що детально говорилося в розділі «Обмін вуглеводів і його порушення». Надлишковий синтез інсулінуможе спостерігатися при інсуліномі - пухлині острівцевих клітин підшлункової залози. При цьому виникає гіпоглікемія, обумовлена не тільки посиленим споживанням глюкози тканинами, чутливими до інсуліну, і зменшенням утворення глюкози в печінці, але також зниженням надходження в печінку субстратів для глюконеогенезу. Швидке зниження рівня глюкози в крові призводить до активації симпатичної нервової системи і виділення адреналіну. Такі патохімічні зміни клінічно проявляються занепокоєнням, слабкістю та відчуттям голоду. Якщо гіпоглікемія є тривалою, то зменшення надходження глюкози в мозок призводить до неврологічних порушень. Глюкагон – одноланцюговий поліпептид з молекулярною масою 3 485 Да, що містить 29 амінокислотних залишків. Він синтезується в α-клітинах підшлункової залози у вигляді неактивного попередника препроглюкагону, який після відщеплення N-кінцевої сигнальної послідовності амінокислот перетворюється на проглюкагон, а після дії протеаз – на глюкагон. Секрецію глюкагону стимулюють амінокислоти, гастрин, катехоламіни, сповільнюють – глюкоза, інсулін, жирні кислоти та Са2+. Основним органом-мішенню для глюкагону є печінка, однак до гормону чутлива також жирова тканина і, меншою мірою, м'язова. Дія глюкагону, як і інших поліпептидних гормонів, здійснюється завдяки посередникам, основним з яких є цАМФ. Гормон зв'язується зі своїми рецепторами на плазматичній мембрані клітин-мішеней і активує аденілатциклазу. Вплив глюкагону на обмін вуглеводів проявляється посиленням розпаду глікогену в печінці шляхом активації глікогенфосфорилази та гальмуванням його синтезу внаслідок інгібування глікогенсинтази шляхом цАМФ-залежного фосфорилування. Підвищений вміст цАМФ гальмує гліколіз і індукує глюконеогенез, активуючи синтез фосфоенолпіруваткінази, глюкозо-6-фосфатази та фруктозо-1,6-дифосфатази. Таким чином, основний ефект глюкагону – гіперглікемія – забезпечується двома механізмами: швидким – глікогенолізом і повільним – глюконеогенезом. Регуляція обміну ліпідів проявляється потужною ліполітичною дією гормону. Шляхом підвищення вмісту цАМФ у клітинах жирової тканини глюкагон активує триацилгліцеролліпазу, збільшує в крові рівень гліцеролу та неестерифікованих жирних кислот, які використовуються як джерело енергії, а також перетворюються на кетонові тіла. Регуляція гормоном обміну білків здійснюється шляхом гальмування їх синтезу в печінці та посиленням катаболізму. Утворені при цьому амінокислоти використовуються в глюконеогенезі та в синтезі сечовини. Таким чином, на противагу інсуліну глюкагон стимулює мобілізацію основних енергоносіїв – вуглеводів і жирів. Соматостатин – циклічний пептид, який синтезується D-клітинами острівців підшлункової залози у вигляді прогормона з молекулярною масою приблизно 11 500 Да, який у кінцевому результаті перетворюється на молекулу з молекулярною масою 1 640 Да, що містить 14 амінокислотних залишків і дисульфідний зв'язок між двома залишками цистеїну. Окрім підшлункової залози, соматостатин синтезується в гіпоталамусі, тканинах травного тракту, а також у різних відділах ЦНС, де, очевидно, відіграє роль нейромедіатора. Діючи паракринним шляхом, цей гормон пригнічує секрецію інших гормонів острівцевих клітин. у фармакологічній кількості він зменшує кетоз, який супроводжує інсулінову недостатність, що, очевидно, пояснює його здатність гальмувати секрецію глюкагону. Він також знижує надходження поживних речовин із травного тракту в кров, оскільки володіє здатністю сповільнювати випорожнення шлунка, гальмувати секрецію гастрину та, відповідно, утворення НСl, пригнічувати екзокринну функцію підшлункової залози та секрецію жовчі, гальмувати всмоктування цукрів. Панкреатичний поліпептид (ПП) синтезується F-клітинами підшлункової залози, складається з 36 амінокислотних залишків і має молекулярну масу 4 200 Да. Його секрецію стимулює збагачена білками їжа, голодування, фізичні навантаження та гостра гіпоглікемія. Соматостатин і внутрішньовенно введена глюкоза знижують утворення цього гормона. Його функція достеменно невідома, ймовірно, він впливає на вміст глікогену в печінці та на секрецію шлункових і кишкових ферментів.
9.6. Гормони щитоподібної залози Щитоподібна залоза – непарний ендокринний орган, розташований у ділянці гортанних хрящів. Вона складається з численних фолікулів, заповнених білковим колоїдом, основним компонентом якого є білок тиреоглобулін – високомолекулярний глікопротеїн молекулярною масою 670 000 Да, який складається з двох субодиниць і містить 115 залишків тирозину, кожен з яких є потенційним сайтом йодування. Близько 70 % йодиду в тиреоглобуліні знаходиться в складі неактивного попередника – монойодтирозину та дийодтирозину, а 30% – у йодтиронінових залишках, Т3 і т4. 9.6.1. Синтез, механізм дії та біологічні функції йодтиронінів. У щитоподібній залозі відбувається синтез і секреція двох йодвмісних гормонів: 3,5,3'-трийодтироніну (Т3) і 3,5,3',5'-тетрайодтироніну (Т4, тироксин), які є похідними амінокислоти тирозину. За умови достатнього надходження йоду в організм співвідношення т4/Т3 становить приблизно 7/1. особливість тиреоїдних гормонів полягає в тому, що для їх біологічної активності необхідний йод. Щитоподібна залоза поряд з епітеліальними тканинами молочної залози, плаценти, слинних залоз і шлунка володіє здатністю накопичувати йод проти високого електрохімічного градієнта. Це відбувається завдяки наявності АТФ-залежної Nа+/К+- помпи та шляхом дифузії. Процес синтезу йодтиронінів включає наступні етапи: 1) поглинання йодидів з крові та їх окиснення до стану більшої валентності за участі гемвмісної тиреопероксидази та Н2О2 в якості окисника; 2) синтез тиреоглобуліну і йодування його тирозинових залишків (за участі тиреопероксидази). Першою чергою йодуванню підлягає третє положення ароматичного кільця, а згодом п’яте з утворенням монойодтирозину та дийодтирозину; 3) дві молекули дийодтирозину конденсуються в складі тиреоглобуліну з утворенням йодтироніну Т4, а конденсація монойодтирозину з дийодтирозином спричинює утворення йодтироніну Т3. Вважають, що цей процес теж каталізує тиреопероксидаза, яка стимулює утворення вільних радикалів йодтирозину. Утворені гормони залишаються в складі тиреоглобуліну до початку його деградації; 4) після стимуляції щитоподібної залози тиреотропіном (або цАМФ) відбувається розщеплення тиреоглобуліну протеазами та пептидазами до амінокислот і вивільнення гормонів у кров шляхом полегшеної дифузії, за умов норми щитоподібна залоза секретує 80 – 100 мкг Т4 та 5 мкг т3 на добу.
50 – 75 % Гормонів Т3 і т4 знаходяться в організмі за межами щитоподібної залози, причому більша частина їх міститься в крові в комплексі з двома білками – тироксинзв’язуючим глобуліном, який слугує основним транспортним білком йодтиронінів і формою їх депонування, і тироксинзв’язуючим преальбуміном. Біологічна активність йодтиронінів обумовлена незв’язаною фракцією. Приблизно 80 % циркулюючого Т4 перетворюється на периферії на «реверсійну» форму Т3, яка майже повністю позбавлена біологічної активності. Інший шлях метаболізму йодтиронінів – повне дейодування, дезамінування або декарбоксилування; йодовані продукти катаболізму йодтиронінів підлягають реакціям кон’югації в печінці. Синтез і секреція йодтиронінів регулюється гіпоталамо-гіпофізарною системою за принципом зворотного зв’язку. Стимулом для підвищення секреції тиреоліберину та тиреотропіну слугує зниження концентрації йодтиронінів у крові. Соматотропний гормон інгібує утворення тиреотропіну. Свою дію тиреоїдні гормони здійснюють через два типи рецепторів: одні знаходяться на плазматичній мембрані клітин, інші – внутрішньоклітинно. Вони посилюють ефекти інших гормонів (гормону росту, інсуліну, глюкокортикоїдів) на транскрипцію генів; чинять вплив на низку тканин організму, але найчутливіші до них тканини серця, печінки, нирок, скелетних м'язів і, меншою мірою, нервова та жирова тканини. Йодтироніни мають широкий спектр дії, в якому можна виділити два основних напрями: регуляція енергетичного обміну та вплив на ріст, розвиток організму та диференціювання тканин. Вплив тиреоїдних гормонів на енергетичний обмін виявляється в підвищеному поглинанні кисню більшістю клітин організму (за виключенням мозку, гонад і ретикулоендотеліальної системи), що пов'язано із збільшенням основного обміну, та продукуванням тепла. Тепловий ефект гормонів пов'язують із їх впливом на мітохондрії, що виражається збільшенням розмірів і кількості мітохондрій, а також числа крист у них. Тиреоїдні гормони пришвидшують біосинтез мітохондріальних дихальних ферментів, а також активують ферменти, що забезпечують механізм човникового транспорту водню з цитоплазми в мітохондрії (активність мітохондріальної α-гліцерофосфатдегідрогенази зростає в декілька разів). Це змушує клітини тканин до акумуляції АТФ, яка потім використовується на забезпечення роботи Nа+, К+-АТФази. Використання АТФ зумовлює збільшення вмісту АДФ і, як наслідок, стимулює процеси катаболізму, які супроводжуються синтезом АТФ. Одночасна стимуляція діаметрально протилежних процесів (літогенезу та ліполізу, синтезу та розпаду білків) забезпечує розсіювання енергії внаслідок прискорення катаболізму та, відповідно, підвищення теплопродукції. Стимульована тиреоїдними гормонами реакція-відповідь організму на охолодження посиленням теплопродукції зумовлена вивільненням із закінчень симпатичних нервів норадреналіну, який, своєю чергою, активує ліпазу жирової тканини та посилює мобілізацію жиру з жирових депо. Утворені при цьому жирні кислоти слугують не лише «паливом», а й важливим регулятором роз’єднання дихання та фосфоритування. Вплив гормонів щитоподібної залози на обмін білків, вуглеводів і ліпідів має двофазний характер і залежить від концентрації гормонів у крові. За фізіологічних концентрацій вони стимулюють анаболічні процеси, а при надмірних – катаболічні. Так, початковий ефект їх дії на обмін білків проявляється індукцією синтезу їх синтезу шляхом активації механізму транскрипції (введення гормонів хворим з нестачею тироксину знижує виведення азоту з організму), але при гіперфункції щитоподібної залози посилюється катаболізм білків (виникає негативний азотистий баланс). Так само впливають йодтироніни на обмін вуглеводів: малі дози стимулюють поглинання глюкози м’язами, підвищують синтез глікогену, прискорюють гліколіз у печінці, великі – посилюють розпад глікогену. Вплив тиреоїдних гормонів на обмін ліпідів проявляється мобілізацією жиру з жирових депо, окисненням жирних кислот, прискоренням синтезу холестерину та перетворення його на жовчні кислоти. Йодтироніни регулюють також обмін вітамінів і водний баланс організму, діяльність ЦНС, травного тракту, функцію серцево-судинної системи. 9.6.2. Захворювання щитоподібної залози. При гіпофункції щитоподібної залози (гіпотиреозі) в організмі спостерігається нестача йодтиронінів. Гіпотиреоз, що розвивається в новонароджених або в ранньому дитячому віці, відомий під назвою кретинізм. Це захворювання характеризується затримкою росту (такі люди мають карликовий ріст), непропорційною будовою тіла, порушенням психіки та розумовою відсталістю. При гіпофункції щитоподібної залози в дорослої людини розвивається мікседема(слизовий набряк), яка характеризується зниженням основного обміну та температури тіла, потовщенням шкіри, внаслідок надмірного накопичення в ній протеогліканів і води, погіршенням пам'яті. В останні роки у дорослих людей частою причиною гіпотиреозу є хронічний автоімунний тиреоїдит (зоб Хашімото), який призводить до порушення синтезу йодтиронінів. Гіпотиреоз, який розвивається внаслідок недостатнього надходження в організм йоду через низький його вміст в ґрунті та воді деяких географічних регіонів носить назву ендемічний зоб. Збільшенням розмірів щитоподібної залози при цьому має компенсаторний характер: недостатнє надходження йоду порушує продукцію йодтиронінів, що призводить до посилення секреції ТТГ (через послаблення дії йодтиронінів на гіпофіз за механізмом негативного зворотного зв'язку), під впливом якого відбувається компенсаторне збільшення розмірів щитоподібної залози (гіперплазія), але продукція йодтиронінів при цьому не збільшується. Гіпотиреоз часто супроводжується зниженням слиновиділення, що зменшує стійкість зубів до карієсу та підвищує частоту розвитку запальних процесів слизової оболонки органів ротової порожнини. Крім цього виникає зміна мікроелементного складу твердих тканин зубів (збільшення в них марганцю, цинку, свинцю). Порушення функція травного тракту, розвиток вітамінної недостатності призводить до імуносупресії. Запобігти цій патології можна додаванням йодиду калію до кухонної солі або до інших харчових продуктів, тоді як при гіпотиреозі, зумовленому порушенням біосинтезу і секреції тиреоїдних гормонів, лікувальний ефект досягається шляхом замісної терапії гормональними препаратами. Гіперфункція щитоподібної залози (гіпертиреоз) характеризується надмірним утворенням йодтиронінів. Найтяжчою формою гіпертиреозу є дифузний токсичний зоб (тиреотоксикоз, базедова хвороба, хвороба Грейвса), який характеризується підвищенням основного обміну з переважанням процесів катаболізму. Швидке окиснення жирних кислот, гліцерину, вуглеводів вимагає підвищеного споживання кисню і призводить до посилення калоригенного ефекту. Характерними клінічними ознаками цього захворювання є: втрата маси тіла, підвищення температури, тахікардія, вирячкуватість (екзофтальм), надмірна нервова збудливість, збільшення розмірів щитоподібної залози. У пацієнтів знижуються секреторна активність залоз травного тракту (у тому числі слинних), зазнають змін біохімічні показники ротової рідини: знижується в’язкість слини, підвищується вміст у ній тироксину і трийодтироніну (в 2 рази порівняно з нормою), послаблюються механізми захисту емалі від демінералізуючих чинників, що сприяє розвитку карієсу (майже 100 % випадків), у навколозубних тканинах розвивається запальний процес (хронічний катаральний гінгівіт), підвищується чутливість організму до інфекційних агентів, токсинів, отрут. Дата добавления: 2015-11-28 | Просмотры: 1547 | Нарушение авторских прав |