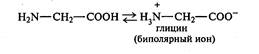|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
САМОСТОЯТЕЛЬНАЯ РАБОТА1. Запишите следующие определения: Первичная структура полипептидов и белков — ___________________________: Вторичная структура полипептидов и белков — __________________________ 2. Какому термину из глоссария соответствуют следующие определения: Обратимый процесс взаимообмена амино- и оксогрупп между α-амино-кислотой и α-оксокислотой — Реакция, в ходе которой происходит удаление диоксида углерода СО2 из молекулы органического соединения —
4.Дополните схему равновесия различных форм α-аминокислоты в водном растворе. Назовите аминокислоту и сделайте вывод о принадлежности ее к группе кислых, основных или нейтральных аминокислот.
5. Дополните схему реакции трансаминирования. донорная α-аминокислота акцепторная α-оксокислота
L-глутаминовая кислота щавелевоуксусная кислота
акцепторная α-оксокислота донорная α-аминокислота
2-оксоглутаровая кислота -----------------------------------------------------
донорная α-аминокислота акцепторная α-оксокислота
L-аспарагиновая кислота акцепторная α-оксокислота донорная α-аминокислота
L-глутаминовая кислота
L-глутаминовая кислота
донорная α-аминокислота акцепторная α-оксокислота
L-аланин 2-оксоглутаровая кислота
L-аланин 2-оксоглутаровая кислота
акцепторная α-оксокислота донорная α-аминокислота +
щавелевоуксусная кислота
акцепторная α-оксокислота донорная α-аминокислота
2-оксоглутаровая кислота ______________________________________________________________________
5.5 донорная α-аминокислота акцепторная α-оксокислота
+ ↔
пировиноградная кислота L-глутаминовая кислота донорная α-аминокислота акцепторная α-оксокисюта 5.6. L-глутаминовая кислота пировиноградная кислота акцепторная α-оксокислота донорная α-аминокислота + 6. Запишите в соответствующие графы таблицы номера верных утверждений для типов химических связей в молекулах белков. 1) является разновидностью донорно-акцепторной связи; 2) образуется в результате окисления тиольных групп; 3) является делокализованной ковалентной связью; 4) гидролизуется как в кислой, так и в щелочной средах; 5) легко восстанавливается с образованием тиольных групп 6) играет основную роль в формировании вторичной структуры пептидов и белков; 7) имеет ключевое значение в образовании первичной структуры пептидов и белков.
Зная набор продуктов гидролиза трипептида, сконструируйте возможные модели аминокислотной последовательности в молекулах трипептидов (для записей используйте трехбуквенные обозначения). Для одного из пептидов приведите название, структурную формулу, обозначьте N- и С-концы и пептидные связн. Напишите схемы реакций кислотного и щелочного гидролиза. Пример. Продукты гидролиза: аланин, глицин, валин. Аминокислотные последовательности возможных трипептидов:
-Название: аланилглицилвалин. —Структурная формула:
Продукты реакции кислотного гидролиза:
катионная форма катионная форма катионная форма валина Продукты реакции щелочного гидролиза:
анионная форма анионная форма анионная форма валина 7.1Алании, серии, тирозин. 7.4 Лизин, валин, треонин. 7.2Аспарагин, лейцин, глицин. 7.5 Глутамин, аланин, глицин. 7.3Тирозин, изолейцин, пролин. 7.6. Цистеин, пролин, изолейцин. Продукты гидролиза: ________________________________________________ Аминокислотные последовательности возможных трипептидов:
Структурная формула: Продукты реакции кислотного гидролиза: Продукты реакции щелочного гидролиза: ТЕКУЩИЙ КОНТРОЛЬ (примерный вариант) 1. Приведите схемы реакций, доказывающих амфотерные свойства валина. К какой группе α-аминокислот (кислых, основных или нейтральных) относится валин? 2. Приведите схему реакции образования L-глутаминовой кислоты из α-оксоглутаровой путем трансаминирования. 3. Приведите название трипептида Ala-Ser-Tyr, его структурную формулу, схемы реакций кислотного и щелочного гидролиза, обозначьте N- и С-концы и пептидные связи. ЛАБОРАТОРНАЯ РАБОТА АМИНОКИСЛОТЫ Свойства аминокислот Реактивы и оборудование: 2%-ный раствор аминоуксусной кислоты (глицина), 10%-ный раствор аминоуксусной кислоты, 1%-ный раствор аминоуксусной кислоты, растворы индикаторов (метиловый оранжевый, метиловый красный, лакмус), карбонат меди(II), 10%-ный раствор гидроксида натрия, 10%-ный раствор нитрита натрия, ледяная уксусная кислота, 0,1%-ный раствор нингидрина в ацетоне; химические стаканы на 100мл, лед, водяные бани, пробирки. Отношение аминокислот к индикаторам. В три пробирки наливают по 1мл 2%-ного раствора глицина и добавляют по 2капли растворов индикаторов: в первую пробирку – метиловый оранжевый, во вторую – метиловый красный, в третью – лакмус. Как изменяется окраска индикатора?____________________________________
Выводы по опыту: Это объясняется тем, что ________________________кислоты (в частности глицин) в водных растворах существуют в виде биполярных ионов, причем кислотность ______________группы уравновешивается основностью__________, поэтому водные растворы этих аминокислот имеют _______________реакцию среды:
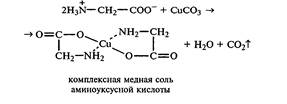
Образование медной соли аминоуксусной кислоты. В сухую пробирку вносят 0,5г карбоната меди(II) и 1,5-2мл 2%-ного раствора аминоуксусной кислоты. Реакционную смесь нагревают на пламени горелки. После нагревания хорошо видна синяя окраска раствора. Часть раствора переливают в другую пробирку и добавляют к нему 2 капли 10%-ного раствора гидроксида натрия. Выпадает ли осадок гидроксида меди(II)? __________________________________ Приведите объяснение. Оставшуюся часть жидкости охлаждают в стакане с ледяной водой. Что наблюдается? ________________________________________________(для ускорения процесса кристаллизации стенку пробирки потирают стеклянной палочкой).
Вывод: образование комплексных окрашенных в синий цвет медных солей характерно для α-аминокислот. Взаимодействие аминокислот с азотистой кислотой. Аминокислоты, как и первичные амины, взаимодействуют с азотистой кислотой. Эту реакцию используют для количественного определения аминокислот. К 1мл 10%-ного раствора глицина приливают 1мл 10%-ного раствора нитрита натрия и 1-2 капли ледяной уксусной кислоты. Что наблюдается при встряхивании пробирки?__________________________________________________________________ NаNО2 + СН3—СООН = НNO2 + СН3— СОONa Н2N—СН2—СООН + НО—N=O →→ НО—СН2—СООН + N2↑ + Н2О аминоуксусная кислота оксиуксусная кислота Цветная реакция аминокислот с нингидрином. Реакция с нингидрином очень чувствительна, поэтому ее часто применяют для качественного и количественного анализа α-аминокислот. К 2-3мл 1%-ного раствора аминоуксусной кислоты добавляют 2-3 капли 0,1%-ного раствора нингидрина в ацетоне. Содержимое пробирки встряхивают и нагревают на горячей водяной бане. Через некоторое время появляется ________________окраска с ____________оттенком. Различные α-аминокислоты с нингидрином образуют окрашенные соединения, отличающиеся оттенком. Цветные реакции белков. Биуретовая реакция Реактивы:30% раствор NaOH;1% раствор CuSO4 К 1-2 мл белка прилить двойной объем раствора NaOH, перемешать и добавить 2-3 капли раствора CuSO4, перемешать. Что наблюдается?__________________________
Цветные реакции белков. Ксантопротеиноваяреакция Реактивы: концентрированная HNO3, раствор щелочи, универсальный индикатор К 0,5 мл раствора белка прилить 5-6 капель концентрированной HNO3, осторожно нагреть. Что наблюдается?___________________________Охладить смесь и добавить щелочь до щелочной реакции. Что наблюдается?__________________________
К лекции По биологическому значению все аминокислоты делятся на заменимые, полузаменимые (гистидин, аргинин, тирозин), незаменимые (валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин).
По полярности радикала: Классификация аминокислот по полярности радикала
Дата добавления: 2015-12-15 | Просмотры: 1968 | Нарушение авторских прав |


 5.1.
5.1.
 5.2.
5.2.
 5.3.
5.3. донорная α-аминокислота акцепторная α-оксокислота
донорная α-аминокислота акцепторная α-оксокислота 5.4.
5.4.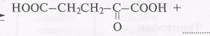
 акцепторная α-оксокислота донорная α-аминокислота
акцепторная α-оксокислота донорная α-аминокислота
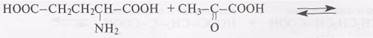


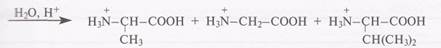

 Название: __________________________________________________________
Название: __________________________________________________________