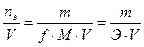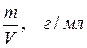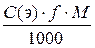|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
II. Лабораторная работа.«Определение содержания сильной кислоты в водном растворе методом кислотно-основного титрования».
ЦЕЛЬ РАБОТЫ 1. Овладеть методикой титрования. 2. Определить точную концентрацию раствора кислоты методом кислотно-основного титрования.
ОБОРУДОВАНИЕ И РЕАКТИВЫ Бюретки вместимостью 25 см3 в штативе, воронка, колба коническая для титрования вместимостью 250 см3, колба для слива, пипетка мерная вместимостью 10 см3, резиновая груша, колба для переноса растворов. Раствор тетрабората натрия с точно известной концентрацией, анализируемый раствор соляной кислоты, раствор индикатора – метилоранжа в капельнице.
СУЩНОСТЬ МЕТОДИКИ Раствор HCl с точной концентрацией нельзя приготовить по точной массе исходного вещества из-за его летучести. Поэтому раствор HCl готовят приблизительной концентрации разбавлением концентрированного раствора, а затем определяют его точную концентрацию (стандартизируют) путем титрования. Для этого надо иметь первичный стандарт – раствор основания с точно известной концентрацией. Его готовят по точной навеске. Веществом, наиболее удобным в качестве первичного стандарта для HCl является тетраборат натрия, Nа2В4О7 . 10Н2О (бура) – соль сильного основания и слабой кислоты.
УРАВНЕНИЕ РЕАКЦИИ
Na2B4O7 . 10H2O + 2HCl ® 2NaCl + 4H3BO3 + 5H2O
ХОД РАБОТЫ 1. Подготовка бюретки к работе. - Бюретка установлена в штативе строго вертикально. Выливают из бюретки воду и ополаскивают ее изнутри небольшой порцией соляной кислоты, пользуясь воронкой. - Заполняют кончик бюретки, «носик», раствором, чтобы не было пузырьков воздуха. - Заполняют бюретку раствором несколько выше нулевого деления и убирают воронку, так как с нее может капать раствор. - Выпуская лишний раствор, заполняют бюретку до нулевой отметки (по нижнему краю мениска). - Кладут на основание штатива листок белой бумаги. 2. Подготовка пробы раствора Nа2В4О7 для титрования. - Из общей склянки с раствором тетрабората натрия отливают в колбу для переноса раствора ~ 50 см3 раствора буры. - Для ополаскивания пипетки в нее с помощью груши засасывают из колбы раствор тетрабората выше метки и выливают его в колбу для слива. - В колбу для титрования переносят 10.00 мл раствора тетерабората натрия, соблюдая все правила обращения с пипеткой (раствор набирают с помощью груши, пипетку держат вертикально, закрывая отверстие указательным пальцем (рис. 1), раствор в колбу выливается самотеком, а не выдувают, последнюю каплю удаляют, прикасаясь концом пипетки к стенке колбы). - Добавляют в колбу 1 каплю раствора метилоранжа. Окраска раствора желтая. 3. Проведение титрования. - Ставят колбу с раствором тетрабората натрия под бюретку. Первое титрование носит ориентировочный характер. Добавляют раствор из бюретки небольшими порциями, постоянно перемешивая содержимое колбы (лучше правой рукой). - Титрование заканчивают, когда произойдет изменение окраски из желтой в оранжевую, записывают результат титрования с точностью до 0,05 мл. - Содержимое колбы выливают в раковину, колбу ополаскивают водой и вносят с помощью пипетки новую порцию раствора Nа2В4О7 и индикатор. - Последующие титрования проводят более точно. Для этого из бюретки в колбу быстро добавляют основной объем титранта, а последние порции добавляют по каплям, внимательно следя за изменением окраски раствора. Титрование прекращают, когда изменение окраски происходит при добавлении всего одной капли. - Титрование повторяют до тех пор, пока не будет получено три сходящихся результата (то есть отличающиеся не более чем на 0,20 мл). Титрование каждый раз начинают с нулевой отметки.
РЕЗУЛЬТАТЫ ТИТРОВАНИЯ (ОБРАЗЕЦ) Анализируемый раствор: HCl» 0,1 н. Выдан лаборантом.
HClNа2В4О7 индикатор: метилоранж
Расчет: 1) Объем раствора HCl, пошедший на титрование, находят как среднее арифметическое их трех сходящихся результатов (точность – до 0,01мл). 2) Для вычисления концентрации раствора HCl используют закон эквивалентов: C (HCl) . V (HCl) = C (Na2B4O7) . V (Na2B4O7)
C (HCl) =
T (HCl) =
Вариант оформления протокола: Название работы. Цель работы. Сущность работы и уравнение реакции. Результаты титрования и расчет СН и Т(HCl). Вывод, в котором указывают, что сделано в работе, и найденные СН (HCl) с точностью 4-5 знаков после запятой и Т (HCl) с точностью 5-6 знаков после запятой.
ОСНОВНЫЕ РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ 1. Фактор эквивалентности. f (кислоты) = f (основания) = f (соли) =
2. Молярная масса эквивалентов вещества.
М э (или Э) = f . М = 3. Число моль вещества Число моль эквивалентов вещества
4. Молярная концентрация Молярная концентрация эквивалента С (х) =
5. Масса вещества m = n . М m = nэ . f . M m = С (э) . f . M . V m= C (э) . Э . V 6. Титр раствора Т = Т = 7. Закон эквивалентов nА = nB
САVА = СВ . VВ.
ТЕМА: «ТИТРИМЕТРИЧЕСКИЙ (ОБЪЕМНЫЙ) АНАЛИЗ. Дата добавления: 2015-12-16 | Просмотры: 1107 | Нарушение авторских прав |
 Титрованный раствор (стандартный): Nа2В4О7 . 10 Н2О. Приготовлен лаборантом. СН = 0,0961 мль/л.
Титрованный раствор (стандартный): Nа2В4О7 . 10 Н2О. Приготовлен лаборантом. СН = 0,0961 мль/л.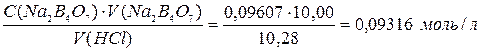
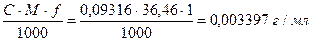
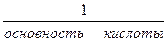
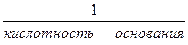

 . М
. М
 nэ = С (э) . V
nэ =
nэ = С (э) . V
nэ = 

 С (э) =
С (э) =