 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
I. Выполните упражнения (САРС). 1. В воду пробулькивали газообразный SО2
1. В воду пробулькивали газообразный SО2. Какое вещество надо добавить к образовавшемуся водному раствору, чтобы получить буферный раствор? Напишите его состав и механизм буферного действия. 2. Вычислите рН ацетатной буферной системы, полученной смешением 200 мл раствора ацетата натрия с молярной концентрацией 0,4 моль/л и 500 мл уксусной кислоты с концентрацией 0,1 моль/л. Какая буферная емкость: кислотная или основная выше в этом растворе? 3. Аммиачный буферный раствор получен смешиванием 500 мл 0,2 М раствора NH4ОН и 200 мл 0,4 М раствора NH4Cl. - Какая среда в этом растворе: кислая или щелочная? - Рассчитайте значение рН. - Какая буферная емкость выше – кислотная или основная? 4. Угольная кислота существует только в растворе за счет растворения углекислого газа. Ее концентрацию можно выразить через парциальное давление углекислого газа (рСО2) и коэффициент растворимости СО2 в жидких средах (S). [H2CO3] = pCO2 ´ S Тогда формула для расчета значения рН гидрокарбонатной системы имеет вид: рН = рКа + lg Рассчитайте рН гидрокарбонатной буферной системы, если рСО2 = 40 мм.рт.ст, S = 0,03, а концентрация гидрокарбонат-иона равна 2,4´10-2 моль/л. 5. В водных растворах a-аминокислоты, в зависимости от рН среды, существуют в виде: катиона, нейтральной биполярной молекулы и аниона. На примере аминокислоты глицин (Н2N-СН2-СООН) составьте кислотную и основную буферные системы и запишите механизм их буферного действия. 6. Рассчитайте величину кислотной буферной емкости, если при добавлении 4 мл 0,5 н раствора Н2SО4 к 50 мл буферного раствора, его рН изменился от 4,2 до 3,5.
Дата добавления: 2015-12-16 | Просмотры: 1031 | Нарушение авторских прав |
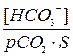 или рН = 6,1 + lg
или рН = 6,1 + lg