 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
II. Лабораторная работа. «Определение содержания соды в контрольном препарате».«Определение содержания соды в контрольном препарате». Работа 1. Приготовление рабочего раствора соляной кислоты. Примерные задания студентам: «Приготовить 250 мл 0,1 н раствора НСl из концентрированного раствора плотностью 1,179 г/мл». РЕШЕНИЕ: 1. С помощью таблицы по плотности определяют массовую долю исходного раствора. Плотности 1,179 г/мл соответствует 36% раствор НСl. 2. Определяем содержание НСl в 250 мл 0,1 н раствора: m = Cн . 3. Определяем, какая масса концентрированной кислоты содержит 0,9125 г НСl: 100 г 36% раствора содержится 36 г НСl х г – 0,9125 г НСl х = 2,53 г НСl. 4. Взвешивать кислоту неудобно, поэтому находим объем раствора кислоты: V = 5. Отмерим этот объем концентрированной кислоты маленькой градуированной пробиркой, перельем этот раствор в мерную колбу и разбавим дистиллированной водой до 250 мл. Дистиллированную воду добавляем до метки с помощью пипетки. Тщательно перемешаем полученный раствор. Кислота соляная, разведенная (8,2 – 8,4%) используется внутрь в каплях в микстурах (часть с пепсином) при недостаточности кислотности желудочного сока. При гипохромных анемиях вместе с препаратами железа она способствует улучшению всасывания и использования железа.
Работа 2. Стандартизация рабочего раствора соляной кислоты. ЦЕЛЬ РАБОТЫ: Научится стандартизировать – определять точную концентрацию рабочего раствора и проводить расчеты с использованием закона эквивалентов.
Веществом, наиболее удобным для установки титра соляной кислоты считают тетраборат натрия Na2B4O7 . 10H2O: Na2B4O7 . 10H2O + 2HCl = 2NaCl + 4H3BO3 + 5H2O Титрование ведут с индикатором метиловым оранжевым путем приливания кислоты из бюретки к раствору тетрабората натрия. 1. Тщательно вымытую бюретку промыть небольшой порцией соляной кислоты для удаления остатков воды. Пользуясь воронкой, наполнить бюретку соляной кислотой так, чтобы мениск ее был несколько выше нулевого деления. Заполнить раствором оттянутую трубку, вытеснить из нее пузырьки воздуха. Затем убрать воронку, т.к. с нее может капать раствор, и, выпуская лишнюю кислоту, установить нижний край мениска на нулевом делении. В таком состоянии бюретка подготовлена к работе. 2. Чистой пипеткой отмерить 10,00 мл раствора тетрабората натрия в коническую колбу для титрования. Не следует выдувать из пипетки последнюю каплю жидкости, а только прикоснуться концом ее к стенке колбы. Прилить к раствору тетрабората 1 каплю метилоранжа. 3. На основание штатива положить лист белой бумаги. Подставить колбу с раствором тетрабората натрия под бюретку и приступать к титрованию с соблюдением всех правил. Надо добиться того, чтобы желтая окраска метилоранжа переходила в бледно-розовую от одной избыточной капли кислоты. Титрование повторять до получения сходящихся результатов, т.е. пока отсчеты будут отличаться друг от друга не более чем на 0, 20 мл. Все результаты титрования записывать в тетрадь. Титровать не менее трех раз. Титрование необходимо начинать каждый раз с нулевой отметки. 4. Результат титрования записать по образцу, приведенному ниже, с.10.
Работа 3. Определение содержания Na2CO3. Получить у преподавателя контрольный раствор соды в мерной колбе и записать в тетради его номер. Довести объем раствора дистиллированной водой до метки и тщательно перемешать. Промыть пипетку раствором соды, затем 10,0 мл контрольного раствора перенести промытой пипеткой в коническую колбу, прибавить 1 каплю метилоранжа и титровать рабочим раствором соляной кислоты до перехода желтой окраски индикатора в бледно-розовую от одной капли кислоты. Титровать до получения сходящихся результатов не менее 3 раз. Из сходящихся результатов взять среднее значение. Вычислить сначала молярную концентрацию эквивалента раствора соды, а затем массу Na2CO3 в контрольном растворе, т.е. в 50 мл. Оформите результаты титрования по образцу, с. 10. В выводе отразите итог проделанной работы.
ТЕМА: «КОЛИЧЕСТВЕННЫЙ АНАЛИЗ. ОКСИДИМЕТРИЯ. Дата добавления: 2015-12-16 | Просмотры: 1124 | Нарушение авторских прав |
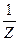 ∙ М∙ V = 0,1∙1∙36,5∙0,25 = 0,9125г НСl
∙ М∙ V = 0,1∙1∙36,5∙0,25 = 0,9125г НСl 2,1 мл 36% раствора НСl
2,1 мл 36% раствора НСl