 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
I. Выполните упражнения (САРС)
1. Имеется три стакана, содержащих системы: а) вода + сахар б) вода + NaCl в) вода + АgCl - В каком из них может установиться гетерогенное равновесие? Изобразите его схематично. - Какую из систем можно охарактеризовать константой растворимости КS (ПР)? Напишите ее выражение. 2. Пользуясь величинами ПР, определите, какой осадитель лучше выбрать: (NH4)2SO4, (NH4)2CO3 или (NH4)2C2O4 (оксалат), чтобы наиболее полно осадить из раствора ион Са2+? ПРCaSO 3. Напишите математическое выражение ПР для сульфата кальция; гидроксида алюминия; карбоната свинца(II); фосфата свинца(II); сульфида серебра. 4. Приготовлены насыщенные водные растворы солей: СаSО4, SrSО4 и ВаSО4 (Т = const). Объясните, в растворе, какой соли молярная концентрация катионов будет выше. ПРВаSO
Условия образования осадка
5. Выясните, образуется ли осадок АgCl, если к 5 мл 0,1 М раствора АgNO3 прибавить 5 мл 0,05 М раствора HCl. ПРAgCl = 1,6 ´ 10-10. 6. ПРСаСО
Растворение осадка
7. Объясните причину растворения оксалата кальция СаС2О4 в соляной кислоте. 8. Почему сульфат бария не растворяется в соляной кислоте желудка при рентгенологических исследованиях? 9. Объясните причину растворения Fе(ОН)3 в соляной кислоте. Дата добавления: 2015-12-16 | Просмотры: 820 | Нарушение авторских прав |
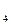 = 6,3 ´10-5 ПРСаСО
= 6,3 ´10-5 ПРСаСО 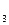 = 4,8 ´ 10-9 ПРСаС
= 4,8 ´ 10-9 ПРСаС 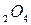 = 2,6 ´ 109.
= 2,6 ´ 109.






 Осадок малорастворимого электролита будет растворяться, если раствор над ним станет ненасыщенным. Этого можно достичь, добавляя к раствору вещество, связывающее один из ионов в более устойчивое соединение (газ, слабый электролит, прочный комплекс или осадок с меньшим ПР).
Например: растворение гидроксида магния под действием соляной кислоты:
(осадок) Мg(ОН)2 «Mg2+ + 2OH- (раствор)
добавление 2НСl «2Сl- + 2Н+
2Н2О – слабый электролит
Осадок малорастворимого электролита будет растворяться, если раствор над ним станет ненасыщенным. Этого можно достичь, добавляя к раствору вещество, связывающее один из ионов в более устойчивое соединение (газ, слабый электролит, прочный комплекс или осадок с меньшим ПР).
Например: растворение гидроксида магния под действием соляной кислоты:
(осадок) Мg(ОН)2 «Mg2+ + 2OH- (раствор)
добавление 2НСl «2Сl- + 2Н+
2Н2О – слабый электролит