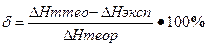|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
II. Лабораторная работа. «Определение энтальпии реакции нейтрализации»«Определение энтальпии реакции нейтрализации»
Цель работы Определить экспериментально энтальпию реакции нейтрализации сильной кислоты щелочью. Сущность методики Определение теплоты, выделяемой или поглощаемой при протекании химического процесса, осуществляется с помощью калориметра. Калориметр - это устройство, в котором количество теплоты, выделяемое или поглощаемое в ходе процесса, измеряется по изменению температуры калориметра. Калориметр состоит из двух сосудов - внешнего и внутреннего, пространство между которыми представляет воздушную изотермическую оболочку для предотвращения потерь теплоты. Крышка внутреннего сосуда снабжена отверстиями для ручной мешалки, воронки для введения веществ, термометра для измерения температуры. Оборудование и реактивы Калориметр, цилиндры на 25 мл (2 шт.), весы, растворы соляной и азотной кислот, гидроксидов натрия и калия с концентрацией 2 мольл, мензурка на 100 мл, дистиллированная вода, соли КСl и Na2CO3.
Опыт 1. Определение энтальпии нейтрализации сильной кислоты щелочью
Расчет теоретического значения энтальпии нейтрализации Уравнение реакции нейтрализации: HCl (p) + NaOH (p) ® NaCl (p) + H2O (ж) H+(р) + OH-(р) ® H2O (ж) Расчет энтальпии нейтрализации сильной кислоты щелочью ведется по краткому ионному уравнению, которое отражает сущность взаимодействия сильных электролитов. Выполнение работы 1. Взвесьте внутренний сухой стакан калориметра с точностью до 0,1 г. 2. Налейте в него 25 мл 2н. раствора кислоты и измерьте начальную температуру раствора. 3. Быстро прилейте 25 мл 2н. раствора щелочи, перемешайте и определите конечную температуру смеси - наивысшую температуру раствора. 4. Данные начальной и конечной температуры занесите в таблицу. Оформление результатов 1. Рассчитайте количество теплоты, которое выделилось при нейтрализации и пошло на нагревание смеси, по формуле: Q1 = Cp · rp · V ·Dt где: V - суммарный объем раствора, мл; rp - плотность раствора, для разбавленных растворов принимается равной плотности воды, т.е. 1 г / мл; Сp - удельная теплоемкость раствора, равная 3,5 Дж ( г×К); Dt = (t кон - t нач ) - разность температур. Таблица 1
2. Рассчитайте количество теплоты, пошедшее на нагревание стакана, по формуле: Q2 = C · m · Dt где: m - масса стакана, г; С - удельная теплоемкость стекла, равная 0,838 Дж(г×К) 3. Рассчитайте экспериментальную энтальпию реакции нейтрализации одного моль эквивалентов кислоты. Повышение температуры в калориметре свидетельствует о том, что энтальпия системы уменьшилась.
где nэ - число моль эквивалентов кислоты, взятое для реакции, которое рассчитывают по формуле: nэ = СНСl . VHCl 4. Сравните полученный результат с рассчитанным теоретическим значением и вычислите относительную ошибку опыта.
В выводе ответьте на следующие вопросы 1. По изменению температуры опыта укажите, экзо- или эндотермической является реакция нейтрализации сильной кислоты щелочью? Какой знак имеет энтальпия этой реакции? 2. Выпишите значения энтальпии нейтрализации, полученные Вашими товарищами в других сочетаниях «кислота-щелочь». Объясните, почему энтальпия нейтрализации сильной кислоты щелочью не зависит от природы кислоты или щелочи и является величиной постоянной.
ТЕМА: «КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ. Дата добавления: 2015-12-16 | Просмотры: 2193 | Нарушение авторских прав |