|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
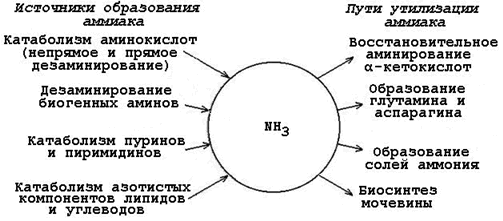
Пути образования и обезвреживания аммиака.2.2.1. Аммиак (NН3) – продукт обмена большинства соединений, содержащих амино- и амидогруппы. Главным путём образования аммиака служит окислительное дезаминирование. Аммиак – очень токсичное вещество, особенно для нервной системы. При физиологических значениях рН молекула NН3 легко превращается в ион аммония NН4+, который не способен проникать через биологические мембраны и задерживается в клетке. Накопление NН4+ вызывает торможение заключительных этапов цикла трикарбоновых кислот и снижение продукции АТФ. Поэтому в организме существует ряд механизмов связывания (обезвреживания) аммиака (см. рисунок 2.3).
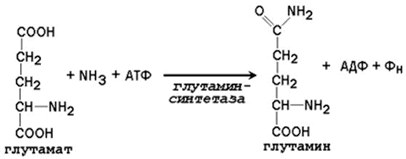
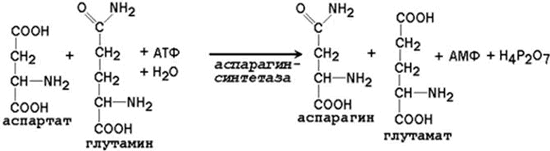
Рисунок 2.3. Образование аммиака в организме и его обезвреживание. 2.2.2. Образование транспортных форм аммиака в тканях. Аммиак, образующийся в тканях, сначала превращается в нетоксичное соединение и в таком виде переносится кровью к печени или почкам. Такими транспортными формами являются аминокислоты глутамин, аспарагин и аланин. Образование глутамина и аспарагина из глутамата и аспартата соответственно происходит во многих тканях, включая головной мозг:
Глутамин - нейтральное нетоксичное соединение, способное легко проходить через клеточные мембраны. В виде этой аминокислоты аммиак транспортируется в крови. В крови здоровых людей содержание глутамина существенно превышает содержание других аминокислот. Глутамин, помимо участия в синтезе белка, служит источником азота в биосинтезе гистидина, глюкозамина, пуриновых и пиримидиновых нуклеотидов. С кровью глутамин поступает в печень и почки. Здесь он под действием фермента глутаминазы превращается в глутамат и аммиак. При участии аспарагиназы также происходит образование аммиака из аспарагина. Аланин является транспортной формой аммиака, которая образуется преимущественно в мышцах. При интенсивной физической нагрузке источниками аммиака служат реакции дезаминирования аминокислот и аденозинмонофосфата (АМФ). Сначала аммиак превращается в аминогруппу глутамата в реакции восстановительного аминирования (см. параграф 2.1.2), катализируемой глутаматдегидрогеназой: Образовавшийся глутамат переносит затем свою α-аминогруппу на пируват, всегда имеющийся в достаточном количестве, поскольку это продукт протекающего в мышцах гликолиза. Реакция катализируется аланинаминотрансферазой. Глутамат + Пируват Аланин (нейтральная аминокислота, не несущая суммарного заряда при значениях рН, близких к 7) выходит из клеток и доставляется кровью к печени. Здесь он под действием аланинаминотрансферазы передаёт свою аминогруппу α-кетоглутарату, в результате чего образуется глутамат. α-Кетоглутарат + Аланин Далее в реакции, катализируемой глутаматдегидрогеназой, глутамат дезаминируется с образованием α-кетоглутарата и аммиака, который в печени превращается в мочевину. 2.2.3. Экскреция аммиака с мочой. Клетки почек поглощают из циркулирующей крови глутамин. Фермент глутаминаза в почках катализирует гидролиз глутамина с образованием глутамата и аммиака.
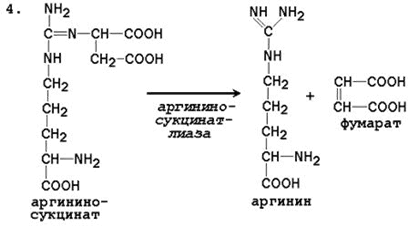
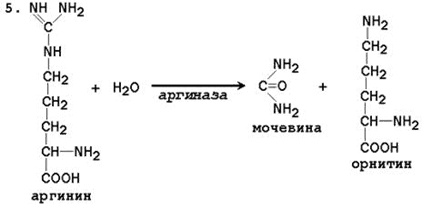
Образующийся глутамат может в дальнейшем подвергаться дезаминированию при участии глутаматдегидрогеназы. Таким образом, из одной молекулы глутамина всего может образоваться две молекулы аммиака. Аспарагин аналогичным образом подвергается гидролизу при участии аспарагиназы, присутствующей в клетках канальцев почек. Аммиак секретируется в просвет почечных канальцев и выводится в виде солей минеральных и органических кислот, например: NН3 + НСl Образование солей аммония в почечных канальцах является важным механизмом регуляции кислотно-основного состояния организма. Оно резко возрастает при метаболическом ацидозе - накоплении в организме кислот и снижается при потере кислот организмом (алкалозе). 2.2.4. Биосинтез мочевины – основной путь обезвреживания аммиака. Мочевина синтезируется в орнитиновом цикле, протекающем в клетках печени. Эту последовательность реакций открыли Х.Кребс и К.Хензелейт в 1932 г. Согласно современным представлениям, цикл мочевины включает последовательность пяти реакций. Две начальные реакции биосинтеза мочевины происходят в митохондриях клеток печени.
Последующие реакции протекают в цитоплазме клеток печени.
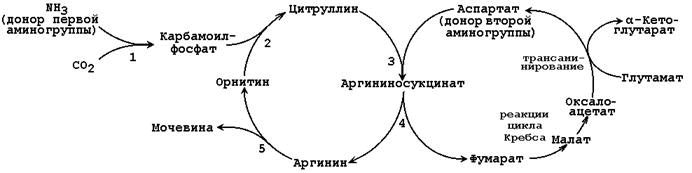
Общая схема орнитинового цикла представлена на рисунке 2.4:
Рисунок 2.4. Схема орнитинового цикла и его связь с превращениями фумаровой и аспарагиновой кислот. 2.2.5. Орнитиновый цикл находится в тесной взаимосвязи с циклом трикарбоновых кислот: 1. пусковые реакции цикла мочевины, как и реакции ЦТК, протекают в митохондриальном матриксе; 2. поступление СО2 и АТФ, необходимых для образования мочевины, обеспечивается работой ЦТК; 3. в цикле мочевины образуется фумарат, который является одним из субстратов ЦТК. Фумарат гидратируется в малат, который в свою очередь окисляется в оксалоацетат. Оксалоацетат может подвергаться трансаминированию в аспартат; эта аминокислота участвует в образовании аргининосукцината. 2.2.6. Регуляция активности ферментов цикла осуществляется главным образом на уровне карбамоилфосфатсинтетазы, которая малоактивна в отсутствие своего аллостерического активатора - N-ацетил-глутамата. Концентрация последнего зависит от концентрации его предшественников (ацетил-КоА и глутамата), а также аргинина, который является аллостерическим активатором N-ацетилглутаматсинтазы: Ацетил-КоА + Глутамат Концентрация ферментов орнитинового цикла зависит от содержания белка в пищевом рационе. При переходе на диету, богатую белком, в печени повышается синтез ферментов орнитинового цикла. При возвращении к сбалансированному рациону концентрация ферментов снижается. В условиях голодания, когда усиливается распад тканевых белков и использование аминокислот как энергетических субстратов, возрастает продукция аммиака, концентрация ферментов орнитинового цикла увеличивается. 2.2.7. Нарушения орнитинового цикла. Известны метаболические нарушения, обусловленные частичным блокированием каждого из 5 ферментов, катализирующих в печени реакции синтеза мочевины, а также N-ацетилглутаматсинтазы. Эти генетические дефекты, очевидно, являются частичными. Полное блокирование какой-либо из стадий цикла мочевины в печени, по-видимому, несовместимо с жизнью, потому что другого эффективного пути удаления аммиака не существует. Общим признаком всех нарушений синтеза мочевины является повышенное содержание NH4+ в крови (гипераммониемия). Наиболее тяжёлые клинические проявления наблюдаются при дефекте фермента карбамоилфосфатсинтетазы. Клиническими симптомами, общими для всех нарушений цикла мочевины, являются рвота, нарушение координации движений, раздражительность, сонливость и умственная отсталость. Если заболевание не диагностируется, то быстро наступает гибель. У детей старшего возраста проявлениями заболевания служат повышенная возбудимость, увеличение размеров печени и отвращение к пище с высоким содержанием белка. Лабораторная диагностика заболеваний включает определение содержания аммиака и метаболитов орнитинового цикла в крови, моче и спинномозговой жидкости; в сложных случаях прибегают к биопсии печени. Значительное улучшение наблюдается при ограничении белка в диете, при этом могут быть предотвращены многие нарушения мозговой деятельности. Малобелковая диета приводит к снижению содержания аммиака в крови и к улучшению клинической картины при мягких формах этих наследственных нарушений. Пищу следует принимать часто, небольшими порциями, для того чтобы избежать резкого повышения уровня аммиака в крови. 2.2.8. Клинико-диагностическое значение определения мочевины в крови и моче. В крови здорового человека содержание мочевины составляет 3,33 – 8,32 ммоль/л. За сутки с мочой выводится 20 – 35 г мочевины. Изменения содержания мочевины в крови при заболеваниях зависят от соотношения процессов её образования в печени и выведения почками. Повышение содержания мочевины в крови (гиперазотемия) отмечается при почечной недостаточности, снижение – при недостаточности печени, при диете с низким содержанием белков. Повышение экскреции мочевины с мочой наблюдается при употреблении пищи с высоким содержанием белков, при заболеваниях, сопровождающихся усилением катаболизма белков в тканях, при приёме некоторых лекарств (например, салицилатов). Снижение экскреции мочевины с мочой характерно для заболеваний и токсических поражений печени, заболеваний почек, сопровождающихся нарушением их фильтрационной способности. Контрольные вопросы: 1. Напишите реакцию трансаминирования между аспарагиновой и α–кетоглутаровой кислотами, укажите название фермента и кофермента. Какова биологическая роль трансаминирования? 2. Напишите реакцию трансаминирования между аланином и α–кетоглутаровой кислотой, укажите название фермента и кофермента. Как связана эта реакция с общим путём катаболизма? 3. Напишите реакции прямого окислительного дезаминирования аминокислот. Назовите фермент, его активаторы и ингибиторы. 4. Представьте в виде схемы последовательность реакций непрямого дезаминирования аланина. Укажите биологическую роль этого процесса. 5. Напишите реакцию декарбоксилирования гистидина, укажите фермент, продукт реакции и его биологическую роль. 6. Напишите реакцию декарбоксилирования глутаминовой кислоты, укажите фермент, продукт реакции и его биологическую роль. 7. Напишите реакцию декарбоксилирования 5-гидрокситриптофана, укажите фермент, продукт реакции и его биологическую роль. 8. Напишите формулу пиридоксальфосфата. Производным какого витамина он является? В каких типах реакций он участвует? 9. Перечислите основные источники аммиака в организме человека и пути его обезвреживания. 10. Напишите реакцию восстановительного аминирования α–кетоглутарата, укажите название фермента и его биологическую роль. 11. Напишите реакцию образования глутамина, укажите название фермента и локализацию в организме. 12. Напишите реакцию образования аспарагина, укажите название фермента и локализацию в организме. 13. Напишите реакцию образования карбамоилфосфата, укажите название фермента. Назовите вещества, являющиеся непосредственными источниками атомов азота молекулы мочевины. 14. Напишите реакцию образования цитруллина, укажите название фермента и его тканевую и внутриклеточную локализацию. 15. Напишите реакцию образования аргининосукцината, укажите название фермента и связь этой реакции с процессами трансаминирования. 16. Напишите реакцию расщепления аргининосукцината, укажите название фермента и связь этой реакции с циклом Кребса. 17. Напишите реакцию образования мочевины из аргинина, укажите фермент. Сколько молекул АТФ затрачивается для синтеза одной молекулы мочевины. 18. Напишите формулу мочевины. Как и почему изменяется содержание мочевины в крови и моче при заболеваниях печени и почек?
Дата добавления: 2015-12-15 | Просмотры: 1165 | Нарушение авторских прав 12 |

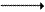 α-Кетоглутарат + Аланин
α-Кетоглутарат + Аланин