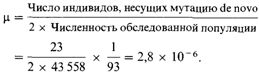|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Данные о соматических хромосомных мутациях, возникающих под воздействием радиации.Медицинская терапия. Таф и др. (1960) [1659] первыми описали структурные аберрации в хромосомах двух пациентов, облученных при лечении анкилозирующего спондилита. С тех пор выполнено немало исследований, посвященных изучению радиационной чувствительности хромосом в соматических клетках человека [1387, 1395]. Здесь можно упомянуть некоторые из полученных результатов. 1. В течение определенного промежутка времени после терапевтического облучения ~25-35% клеток (в основном лимфоцитов) содержали структурные хромосомные аберрации. 2. Чем больше промежуток времени между облучением и цитогенетическим анализом, тем меньше число клеток, содержащих дицентрические хромосомы, кольцевые хромосомы и ацентрические фрагменты (особенно заметно уменьшение в первые 2 года после облучения). Тем не менее даже через 10 лет такие аномалии все еще встречались у них примерно в четыре раза чаще, чем в контроле. С другой стороны, число реципрокных транслокаций через 10 лет не намного меньше, чем сразу после облучения (рис. 5.53). После комбинированной рентгеновской и радиевой терапии гинекологических опухолей структурные дефекты хромосом обнаруживаются в лимфоцитах даже спустя 25 лет. Сходные аберрации наблюдались у пациентов, лечившихся с применением радиоизотопов, например 131I или 32Р. 250 5. Мутации
Профессиональное облучение. Сообщения о хромосомных аберрациях у индивидов, подвергающихся, в силу своей профессии, хроническому облучению, появляются довольно часто. Спонтанно клетки с кольцевыми или дицентрическими хромосомами возникают очень редко (1/2000 клеток после 48 ч культивирования лимфоцитов и 1/8000 после 72 ч). Поэтому они служат хорошими индикаторами воздействия радиации. Однако и простые хромосомные разрывы при облучении тоже увеличиваются в числе [1387]. Облучаемые группы включают рабочих, наносящих фосфоресцирующие вещества на циферблаты часов, персонал, обслуживающий атомные реакторы, и лиц, попавших в аварии, приводящие к утечке радиации. Появилась даже возможность оценить по величине цитогенетических изменений дозы радиации, полученные индивидами. Такая биологическая дозиметрия является полезным тестом, применяемым в радиобиологии человека. Оставшиеся в живых жертвы атомной бомбардировки. Сасаки и Мията [1614] обследовали 51 человека, перенесшего атомную бомбардировку, приблизительно через 22 года после этого события и сравнили их с 11 необлученными контрольными индивидами. Было проанализировано не менее 83 506 клеток. В облученной выборке частота дицентрических и кольцевых хромосом составляла 0,0027 на клетку (201 на 73 996 клеток). В контроле она была равна 0,0002 (2 на 9 510 клеток). Число клеток с устойчивыми симметричными транслокациями также увеличивалось. Обнаружена четкая зависимость между расстоянием от эпицентра взрыва и числом аберрантных клеток (рис. 5.54). Другая работа, приведшая к сходным результатам, была проведена Блумом и др. [1395]. У четырех сильно облученных индивидов, получивших дозы радиации от 2,07 до 6,42 Гр, обнаружено развитие клонов с аберрантными клетками. В разд. 5.1.6 при обсуждении синдромов, сопряженных с повышенной нестабильностью хромосом, объяснялось, что образование клона свидетельствует о селективном преимуществе
5 Мутации 251
клеток, имеющих данную хромосомную аберрацию. Клеточные клоны, обладающие таким преимуществом, могут легко развиваться в злокачественные новообразования. Заболеваемость раком среди жертв атомной бомбардировки. Дополнительные обследования пациентов, получивших значительные дозы облучения, и людей, переживших атомный взрыв в Хиросиме или Нагасаки, показали, что у них повышена частота различных раковых заболеваний. Список этих болезней включает лейкемию [1393, 1557] (рис. 5.55), рак молочной железы [1377; 1555], рак легких [1497], рак щитовидной железы [1434; 1557] и рак пищеварительной системы. Данные результаты согласуются с мутационной теорией возникновения рака (разд. 5.1.6) и поэтому не были совершенно неожиданными. «Латентный» период между воздействием радиации и диагностикой злокачественной опухоли обычно очень продолжителен (более 10 лет), особенно в случае солидных опухолей. Дальнейшее изучение слабой радиации как возможного фактора, способствующего возникновению рака у человека, имеет громадное значение для здравоохранения. Не исключено, что клеточный механизм репарации может исправлять повреждения, произведенные радиацией низкого уровня. До тех пор пока этот вопрос не выяснен в ходе специального исследования, предположение о существовании некоего порога для соматического повреждения, вызванного радиацией, лишено оснований. Проблемы канцерогенеза, обусловленного соматическими мутациями, индуцированными радиацией, имеют непосредственное значение для нынешнего поколения. Между тем эффект
252 5 Мутации
мутаций в половых клетках может быть отсрочен. Высказывались опасения относительно возможности повышения риска развития злокачественных опухолей у детей, подвергавшихся воздействию взрыва атомной бомбы в утробе матери, однако исследования по этой проблеме не дали никаких свидетельств увеличения такого риска [1499]. Как отмечалось в разд. 5.1.6.7, отдельные изменения, сопутствующие процессу нормального старения, могут быть обусловлены соматическими мутациями. Некоторые эксперименты на животных свидетельствуют об определенном сокращении продолжительности жизни после облучения особи [1377]. Прогнозируемое количество дополнительных мутаций на дозу. Сколько будет индуцироваться дополнительных мутаций по отношению к частоте спонтанных мутаций? При ответе на этот вопрос направляющей нитью служит информация, почерпнутая из генетики животных, особенно из генетики мыши. Ввиду возможных межвидовых различий в радиационной чувствительности мы, конечно, предпочли бы вычислять все оценки риска на основе данных о человеке, однако такие данные настолько скудны, что не позволяют получить какой-либо обоснованной количественной оценки. Однако они могут служить в качестве контроля и в некоторых случаях помогают квалифицировать оценки, полученные на животных. Мы рассмотрим ожидаемые относительные частоты в момент рождения и, кроме того, выскажем свое мнение относительно ожидаемой потери зигот до рождения. Разные группы мутаций будут рассматриваться по отдельности. Геномные мутации. Сформулировать здесь какие-либо количественные выводы, повидимому, невозможно. Слишком много в данном случае неопределенных факторов. Мы не знаем, увеличивает ли ионизирующая радиация частоту нерасхождений при облучении на различных стадиях развития половых клеток и если да, то какого увеличения следует ожидать? Доказывают ли данные, полученные на человеке, что радиация индуцирует нерасхождения, или существует другое возможное объяснение фактов, о которых шла речь раньше (возможное увеличение анеуплоидии по Х-хромосоме среди детей лиц, переживших атомную бомбардировку; возможное увеличение числа детей-трисомиков в потомстве матерей, облученных в диагностических целях). В отличие от нерасхождения потеря хромосом, вызванная облучением матерей за несколько недель до или через несколько часов после зачатия, - хорошо установленный факт. Сильный эффект мощности дозы свидетельствует, что опасность сопряжена главным образом с острым облучением высокими дозами, тогда как хроническое облучение при очень низких мощностях дозы, возможно, не увеличивает частоты мутаций. Количественный эффект для человека предсказать трудно, так как большинство спонтанно возникающих зигот ХО у людей абортируется. Исследования на пациентах с кариотипом ХО ясно показывают, что большинство из них обязаны своим происхождением потере одной половой хромосомы в результате задержки анафазы или митотическому нерасхождению во время раннего деления дробления. Заманчиво предположить, что абортированные зиготы ХО являются результатом нерасхождения в мейозе, поскольку мы уверены, что нерасхождение Х-хромосом действительно происходит (об этом свидетельствует существование генотипов XXY и XXX). Неизвестно, приводит ли потеря хромосом в период после зачатия до первого деления дробления к жизнеспособным зиготам ХО у человека, однако появление зигот с таким генотипом даже в отсутствие радиации свидетельствует о повышенном общем риске потери хромосом в ходе первых делений. Вот почему необходимо считать недели, к которым приурочено оплодотворение, периодом особой чувствительности к повреждениям. В это время и в течение нескольких недель после облучения высокими дозами радиации при высоких дозовых мощностях следует избегать зачатия. 5. Мутации 253
Структурные хромосомные аберрации. В данном случае мы находимся в лучшем положении. Наиболее важной группой структурных аберраций, с которыми доживают до рождения, являются транслокации. Они могут быть сбалансированными или несбалансированными, приводя или к появлению индивида с синдромом, обусловленным частичной трисомией (или частичной моносомией), или к рождению здорового носителя транслокации. Как показали обследования новорожденных, большинство носителей транслокаций фенотипически нормальны, а транслокации у них сбалансированы. Однако для носителей транслокаций de novo, выглядящих сбалансированными, возможно, немного повышен риск стать умственно отсталыми (разд. 2.2.2). Громадное большинство несбалансированных зигот умирает на эмбриональной стадии. У людей несбалансированные транслокации вызывают выщепление несбалансированных зигот в последующих поколениях. У экспериментальных животных соответствующий феномен называется полустерильностью, так как носители транслокаций имеют меньшее число здоровых потомков, чем нормальные животные. Несбалансированные зиготы гибнут в матке. Люнинг и Сирл [1537] получили оценку удваивающей дозы (разд. 5.2.1.3) для полустерильности, равную 0,31 Гр, после облучения сперматогониев самцов мыши. Это эквивалентно увеличению, равному 0,34 х 10–2 на Гр на гамету. Прямые данные, полученные на людях-добровольцах и на обезьянах-мармозетках, свидетельствуют о более высокой (в 2-3 раза) по сравнению с мышами чувствительности их сперматогониев к индукции транслокаций, визуально обнаруживаемых в первом мейотическом делении. Как уже отмечалось, частота элиминации транслокаций до появления на свет высока как у мышей, так и у людей, однако неизвестно, не компенсирует ли более высокая частота элиминации у людей более высокую частоту индукции, что было показано в процитированных выше работах. Поэтому разумно предполагать, что для людей удваивающая доза для индукции транслокаций равна приблизительно 0,15 Гр, а частота индукции транслокаций – 0,7 х 10–2 на Гр на гамету. Установлено, что робертсоновские транслокации не (или почти не) индуцируются [1453]. Постмейотические мужские половые клетки, особенно сперматиды, более чувствительны к индукции транслокаций, чем сперматогонии. Однако при низких мощностях дозы транслокаций в сперматогониях образуется меньше. У самок мышей, по-видимому, радиационной чувствительностью обладают половые клетки за несколько недель до оплодотворения и оогонии эмбрионов. Для оогоний была получена оценка соответствующего увеличения, равная 0,16 х 10~2 на Гр на гамету. Эта оценка составляет около половины величины, полученной для сперматогониев. Для других структурных аберраций, особенно делеций, достоверные данные на мышах отсутствуют. Однако известно, что частота делеций у новорожденных человеческих индивидов мала (разд. 5.2.1, табл. 5.3). Делеции неизменно приводят к синдромам с тяжелыми пороками развития и обычно к ранней смерти. В качестве первого приближения увеличение количества радиационно-индуцированных делеций можно считать сходным с увеличением количества транслокаций, поскольку основным событием и в случае делеций, и в случае транслокаций является хромосомный разрыв. Точковые мутации. Здесь мы находимся на более твердой почве, особенно когда имеем дело с единичными аутосомно-рецессивными мутациями. Люнинг и Сирл (1971) [1537] установили, что удваивающая доза при остром облучении мышиных сперматогониев равна 0,32 Гр, а оценка для индуцированных мутаций составляет 2,45 х 10–5 на Гр на рентген на локус. Имеет место сильный эффект мощности дозы; в случае хронического облучения с очень низкими дозовыми мощностями удваивающую дозу можно оценить по крайней мере в 1 Гр, что соответствует увеличению количества мутаций, равному ≈ 0,8 х 10–5 на Гр на локус. Частота мутаций в мужских постмейо- 254 5. Мутации
тических половых клетках приблизительно в два раза выше, чем в сперматогониях, при наличии очень небольшого эффекта мощности дозы. Это свидетельствует о том, что удваивающая доза равна 0,16 Гр независимо от дозовой мощности. Такая ситуация вполне реальна и для людей. Следовательно ≈ 6-8 нед, предшествующих зачатию, следует считать особенно опасными. В течение этого времени необходимо избегать острого облучения и рентгеновского обследования тазовых органов, прямо воздействующих на гонады. С другой стороны, опасность хронического облучения будет очень небольшой, так как индивидуальные половые клетки пребывают на наиболее опасной для них стадии развития в течение лишь нескольких недель. Чувствительность оогоний к индукции монолокусных мутаций пока неизвестна. Ооциты приблизительно до 7 нед перед оплодотворением, по-видимому, устойчивы; никаких сообщений об увеличении частот мутаций после острого или хронического облучения не появлялось. В течение 7 нед, предшествующих оплодотворению, частота мутаций была оценена равной 1,85 х х 10–5 на локус (облучение одной дозой в 2 Гр) и 18 на Гр на дозу, когда 2 Гр даются 20 порциями [1541]. Отсюда, считая частоту спонтанных мутаций равной 4,9 х 10–6 на локус (раздел 5.2.1.3), получаем, что удваивающая доза при остром облучении равна ~ 0,25 Гр. При фракционировании дозы удваивающая доза была бы гораздо выше и, проявляя сильный эффект мощности дозы, возможно, еще намного выше в случае хронического облучения. Практический вывод из этого состоит в том, что следует избегать зачатия в течение нескольких недель после облучения. Неизвестно, устойчив ли ооцит человека, подобно ооциту мыши, к индукции точковых мутаций на протяжении большей части его существования. Резонно предполагать, что соответствующие эффекты сопоставимы с эффектами, обнаруженными в случае рецессивных мутаций. Сколько естественно возникающих «спонтанных» мутаций индуцируется естественным фоном радиации? Рассмотрение удваивающих доз и числа индуцированных мутаций на Гр на локус помогает в получении оценок частоты естественно возникающих мутаций, индуцированных естественным фоном радиации. Эта радиация оценивается величиной, составляющей от 0,03 до 0,04 Гр за 30 лет (табл. 5.26). Мощность дозы крайне низка. Поэтому оценка удваивающей дозы для мутаций в сперматогониях в 1 Гр, вероятно, вполне приемлема. Дополнительное облучение, сходное по величине с фоновой радиацией, увеличило бы частоту спонтанных мутаций на 3-4% и такая же доля частоты спонтанных мутаций, возможно, обусловлена естественным фоном радиации. Сколько мутаций возникло бы спонтанно, если бы не было дополнительного облучения, обусловленного факторами современной цивилизации. Все полученные выше для точковых мутаций оценки являются относительными. Они представлены или в виде удваивающих доз или в виде числа новых мутаций на рентген и на локус. Чтобы перевести их в абсолютные оценки, необходимо знать число локусов, подвергающихся риску. Проблема общей частоты точковых мутаций в геноме человека обсуждалась в разд. 5.1.4.2 при рассмотрении частот спонтанных мутаций для отдельных генов. Из этого обсуждения видно, что экстраполяция частот отдельных мутаций на весь геном человека зависит от предположений о числе локусов, подвергающихся риску, числе мутаций внутри одного локуса, приводящих к идентифицируемому фенотипу и об эффектах, если они есть, мутаций в последовательности ДНК, не кодирующих полипептидных цепей. На все эти вопросы так трудно ответить, что мы просто не в состоянии прямо оценить, насколько может увеличиться частота возникновения точковых мутаций после воздействия данной дозы радиации. Некоторые из этих трудностей можно обойти, если вопрос поставить несколько проще: какого увеличения частоты генетически детерминируемой болезни можно ожидать вследствие данного увеличения уровня радиации? Чтобы ответить на этот 5. Мутации 255
вопрос, мы должны знать частоту генетически детерминируемого заболевания в отсутствие дополнительного облучения, долю генетических болезней, поддерживаемых в популяции мутациями de novo и увеличение частоты возникновения мутации, приходящуюся на данную дозу радиации. Предварительные ответы на последний вопрос получены в предшествующих разделах. К сожалению, у нас нет необходимой информации относительно частоты генетически детерминируемых болезней человека. Имеется только одна группа наследственных аномалий, для которых возможно получение относительно достоверной абсолютной оценки,- структурные аберрации хромосом, главным образом транслокации. Согласно Джекобсу (1972) [1501], у 43 558 новорожденных выявлено 82 эуплоидных структурных аберраций аутосом, 20% которых возникли в результате мутаций de novo. Дополнительно в той же выборке обнаружена 21 анеуплоидная аберрация, одна треть которых возникла вследствие мутаций de novo. Удваивающая доза для транслокаций была равна 0,31 Гр при остром облучении [1537] и 0,93 Гр при хроническом облучении. Это приводит к следующей оценке частоты индуцированных мутаций на 0,01 Гр на гамету при объединении эуплоидных и анеуплоидных зигот:
Дополнительная радиация в 0,01 Гр на поколение увеличила бы частоту половых клеток с вновь возникшими аберрациями этого типа на 2,8 в расчете на 1 миллион половых клеток и, поскольку индивид образуется в результате слияния двух половых клеток, на 5,6 индивидов с такой аберрацией на 1 миллион. Эта оценка, вероятно, может быть сильно заниженной (в 2-4 раза), если сперматогонии человека действительно более чувствительны к радиации, чем сперматогонии мыши. Для трисомий расчет увеличения их числа на грей невозможен. Частота трисомий известна и точно в два раза больше частоты мутаций, так как каждый трисомик является мутантом de novo. Но в данном случае мы не располагаем оценкой ее увеличения на грей и на гамету. Однако, основываясь на данных о мышах, есть веские основания предполагать, что это увеличение, возможно, меньше, чем в случае структурных аберраций. Получение оценок для генных мутаций представляет гораздо большую сложность, так как ни количество генетически детерминированных болезней в отсутствие облучения, ни доля болезней, поддерживаемых в популяции мутациями de novo, неизвестны. Количество генетических болезней в популяции неизвестно. Многим читателям может показаться удивительным, что определение частоты наследственных болезней в человеческих популяциях никогда не производилось. Были предприняты две серьезные попытки выявления всех случаев наследственных заболеваний в хорошо изученных популяциях Северной Ирландии [1649] и Британской Колумбии (Канада) [1661]. Полученные данные использованы экспертами ООН в качестве основы для оценок риска. Однако критическое изучение таблиц, опубликованных в этих работах, показывает, что авторы не провели персональных обследований и генетической классификации больных, а вынуждены были полагаться на диагнозы, поставленные большим числом практикующих врачей, и иногда даже на их заключения относительно способов наследования. Диагнозы редких болезней часто бывают ошибочными, что вносит путаницу в классификацию многих наследственных болезней и не позволяет судить об их генетической и средовой гетерогенности. Для этого необходимо проведение обширных клинических и лабораторных исследований. Между тем диагностическая практика, принятая в медицине, часто не требует (и не должна требовать) детального анализа (см. разд. 3.8.14). Для генетиков-клиницистов несостоятельность этих сообщений очевидна. Почему же доклады ООН в значительной степени ос- 256 5. Мутации
нованы на этих данных? Да потому, что ученые, которые готовят эти доклады, являются в основном специалистами в области экспериментальной генетики и не имеют медицинского образования. Распространение доминантных и Х-сцепленных болезней. Попытки определения общих частот наследственных болезней в человеческих популяциях до сих пор терпели неудачу. Однако для многих заболеваний с доминантным или Х-сцепленным типом наследования проведены исследования, выполненные врачами - специалистами по соответствующим болезням. Во всех случаях для постановки и проверки диагноза использовали современные методы. Результаты таких исследований должны дать правильное представление о порядке величин, характеризующих распространение этих болезней. В табл. 5.28 приводятся сведения о наиболее часто встречающихся заболеваниях этого типа [1412]. Распространенные болезни, как правило, начинаются в зрелом возрасте. Собственно, они получили распространение именно потому, что репродуктивная приспособленность таких больных относительно высока; болезнь часто проявляется уже после того, как пациент обзавелся потомством. Наибольшее распространение имеет моногенная семейная гиперхолестеринемия. Ошибка метаболизма при этой болезни рассматривалась в разд. 4.6.4. Гетерозиготные мужчины подвержены 50%-му риску проявления к 50 годам коронарной недостаточности и 50%-му риску умереть от ишемической болезни сердца к 60 годам. Среди других заболеваний этой группы - хорея Гентингтона, нейрофиброматоз, множественные экзостозы и поликистоз почки. Общая частота аутосомных доминантных болезней, включая те, которые встречаются редко и не приведены в табл. 5.28, составляет приблизительно 7/1000. Анализ результатов исследований, касающихся Х-сцепленных рецессивных болезней, дал оценку равную ~ 1/1000. Известна поразительная этническая и географическая изменчивость по аутосом- 5. Мутации 257 Таблица 5.29. Приблизительные доли пациентов с аутосомно-доминантными заболеваниями, обусловленными мутациями de novo. [По Goldstein, Brown (1977) с изменениями.]
но-рецессивным болезням, которая будет обсуждаться в разд. 6.1.3. Частота аутосомно-рецессивных патологий имеет лишь очень отдаленную связь с частотой соответствующих мутаций (разд. 5.1.3). Поэтому предсказания частот этих болезней в будущем на основе предположений об увеличении частот мутаций невозможно. Любое увеличение частоты мутаций будет лишь очень медленно (по прошествии многих поколений) приводить к росту количества гомозиготных больных индивидов. Этот вопрос мы обсудим в разд. 6.2.1. Однако даже в случае аутосомно-доминантных и Х-сцепленных рецессивных патологий, оценки частот могут быть использованы для прогнозирования частоты больных в будущем при возникновении соответствующих индуцированных мутаций (если эта частота поддерживается посредством равновесия между мутациями и отбором). Любое увеличение частоты мутаций в конце концов приведет к новому равновесию, при котором частота заболеваний увеличится в той же пропорции, что и частота мутаций. Однако относительно некоторых из доминантных болезней, приведенных в табл. 5.28, и особенно в случае наиболее часто встречающихся неизвестно, действительно ли они поддерживаются в результате равновесия между мутационным процессом и отбором. Например в случае хореи Гентингтона, Вендт и Дром [941] не смогли найти у нескольких тысяч пациентов с этим заболеванием даже одну бесспорную мутацию de novo. Возможно, в прежние века соответствующий ген обладал селективным преимуществом, например из-за повышенной сексуальной активности его носителей на начальных стадиях болезни. Частота мутаций de novo в случае аутосомно-доминантных болезней и биологическая приспособленность. Индивиды с доминантными заболеваниями, влияющими на выживаемость, имеют меньшую вероятность оставить после себя потомство. Вот почему можно ожидать, что многие случаи таких болезней представляют собой результат мутаций de novo у родителей, не страдающих этой патологией. Чем ниже биологическая приспособленность, тем выше будет доля случаев, обусловленных новыми мутациями. При болезни, приводящей к ранней смерти или исключающей репродукцию, большинство больных будут мутантами de novo. Приблизительные доли пациентов с аутосомно-доминантными заболеваниями, болезнь которых обусловлена новыми мутациями, приведены в табл. 5.29. В случае болезней, не нарушающих репродукцию благодаря позднему их началу (таких как поликистоз почек и хорея Гентингтона), мутантами de novo оказываются очень немногие больные или же таковые вообще отсутствуют. Кроме того, такие болезни будут чаще встречаться в популяции. Несмотря на эти критические замечания, в следующем параграфе мы будем придерживаться предположения, что частоты доминантных мутаций, приведенные в табл. 5.28, поддерживаются в результате равновесия между отбором и мутациями и что увеличение скорости мутирования рано или поздно приведет к увеличению их частоты. Это наиболее осторожное предположение; оно предсказывает самое высокое увеличение частоты за счет индуцированных мутаций. Некоторые гипотезы относительно неполной пенетрантности и мультифакториальных болезней. Для большого числа болезней, имеющих по крайней мере частичную генетическую детерминацию, не удается ни
258 5. Мутации
выявить соответствующую хромосомную аберрацию, ни установить какой-либо простой способ ее наследования. Вывод о наличии генетической компоненты может быть сделан на основании более высокой, чем в общей популяции, частоты больных среди родственников пробандов и из более высокой конкордантности пар монозиготных близнецов по сравнению с дизиготными. Генетический анализ таких данных можно осуществить только на фенотипическом уровне с применением биометрико-статических подходов. Такие биометрические модели часто используются для сравнения очень общих гипотез мультифакториального наследования с более конкретными генетическими моделями, например с моделью аутосомно-доминантного наследования со сниженной пенетрантностью (разд. 3.1.2). Три основных класса внутри этой группы патологий составляют врожденные пороки развития, «распространенные» болезни вроде диабета и гипертонии и психические заболевания, например шизофрения и маниакально-депрессивный психоз. Для большинства этих болезней мультифакториальная генетическая модель с пороговым эффектом дает довольно адекватное описание типа наследования (разд. 3.6). Однако тщательный анализ фенотипов и родословных во многих случаях привел к выделению редких типов заболеваний с простыми способами наследования. Примеры таких болезней (к ним относится, скажем, Х-сцепленная умственная отсталость) приведены в табл. 5.28. Наши знания об индуцированных радиацией доминантных скелетных мутантах мыши свидетельствуют о том, что доминантные главные гены с очень неполной пенетрантностью и крайне вариабельной экспрессивностью встречаются гораздо чаще, чем это до сих пор предполагалось (разд. 3.6.2.5). Болезни этой категории несомненно поддерживаются в популяции новыми мутациями, и число больных может поэтому увеличиваться с ростом частоты возникновения соответствующих мутаций. С другой стороны, изучение ассоциации болезней с системами генетического полиморфизма, например с антигенами HLA и группами крови (разд. 3.7), показало, что эти системы имеют отношение к генетической детерминации некоторых наследственных болезней. Однако, поскольку частоты генов полиморфных систем поддерживаются не мутациями, а, вероятно, балансирующим отбором (разд. 6.2.1.3), увеличение скорости мутирования не должно влиять на частоты полиморфных генов и, следовательно, на частоты таких мультифакторных заболеваний (разд. 3.6). Влияние мутаций на частоту врожденных дефектов оценить трудно. Очень немногие из таких дефектов являются явно моногенными. Но вот влияние главных генов на некоторые из них не исключено. Лишь немногие врожденные дефекты полностью обязаны своим возникновением окружающей среде. Поразительные различия в популяционных частотах индивидов с дефектами нервной трубки могут объясняться невыявленными средовыми воздействиями. Для большинства врожденных дефектов предполагается взаимодействие между множественными генетическими и пока неизвестными средовыми факторами. Эффекты мутаций должны зависеть от природы лежащей в основе заболеваний генетической изменчивости. Если значительная часть генетической изменчивости, предрасполагающей к врожденным дефектам, обусловлена системами генетического полиморфизма, поддерживаемыми отбором, мутации должны иметь небольшое влияние или вообще не влиять на их частоты. Продолжая анализировать этот вопрос, можно предположить, что, например, врожденные пороки сердца обусловлены случайными или стохастическими процессами, не испытывающими влияния ни генетических, ни средовых факторов, поскольку конкордантность по таким сложным врожденным дефектам органогенеза у идентичных близнецов низкая [2348]. В табл. 5.30 приведена оценка дополнительного числа индивидов, имеющих наследственные дефекы, на 0,01 Гр дополнительного облучения. Она взята из доклада UNSCEAR и основана на экспертных оценках, представленных рабочей группой Международной комиссии по радиационной защите. В согласии с отчетом за 5. Мутации 259
1982 г., приведенные здесь оценки ниже тех, что публиковались раньше. Причины этого в росте наших знаний о некоторых проблемах. Например, раньше предполагалось, что риск возникновения робертсоновских транслокаций равен риску возникновения реципрокных транслокаций. Теперь известно, что он намного меньше (если вообще существует). Понижение оценок риска показывает, что таким комитетам свойствен консерватизм в том смысле, что в сомнительных случаях они всегда принимают более высокие величины риска. С другой стороны, эти оценки касаются только наследственных дефектов; возможная изменчивость нормы здесь не рассматривалась. Например, в случае рецессивной болезни число гомозигот будет увеличиваться лишь очень медленно. Однако, если гетерозиготы по генам некоторых рецессивных болезней, таких как фенилкетонурия, имеют слегка пониженный IQ, увеличение средней гетерозиготности, обусловленное дополнительными мутациями, могло бы повлиять на изменчивость IQ в нормальной популяции. Поверхностное рассмотрение этой таблицы может создать впечатление, что в отсутствие ионизирующей радиации или других мутагенных факторов частота генетических аномалий по прошествии поколений осталась бы той же самой. Это предположение, однако, не подтверждается; например, аутосомно-рецессивные болезни в индустриальных странах имеют в настоящее время чрезвычайно низкую частоту, поскольку в течение нескольких последних поколений произошло быстрое снижение частоты кровнородственных браков (разд. 6.3.1.2). Следовательно, частоты гомозигот будут очень медленно в течение сотен поколений увеличиваться до достижения нового равновесия. Частота доминантных и Х-сцепленных заболеваний, с другой стороны, будет испытывать отрицательное влияние ослабления естественного отбора, обусловленного усовершенствованием терапии, а также положительное влияние, связанное со все более эффективным генетическим консультированием и пренатальной диагностикой. Даже если бы увеличение частоты наследственных заболеваний и (или) врожденных дефектов было обнаружено в ходе тщательного мониторинга, было бы 260 5. Мутации
трудно, если не невозможно, выделить в качестве причины такого увеличения какой-либо один фактор, скажем облучение. В другом источнике, с которым мы рекомендуем ознакомиться, приводится еще более низкая оценка для доминантных и Х-сцепленных мутаций [1417]. Для уточнения этих оценок необходимы более основательные знания: 1) о генетических факторах, лежащих в основе мультифакториальных заболеваний и о соответствующих доминантных генах с низкой пенетрантностью; 2) о частоте и распространенности наследственных заболеваний (т.е. нужны тщательно спланированные, широкомасштабные эпидемиологические исследования, в которых медико-статистическая информация объединяется с результатами изучения отдельных больных); 3) о взаимодействии между мутациями и естественным отбором, особенно в случае тех болезней, для которых существование равновесия между мутационным процессом и очень сильным отбором не является очевидным фактом. В разделе 5.2.1.2 были поставлены четыре вопроса: 1. Каким образом данный фактор действует, если он вообще действует, на генетический материал? 2. Насколько сильно подвергается человеческая популяция воздействию этого фактора? 3. Сколь значительного увеличения частоты «спонтанных» мутаций следует ожидать? 4. Каковы его долговременные последствия для популяции? Длинная цепь аргументов привела нас к ответу на вопрос 3. Хотя рассуждения, касающиеся ответа на четвертый вопрос не так громоздки, пока мы не узнаем, какую долю всех мутаций составляют вредные, ответить на самую существенную часть этого вопроса, мы не сможем. Популяционные исследования на облученных популяциях мыши могли бы привести нас к довольно оптимистическим выводам относительно последствий для человеческих популяций, но люди не мыши, и экстраполяция этих результатов может вводить в заблуждение. Обсуждение проблем популяционной генетики (разд. 6) покажет, где со временем могут быть найдены ответы на вопрос о долговременных тенденциях. При внимательном рассмотрении проблема генетического риска, обусловленного ионизирующей радиацией для человеческих популяций, оказалась неожиданно сложной. Однако путь к решению этой проблемы хоть и пролегает через густой лес, перерезаемый глубокими оврагами, более или менее ясен. Совершенно другая ситуация имеет место в случае генетического риска, вызываемого химическими мутагенами. Здесь мы встречаемся с еще более сложными проблемами, и едва ли можно сказать, что научное сообщество уже приступило к их решению. Дата добавления: 2015-12-16 | Просмотры: 1179 | Нарушение авторских прав |