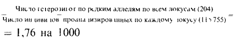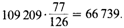|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Генетический полиморфизмОпределение и история вопроса. Полиморфным признаком называется менделевский (моногенный) признак, по которому в популяции присутствуют по крайней мере два фенотипа (и предположительно по крайней мере два генотипа), причем ни один из них не является редким, т. е. не встречается с частотой менее 1-2%. Часто в популяциях присутствует больше двух аллелей (и соответственно более чем два фенотипа) по данному локусу. Альтернативное полиморфизму явление – наличие редких генетических вариантов. Редкие генетические варианты условно определяются как моногенные признаки, присутствующие в популяции с частотой менее 1-2% (а обычно с гораздо более низкой частотой). Первый полиморфный признак - система групп крови АВ0 - был открыт Ландштейнером еще в 1900 г. [259]. До 1955 г. были известны только случаи полиморфизма по нескольким поверхностным антигенам эритроцитов, т. e. группам 6. Лопуляционная генетика 281
крови. В 1955 г. Смитис [1307, 1308] описал методику электрофореза в крахмальном геле, при помощи которой можно разделять белки в поддерживающей среде не только в зависимости от их заряда, но и по молекулярной массе. Этот новый метод позволил Смитису выявить полиморфизм гаптоглобина - сывороточного белка, связывающего гемоглобин. Электрофорез с успехом использовали для обнаружения полиморфизма по сывороточным белкам, а затем в комбинации с методами определения специфической активности ферментов для выявления полиморфизма ферментов [78, 1769]. Высокий уровень полиморфизма продемонстрирован для многих сывороточных белков, а также для ферментов плазмы крови, эритроцитов и лейкоцитов. Во многих случаях генетическая детерминация полиморфизма проста: два аллеля определяют два варианта одного белка. Но есть и сложные полиморфные системы, например главный комплекс гистосовместимости (МНС). Множественные, взаимосвязанные локусы, составляющие эту систему, локализованы в 6-й хромосоме человека (разд. 3.5.5). Ситуация в настоящее время. В табл. 6.1 приведены наиболее важные полиморфные признаки человека. Некоторые из них демонстрируют полиморфизм только в пределах одной основной расовой группы. Для нескольких случаев полиморфизма были выдвинуты гипотезы о механизмах их поддержания естественным отбором в популяциях человека. Более подробно эти гипотезы рассмотрены в разд. 6.2.1 и 6.2.1.8. Биохимическое своеобразие по полиморфным белкам. В 1902 г. Гэррод [249] закончил свою статью об алкаптонурии следующими словами: «Если в случае алкаптонурии и других рассмотренных заболеваний мы действительно имеем дело не с результатом метаболических процессов, а с индивидуальными особенностями метаболизма, естественно возникает мысль о том, что последние отражают химическую изменчивость, в незначительной степени присущую всем особям. Как не существует двух особей одного вида, абсолютно идентичных по своим внешним признакам, так и химические процессы в разных организмах совпадают не полностью. Это биохимическое своеобразие поразительно, если рассматривать все случаи полиморфизма по группам крови. Предположим, к примеру, что некий житель северо-западной Европы имеет наиболее часто встречающиеся аллели каждой полиморфной системы, приведенной в табл. 6.1. Сколько других индивидов будут иметь тот же фенотип и генотип по всем этим маркерам? Соответствующая вероятность вычисляется путем перемножения относительных частот этих фенотипов в населении белой расы (табл. 6.2), что дает величину 3,1·10–5, т.е. из 100000 мужчин только два или три будут иметь данный фенотип, несмотря на то что такое сочетание аллелей встречается наиболее часто. Все другие аллельные комбинации еще более редки. В табл. 6.1 не вошли фенотипы по главному комплексу гистосовместимости (МНС) (разд. 3.5.5) и другие менее детально изученные полиморфные системы, а также многие системы ферментов, для которых выявлены только редкие варианты. Если включить в рассмотрение все эти системы, то можно показать, что любой человек на нашей планете, за исключением идентичных близнецов, генетически уникален. Физиологическая функция известна только для некоторых из перечисленных в табл. 6.1 полиморфных систем. Возможное значение полиморфных генов для предсказания риска заболевания в изменяющихся условиях среды обсуждалось в разд. 4.5.2. Какова доля полиморфных локусов у человека? Сколько у человека полиморфных генов? Составляют ли полиморфные локусы небольшую часть генома человека или их доля высока? Группы крови могут быть идентифицированы только в том случае, если к определенным антигенам обнаружены антитела. Серологическое выявление генного локуса обычно заранее предполагает существование генетической изменчивости по данному локусу – наличия полиморфизма или редких вариантов. Выявление генетической изменчивости ферментов 282 6. Популяционная генетика
6. Популяционная генетика 283
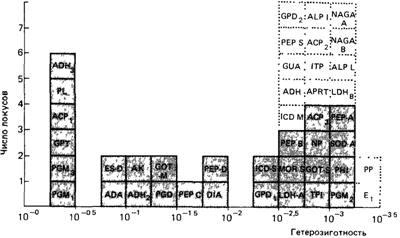
производится иначе: в этом случае необходимо непосредственно идентифицировать фермент в электрофоретической среде. При наличии полиморфизма белки, контролируемые альтернативными аллелями, часто имеют разную электрофоретическую подвижность. Идентификация нормального фермента (дикого типа) и его мутантного варианта может быть достигнута только путем локализации фермент-специфичной биохимической реакции в поддерживающей электрофоретической среде, например в крахмальном геле. Для этого необходимо разработать такую тест-систему, которая позволяет визуально выявить положение фермента в геле. Например, кислая фосфатаза эритроцитов при рН6 расщепляет фенолфталеинфосфат на фенолфталеин и фосфат; свободный фенолфталеин окрашивает гель только в том месте, куда мигрировал фермент. Окрашенные участки располагаются на геле по-разному, что можно связать с соответствующими изменениями соответствующих генов (рис. 6.2). Скрининг многих ферментов, проведенный аналогичными методами, позволяет получить несмещенную оценку доли полиморфных локусов. Такая оценка была получена Харрисом и Хопкинсоном в 1972 г. Эти авторы объединили данные электрофоретических исследований населения Европы примерно по 70 различным локусам, кодирующим ферменты. Число исследованных ферментов было меньше, поскольку один фермент может состоять более чем из одной полипептидной цепи и, следовательно, кодироваться более чем одним геном. Считается, что ген полиморфен, если частота 284 6 Популяционная генетика
его наиболее распространенного аллеля не превышает 0,99. Поскольку частота гетерозигот (2pq) приблизительно равна удвоенной частоте гена (q), по таким аллелям должно быть гетерозиготно около 2% популяции. Согласно этому определению, 20 из 71 (28,2%) локуса оказались полиморфными. Эта цифра не отражает всего числа полиморфных локусов, так как некоторые варианты могут не идентифицироваться электрофоретически, а обнаруживаться другими методами (например, псевдохолинэстераза) (разд. 4.5.1). Эти расчеты относятся только к полиморфизму, выявляемому методом электрофореза. Поскольку в некоторых случаях разрешающая способность этого метода недостаточна для того, чтобы ясно различить белковые варианты, оценка 28,2% почти наверняка занижена. По одному из исследованных ферментов - кислой фосфатазе эритроцитов, имеющей 3 распространенных аллеля, - более 50% популяции оказалось гетерозиготно. Уровень гетерозиготности других локусов был значительно ниже; средняя доля гетерозиготных особей, рассчитанная по 71 локусу, равнялась 6,7% на локус. Исходя из свойств генетического кода, можно сделать вывод, что только одна треть из всех возможных нуклеотидных замен приводит к полярным заменам аминокислот, т. е. к таким заменам, которые обусловливают изменение электрофоретической подвижности [1681]. Однако нет никакого основания априорно предполагать, что мутации, приводящие к неполярным заменам, возникают с меньшей частотой. Поэтому реальный уровень средней гетерозиготности на локус, вероятно, приблизительно в три раза выше и составляет около 20%. Сходные результаты, касающиеся повсеместного распространения генетического полиморфизма, были получены для всех исследованных биологических видов (рис. 6.3). 6 Популяционная генетика 285
Таким образом, этот феномен не является уникальной особенностью человека, для которого он был впервые показан. Обсуждение причин высокой генетической гетерогенности, неудивительной для человека с его высокодифференцированными индивидуальными особенностями, вызвало значительные разногласия среди ученых и привело к возникновению теории недарвиновской эволюции, утверждающей, что большинство генов селективно нейтрально [1510; 1511] (см. разд. 7.2.3). Редкие варианты. В работе Харриса [1787] лимитирующая частота наиболее распространенного аллеля, определяющая условие генетического полиморфизма, была принята равной 0,99. Однако для многих ферментов известны редкие варианты. Зачастую редкие варианты присутствуют в популяции наряду с распространенными аллелями, однако для многих локусов известны только редкие варианты, а распространенные аллели отсутствуют. Частота и распространение редких вариантов в европейских популяциях исследованы Харрисом [1788]. Вероятность выявления редких вариантов зависит от величины выборки; для этой цели необходимо проанализировать выборку из нескольких сотен особей. Такие выборки были исследованы для 43 локусов, кодирующих ферменты. Редкими считались варианты, частота которых не превышала 0,005. Редкие аллели были найдены для 22 из 43 локусов (для 7 из 13 «полиморфных» и для 15 из 30 «неполиморфных» локусов) (рис. 6.4). Общее число редких аллелей составило 56. Большинство из них оказались очень редкими; 45 имели частоту менее 0,001. Влияние величины выборки на вероятность обнаружения редких вариантов видно из следующего факта. В тех случаях, когда были обнаружены редкие аллели, средний размер выборки составил 4023 индивида. Между тем для локусов, для которых редкие аллели выявить не удалось, средний размер выборки был равен только 1300. Важно отметить, что в этом исследовании редкие варианты были идентифицированы не для всех локусов, однако в других работах эту задачу удалось решить. Таким образом, можно предположить, что редкие варианты встречаются у всех ферментов. Средняя гетерозигогность на локус определялась для редких аллелей таким же способом, как и для полиморфных вариантов:
Для одного из локусов (кодирующего плацентарную щелочную фосфатазу) был характерен особенно высокий уровень гетерозиготности, обусловленный наличием редких аллелей. Когда этот локус был 286 6 Популяционная генетика
исключен из анализа, общая оценка средней гетерозиготности составила 1,14 гетерозигот на 1000 индивидов на локус. Подобные расчеты проводились и для других популяций. Например, показано, что частота редких аллелей 12 гликолитических ферментов равна приблизительно 2/1000 согласно объединенным данным по популяциям белой, черной и монголоидной рас [1891] и около 3/1000 по данным анализа 17 ферментных и белковых локусов в некоторых племенах индейцев Южной Америки. В выборке из японской популяции частота редких аллелей составила 2/1000 для 25 полипептидов, 23 из которых были также проанализированы в выборке из популяции Великобритании Харрисом [1788]. Частота редких аллелей двух локусов PGM1 (фосфоглюкомутазы) и PHI (фосфогексоизомеразы) оказалась выше в японской популяции по сравнению с английской [1578]. Частота возникновения мутаций (скорость мутирования) может быть низкой. Для редких вариантов можно определить среднюю частоту возникновения мутаций [1788]. Точнее можно вычислить верхнюю доверительную границу μ. Чтобы решить эту задачу, Харрис выбрал 36 локусов, для которых имелись данные о генотипе родителей пробандов. По этим 36 локусам было в общей сложности изучено 109 209 человек, 126 из них несли редкий вариант. Оба родителя обследованы только в 77 из 116 случаев, и всегда у одного из них обнаруживали редкий вариант: новых мутаций выявлено не было. Эта группа из 77 носителей редких генов соответствует контрольной выборке проанализированных особей, величина которой равна
Поэтому можно утверждать, что в среднем в 2·66·739 = 133 478 родительских гаметах не возникло новых мутаций. Вероятность того, что в этих гаметах возникнет хотя бы одна новая мутация, равна 1 — е–nμ, где n - число гамет, а е - основание натуральных логарифмов. Решение уравнения 1-е– nμ = 0,95 для μ дает величину μ = 2,24•10–5 на ген на поколение как верхнюю доверительную границу реальной частоты возникновения мутаций. Это означает, что полученная оценка является завышенной по отношению к действительной скорости мутирования с вероятностью 95%. Если принять несколько иные допуще- 6. Популяционная генетика 287
ния и включить в рассмотрение данные, полученные многими другими исследователями, которые не смогли выявить ни одной вновь возникшей мутации в биохимических системах, скорость мутирования получается еще ниже. Определение скорости мутирования прямым методом, проведенное для другого класса мутаций - вызывающих доминантные или сцепленные с полом заболевания - также показало, что скорость мутирования скорее всего не превышает приведенную величину (разд. 5.1.3). С другой стороны, при электрофоретическом скрининге детей, родившихся у людей, переживших атомный взрыв, были обнаружены три новые мутации (табл. 5.27), что дает величину скорости мутирования 5,4·10–6; при расширенном скрининге новорожденных обнаружен один вновь возникший вариант гемоглобина [1679]. Распределение вариантов в зависимости от их частоты. На рис. 6.4 показано распределение вариантов ферментов в зависимости от их частот. Между распространенными и редкими вариантами наблюдается ярко выраженное различие, на основании чего были предложены разные гипотезы о механизмах эволюции (отбор или случайные изменения частот селективно нейтральных мутаций). Подробнее этот вопрос будет обсуждаться в разд. 7.2.3. Генетический полиморфизм других (например, структурных) белков [1892, 1803]. На основании данных о высокой частоте полиморфизма ферментов первоначально был сделан вывод о том, что большинство генов высоко полиморфно. Однако работы последних лет заставили усомниться в их правильности. В этих работах в основном использовался метод двумерного электрофореза, иллюстрируемый рис. 5.51 [1892]. В табл. 6.3 приведены результаты одной из них [1803]. В ней исследовали общую фракцию культуры фибробластов, фибробласты, фракционированные на осадок (белки, связанные с клеточными структурами) и супернатант (растворимые белки), а также растворимые белки клеток корней волос. Число качественно различающихся вариантов оказалось весьма низким. Уровень хорошо выявляемой количественной изменчивости был гораздо выше. Предыдущие работы, проведенные на мышах, показали, что такая количественная изменчивость также имеет генетическую основу. Кроме того, уровень как качественной, так и количественной изменчивости оказался выше у растворимых белков супернатанта. Отсутствие изменчивости в настоящее время показано не только для фибробластов, но и для других тканей человека, например мозга [1741] или лимфоцитов [1782, 1783]. Для объяс-
288 6. Популяционная генетика
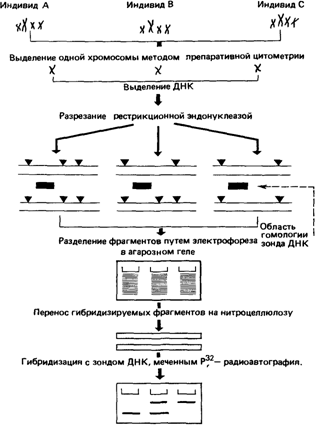
нения этого факта было высказано вполне реальное предположение, что в результате взаимодействия структурных белков со многими другими белками на число мутаций, ведущих к допустимым конформационным изменениям, накладываются жесткие ограничения [1992]. В пользу этой гипотезы говорит также более высокий уровень изменчивости растворимых белков по сравнению с белками, связанными с клеточными структурами. Более высокий уровень количественной изменчивости по сравнению с качественной, возможно, свидетельствует о более высокой толерантности к мутациям нетранскрибируемой ДНК, поскольку считается, что такие мутации оказывают влияние на скорость синтеза белка (см., например, разд. 4.6.4, талассемия). У лимфоцитов, стимулированных фитогемагглютинином, среди 200 различных пятен белков было найдено 3 полиморфных варианта, что подтверждено популяционными и семейными исследованиями [1782, 1783]. Все 3 варианта обнаружены в растворимой фракции. Возможно, что уровень полиморфизма лимфоцитов несколько выше, чем у фибробластов. На основании как этих работ, так и большого количества исследований других видов (мыши, дрозофилы) был сделан вывод, что полиморфизм встречается реже у структурных белков по сравнению с растворимыми белками крови. Однако следует избегать поспешных обобщений, поскольку в недавнем исследовании тромбоцитарных белков у человека, основной целью которого было обнаружение новых белковых вариантов, показан более высокий уровень генетической изменчивости [1838]. Уровень изменчивости, выявленный в этой работе, сравним с изменчивостью, показанной для растворимых белков плазмы и эритроцитов. Полиморфизм ДНК. Для экспрессируемых продуктов генов, таких, как группы крови, белки тканей и крови, характерен высокий уровень полиморфизма, однако генетическая изменчивость, наблюдаемая на уровне ДНК, существенно выше. Поскольку значительная часть генома, вероятно, не принимает прямого участия в регуляции или кодировании продуктов генов, мутации в этих нерегуляторных и некодирующих участках ДНК не имеют фенотипического выражения и являются селективно нейтральными. Определение последовательностей нуклеотидов у различных индивидов и использование рестрикционных ферментов для картирования генома человека выявило необыкновенно высокую изменчивость на уровне ДНК. Семейный анализ показал, что варианты ДНК наследуются в соответствии с законами Менделя. Таким образом, теперь в распоряжении исследователей находится совершенно новый набор генетических маркеров. Типы полиморфизма ДНК. Наиболее распространенный тип полиморфизма ДНК - рестрикционный полиморфизм. Если в сайте узнавания для какой-то рестриктазы происходит точечная мутация, фермент не распознает свой сайт и не разрезает ДНК (рис. 2.84). Имея под рукой специфические ДНК-зонды и рестриктазы, можно анализировать ДНК. Рестрикционные фрагменты ДНК (рестрикты) различаются по длине (полиморфизм по длине рестрикционных фрагментов). Они идентифицируются по различной подвижности после гибридизации по Саузерну (рис. 6.5). В настоящее время метод гибридизации по Саузерну включает радиоактивное мечение. Вероятно, в будущем появится возможность нерадиоактивного мечения фрагментов ДНК. Точечные мутации, заменяющие один нуклеотид на другой в некодирующем районе ДНК, встречаются очень часто. Немногие систематические исследования изменчивости ДНК проводились путем анализа с использованием большого количества рестриктаз в небольшой выборке особей (10-12). Результаты, полученные для хорошо изученных к настоящему времени областей генома (гемоглобина, альбумина и сегментов ДНК с неизвестной функцией из разных хромосом) [1143; 1742; 1959], свидетельствуют о том, что уровень нуклеотидной изменчивости приблизительно на порядок выше, чем наблюдаемый по структурным генам, кодирующим белки. Это означает, что разница между случайно выбранными хромосомами составляет в среднем 1/500 — 1/250 нуклеотидов (гетерозиготность = = 0,001 — 0,004). Особенно подходят для выявления вариантов ДНК ферменты Mspl и TaqI, узнающие метилированный динуклеотид CpG. Большинство вариантов по длине рестрикционных фрагментов диморфны, т. е. имеют только два «аллеля» - присутствие (+) или отсутствие (—) сайта рестрикции. Частота полиморфного ва- 6. Популяционная генетика 289
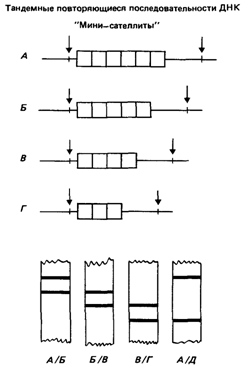
рианта может изменяться от нескольких процентов до максимальной-50%. Другой тип полиморфизма ДНК заключается в различном числе тандемных повторов, имеющих общую центральную часть из 10-15 пар оснований («мини-сателлиты») [1795]. Участок хромосомы может нести различное количество таких повторов. Возникновение полиморфизма этого типа облегчается благодаря идентичности последовательностей нуклеотидов в повторах, что приводит к делециям и дупликациям, возникающим в результате неравного кроссинговера (рис. 6.6). Длина рестрикционных фрагментов зависит от числа повторов. Такие гипервариабельные участки ДНК расположены около гена, кодирующего инсулин, и вокруг комплекса Нbβ в хромосоме 11, встречаются они и в других хромосомах. Поскольку данный тип полиморфизма ДНК выражается в разном числе повторов, гетерозиготность по нему обычна, а гомозиготность встречается редко. Это свойство существенно для исследований с использованием ДНК-маркеров, поскольку почти во всех случаях варианты информативны. На основе мини-сателлита интронной последовательности миоглобина Джеффри создал зонд, узнающий гипервариабельную ДНК [1795]. В разных хромосомах человека обнаружено много гипервариабельных участков. Уровень гетерозиготности в небольшой популяции, исследованной в это время, был весьма высоким и достигал почти 100%. Анализ инбредной родословной из 54 индивидов, относящихся к 4 поколениям, показал, что гетерозиготные полосы наследуются согласно законам Менделя. Интересно, что с помощью этого 290 6. Популяционная генетика
метода каждый индивид из родословной легко отличается от любого другого. Дальнейшее совершенствование этой методики даст возможность различать по «отпечаткам пальцев» (fingerprint) даже родственников. Заметим, что различие по длине рестрикционных фрагментов между родителями и детьми может возникать не только в результате точковых мутаций в сайте узнавания, но и в результате ошибки репликации или кроссинговера. Ожидается, что эти события происходят чаще, чем точковые мутации. Среди 27 индивидов, у которых проанализировано 240 полос, выявлена такая полоса, которой не было ни у одного из родителей, отсюда скорость мутирования составляет 1/240, что по крайней мере на 4 порядка выше, чем скорость мутирования для точковых мутаций (разд. 2.3.3.9). Использование ДНК-маркеров. Использование ДНК-маркеров значительно расширяет теоретические и практические возможности работ по сцеплению. Через несколько лет в распоряжении исследователей, вероятно, будет большое количество маркеров ДНК, равномерно распределенных по геному человека, что существенно расширит возможности пренатальной диагностики сцепленных с ними моногенных наследственных заболеваний (разд. 3.4) [946]. Возможно, с помощью ДНК-маркеров удастся точнее определить вклад различных генов в проявление широко распространенных заболеваний (менделевские признаки) путем обнаружения сайтов главных генов, не идентифицируемых по сцеплению. При дифференциации главных генов и полигенов возникают, однако, аналитические трудности (разд. 3.7). Варианты ДНК могут использоваться как маркеры в исследованиях по канцерогенезу [1685] и в анализе причин возникновения новообразований типа ретинобластомы, опухоли Вилмса и др. (разд. 5.1.6). Кроме того, станет возможной пренатальная диагностика наследственных форм этих опухолей. Поскольку новые полиморфные мини-сателлиты скорее всего несут рекомбинационные сигналы 6. Популяционная генетика 291
[1795], с их помощью можно исследовать механизм рекомбинации. Вполне вероятно, что в будущем при помощи маркеров ДНК будут проводить установление материнства и отцовства, а также идентификацию пятен крови и спермы в судебно-медицинской практике. Открытие полиморфизма на уровне ДНК произвело революцию в генетике человека и медицинской генетике. Думаем, что довольно скоро геном человека будет картирован полностью. Использование этой карты в теоретических и практических целях - увлекательная задача. Полиморфизм митохондриальной ДНК. Митохондрии передаются только по материнской линии всем потомкам; диплоидность, мейоз и рекомбинация в этом случае отсутствуют. Полиморфизм митохондриальной ДНК особенно важен для популяционной генетики, с его помощью изучают взаимодействие между популяциями и историю популяций [1792]. Вероятно, варианты митохондриальной ДНК не подвержены давлению отбора. Следовательно, сравнение наследующихся по материнской линии рестриктных вариантов и РНК в группах популяций позволяет получить достоверную картину их мутационной истории. Дата добавления: 2015-12-16 | Просмотры: 1085 | Нарушение авторских прав |