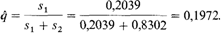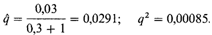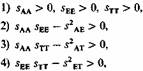|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
История некоторых инфекционных заболеваний.Какие инфекционные болезни могли влиять в прошлом на частоту генов в популяциях? 1. Острые инфекционные заболевания, распространявшиеся на целые страны и уносившие значительную часть их населения. Примеры: чума, холера, оспа. 2 Хронические инфекционные заболевания, например туберкулез, проказа и сифилис. 3. Разнородная группа кишечных инфекций, которые затрагивали все возрастные группы, но к летальному исходу приводили, в основном, в младенчестве и раннем детстве. 4. Тропические болезни, например малярия. Информация, касающаяся истории этих болезней, фрагментарна и зачастую неточна, поскольку бактериологические данные об эпидемиях прошлого отсутствуют, а по описаниям диагноз часто невозможно поставить. Однако некоторые выводы все же сделать можно [1791]. 1. Первые упоминания о чуме относятся к концу II – началу III в. до н.э. Известны подробные описания чумы в Александрии и Ливии в начале нашей эры; в средние века чума несколько раз вспыхивала в Европе, унося тысячи жизней. В более недавнее время эпидемии приходили с Ближнего Востока (Турции) и Южной и ЮгоВосточной Азии. Центры возникновения оспы находились в Африке и Азии, особенно в Индии и Китае. В обеих этих странах оспа была из- 6. Популяционная генетика 311 вестна в течение тысячелетий; В Индии даже существовала богиня оспы Ситала. 2. Туберкулез был эндемичным заболеванием в значительной части Старого Света и распространялся вместе с белыми поселенцами. В средние века в Европе часто встречалась проказа, однако к XVIII в. она была вытеснена оттуда благодаря улучшению условий жизни. В настоящее время проказа распространена в Индии, Юго-Восточной Азии и Южной Америке. Согласно одной из гипотез, сифилис являлся болезнью Нового Света (Центральной и Южной Америки) и был ввезен в Европу сразу после открытия Америки. После эпидемий конца XVначала XVI в. сифилис стал эндемичной болезнью [1728]. Хотя эта гипотеза достаточно хорошо соответствует многим историческим фактам, она принята далеко не всеми. Исторические гипотезы такого рода трудно опровергнуть, но еще труднее подтвердить. 3. Известно, что детская смертность от кишечных инфекций была очень высока в Европе вплоть до 1900 г., а в некоторых обширных областях Азии, Африки и Латинской Америки-до гораздо более недавнего времени. Представляется вероятным предположение о том, что высокая детская смертность от этих заболеваний наблюдалась в течение всей истории человечества. Гипотезы, более конкретно трактующие эти заболевания, сформулировать невозможно. 4. Хотя статистические данные по смертности, подобные упомянутым выше для Пруссии (рис. 6.17), для тропических стран появились только в последнее время, многие сведения указывают на то, что даже после второй мировой войны во многих из этих стран детская смертность была еще очень высока. Ее причина – различные заболевания, главные из которых – тропическая малярия и кишечные инфекции. Если предрасположенность к этим болезням обусловлена генетически, чувствительные индивиды должны умирать чаще, тогда как индивиды, обладающие большей генетической устойчивостью, имеют большую вероятность выжить и передать свои гены потомству. На генетический состав современных популяций человека подобные различия в устойчивости к инфекционным заболеваниям тоже оказывают сильное влияние. Последние десятилетия ознаменовались значительными успехами в изучении механизмов такой устойчивости и исследовании генетического состава популяций человека. Остановимся на двух примерах. 1. Отбор, обусловленный заболеваемостью малярией в связи с частотой генов гемоглобина в населении тропических стран. 2. Отбор в связи с группами крови системы АВО. Благодаря успехам, достигнутым за последние годы иммуногенетикой, в недалеком будущем в популяционный анализ, вероятно, будут включены и другие генетические системы. Распределение гена серповидноклеточности и других генов, кодирующих аномальные формы гемоглобина. Наиболее известный пример гетерозиса у человека - селективный механизм, обусловливающий высокую частоту гена серповидноклеточности в некоторых популяциях. Молекулярные основы, генетическое определение и взаимосвязь генотипа и фенотипа в случае серповидноклеточного гемоглобина рассматриваются в разд. 4.3 и 5.1.4. Серповидноклеточный гемоглобин (HbS) возникает в результате замены одного нуклеотида в глобиновой р-цепи. Пораженные гомозиготы страдают тяжелой гемолитической анемией, тогда как гетерозиготные индивиды в нормальных условиях клинически здоровы. С точки зрения популяционной генетики, поразительной особенностью гена серповидноклеточности является его крайне неравномерное распределение в мировой популяции. Впрочем, такое распределение обнаруживает не только этот ген; оно характерно для некоторых других вариантов гемоглобина, например HbC, D, Е и талассемии. Однако ген серповидноклеточности встречается наиболее часто. В пределах широкого периэкваториального пояса от Камеруна и Конго до Танзании гетерозиготность по HbS варьирует от 25% до такого высокого уровня, как 40%. Эта частота слегка понижается в направлении западной части Африки. В северной и южной Африке она гораздо ниже; во многих популяциях этих областей HbS встречается только спорадически. В Средиземноморье HbS особенно распространен в Сицилии, Калабрии и некоторых районах Греции. На полуострове Халкидики частота гетерозигот достигает 30%. Ген HbS сравнительно часто встречается в популяциях Южной Индии и обнаруживается в арабских странах. Его нет у коренных жителей Америки, практически отсутствует он и во всех популяциях севера и северо-запада Европы. В принципе существуют три объяснения такого неравномерного распределения. 312 6. Популяционная генетика
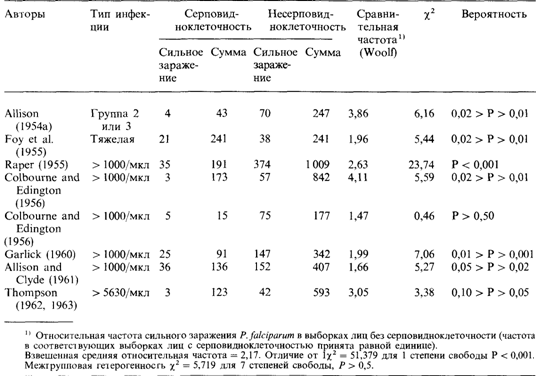
1. Различная частота возникновения мутаций (скорость мутирования), причины которой могут быть либо внешними (например, дифференциальное воздействие мутагенных факторов), либо внутренними (например, неравномерное распределение мутаторных генов). 2. Разное давление отбора в различных условиях среды. 3. Случайные колебания генных частот (генетический дрейф), особенно если эффективная репродуктивная величина популяции мала (разд. 6.4.1). Начнем обсуждение с последней возможности и отметим, что случайное возникновение различий между такими большими группами популяций, как в случае HbS, крайне маловероятно. Опровергает последнюю гипотезу и тот факт, что все известные полиморфные варианты гемоглобина (HbS, С, D, Е и талассемии) встречаются почти исключительно в тропической и субтропической зонах. Вот почему предположение о дрейфе генов никогда всерьез не принималось в расчет при объяснении распределения этих генов. Различная скорость мутирования. Эта гипотеза рассматривалась серьезно [1836]. Для вычисления частоты возникновения мутаций HbS был использован косвенный метод Холдейна (разд. 5.1.3). Согласно этому методу, сначала определяется число мутантных генов у пораженных неразмножающихся гомозигот, которые в каждом поколении элиминируются из популяции. Если считать, что между мутационным процессом и отбором существует генетическое равновесие, то частота возникновения мутаций HbS приблизительно равна частоте элиминации этих мутаций из популяции. Подсчитанная таким образом «скорость мутирования» в некоторых популяциях оказалась равной 10–2 (1:100). Эта величина настолько высока, что представляется маловероятной. Гипотеза о необыкновенно высокой частоте возникновения мутаций серповидноклеточности действительно вскоре была отвергнута [1805]. Из 530 матерей, каждая из которых имела по крайней мере одного ребенка, страдающего серповидноклеточной анемией, 525 обладали признаком серповидноклеточности (т. е. имели серповидные эритроциты), и, следовательно, считались гетерозиготами. Из 485 отцов этот признак обнаружен у 445. В подобных исследованиях следует рассматривать только данные по матерям, если путем анализа по многим генетическим маркерам не было показано, что их «официальные» отцы действительно являются биологическими отцами. Однако даже те пять матерей, которые не имели серповидных эритроцитов, все-таки не были носителями вновь возникшей мутации: вероятно, они были носителями β-талассемии и их дети страдали серповидноклеточной β-талассемией, клинические проявления которой очень сходны с серповидноклеточной анемией. В любом случае максимальная вероятная скорость мутирования далеко не так высока, чтобы на ее основе можно было объяснить высокую частоту гена в популяции. Все имеющиеся данные свидетельствуют об очень низкой скорости мутирования, обусловленной одиночными замещениями нуклеотидов ДНК (разд. 5.1.4): возможно, в пределах 10–8 — 10–9. Отсюда, учитывая малочисленность популяций в прежние века, можно предположить, что в конечном счете все гены серповидноклеточности произошли от очень небольшого числа мутаций или только от одной мутации. Недавно этот вывод был подтвержден при исследовании сцепления 11 вариантов полиморфизма ДНК у негров США и Ямайки. Было обнаружено четыре кластера гаплотипов, ни один из которых не мог быть получен из остальных в результате менее чем двух кроссинговеров. Это указывает на наличие 4 или даже менее мутационных событий, если считать, что произошли два кроссинговера или две генные конверсии (разд. 2.3.4). Соответствующие гаплотипы по генам серповидноклеточности были найдены в средиземноморских популяциях, и, стало быть, гены серповидноклеточности в популяциях Средиземноморья возникли не в результате отдельной мутации, а были внесены африканскими неграми [1721]. Принимая во внимание очень низкие значения оценок скорости мутирования (разд. 5.1), мы считаем весьма вероятным предположение о том, что все аллели HbS произошли от одной мутации и что теперешнее 6. Популяционная генетика 31 3 присутствие этого аллеля в четырех гаплотипах объясняется очень редкими рекомбинационными событиями или генной конверсией (см. разд. 2.3 и 4.3). Такие же рассуждения применимы и в случае НbЕ. Почему же все-таки столь высока частота этих генов в популяциях? Вероятно, они должны иметь селективное преимущество. Гипотеза о малярии. Исследование географического распространения этих генов и их всесторонний анализ показали следующее. 1. Их селективное преимущество, вероятно, ограничивается тропическими и субтропическими регионами. 2. Гомозиготные по ним индивиды страдают тяжелой гемолитической анемией. Репродуктивная способность гомозигот составляет приблизительно 20-25% от нормальной; в примитивных условиях жизни она приближается к нулю. В Центральной Африке вплоть до последнего двадцатилетия ген серповидноклеточности вообще не встречался, поскольку пораженные анемией дети умирали в раннем возрасте. Высокая частота HbS может быть достигнута только благодаря селективному преимуществу гетерозигот, которые встречаются гораздо чаще, чем гомозиготы. На основе этих двух фактов была высказана гипотеза о том, что гетерозиготы по HbS менее подвержены тропической малярии, чем гомозиготы по нормальному аллелю. Бит [1724; 1725] показал, что в районе Бейловейла и в других областях Северной Родезии в течение сухого сезона, когда заболеваемость малярией вообще низка, в мазках крови детей, гетерозиготных по гену серповидноклеточности, малярийные паразиты встречаются реже, чем у нормальных гомозигот. Эта разница была статистически недостоверна, однако спленомегалия у гетерозигот также была менее выраженной. Вероятно, Бит первым высказал предположение, что основным селективным фактором в данном случае является малярия. В 1951 г. Ламбот-Легран (Заир) предположил, что церебральная малярия реже поражает гетерозигот по серповидноклеточной анемии. Отмечая сходное географическое распространение талассемии и малярии, Холдейн [1778] предположил, что талассемия поддерживается в популяции благодаря селективному преимуществу гетерозигот в присутствии малярии. Эта гипотеза была проверена для гена серповидноклеточности Аллисоном, сформулировавшим ее следующим образом: 1. Состояние гомозиготности по гену серповидноклеточной анемии фактически является в Африке летальным... Скорость элиминации этого гена не может компенсироваться вновь возникающими мутациями. 2. Сбалансированный полиморфизм поддерживается в результате преимущества гетерозигот по гену серповидноклеточности, возникающе му в основном благодаря их устойчивости к тропической малярии. 3. Селективное действие малярии осуществляется в основном путем дифференциальной выживаемости лиц, имеющих и не имеющих ген серповидноклеточности, в промежутке времени между рождением и репродуктивным возрастом и в гораздо меньшей степени путем дифференциальной плодовитости. 4. Высокая частота гена серповидноклеточности отмечается только в тех районах, где малярия является (или была до недавнего времени) эндемичным заболеванием. 5. В большинстве негритянских популяций Нового Света, частота гена серповидноклеточности ниже, чем ожидается на основе «разбавления» африканского генного пула примесью генов белой расы. Возможно, что это результат элиминации гена серповидноклеточности, происходящей при отсутствии уравновешивающего преимущетсва гетерозигот. 6. В районах, где оба гена, кодирующие аномальные формы гемоглобина, присутствуют одновременно и взаимодействуют таким образом, что обладание ими селективно невыгодно для их носителя, эти гены имеют тенденцию к исключению из популяции. Перейдем к обсуждению данных, подтверждающих первые четыре пункта «гипотезы о малярии». Пункты 5 и 6 мы проанализируем в последующих разделах. Аргументы в пользу «гипотезы о малярии». Этот пример иллюстрирует методологию проверки гипотезы о естественном отборе применительно к человеку. Соответствующие данные можно разделить на две категории: 1) результаты проверки предположения относительно селек- 314 6. Популяционная генетика тивного преимущества; 2) результаты анализа репродуктивных процессов и частот генов в популяции с точки зрения данной гипотезы. 1. Гипотеза предсказывает, что дети раннего возраста (в течение первых пяти лет жизни), не имеющие признака серповидноклеточности, должны сильнее инфицироваться, тяжелее болеть и чаще умирать от тропической малярии, чем дети, гетерозиготные по серповидноклеточности. Гипотеза не предполагает, что дети школьного возраста и взрослые чаще заражаются малярией или болеют ею более тяжело. В гиперэндемичных районах иммунизация вследствие частых заболеваний малярией возникает уже в раннем возрасте, поэтому различий в уровне смертности между гетерозиготами по серповидноклеточности и нормальными гомозиготами не наблюдается. В таблице 6.10 приведена частота заражения малярийным плазмодием (Plasmodium falciparum) для лиц, обладающих и не обладающих признаком серповидноклеточности. Статистическая обработка данных проведена методом Вулфа (разд. 3.7.2); средняя взвешенная относительная частота показывает, что риск тяжело заболеть у детей без серповидноклеточности (нормальных гомозигот) в 2,17 раза выше, чем для гетерозигот. В таблице представлены только случаи тяжелой формы заболевания (более 1000 паразитов в 1 мкл крови). Однако различия в приспособленности в результате заболевания малярией возникнут, только если большой процент пораженных нормальных гомозигот погибнет или если болезнь повлияет на их репродуктивную способность. В табл. 6.11 содержатся сведения о количестве фатальных исходов среди нормальных и гетерозиготных по HbS детей в некоторых районах Африки. За одним исключе-
6. Популяционная генетика 315
нием, от малярии гибли только нормальные гомозиготы. Учитывая, что частота серповидноклеточности в этих популяциях составляет 8-29%, эти результаты не могут быть случайными. Таким образом, можно сделать вывод, что нормальные гомозиготы имеют более высокую восприимчивость к малярии в раннем детстве и, следовательно, более высокую смертность по сравнению с гетерозиготами. Менее убедительны результаты исследований, в ходе которых добровольцев - носителей признака серповидноклеточности – заражали малярийным плазмодием. В одной из работ [1715] показано, что гетерозиготы по серповидноклеточности после экспериментального заражения малярией имели меньшую частоту носительства паразита по сравнению с контрольными индивидами, однако в других исследованиях этот результат не подтвердился. 2. В другой серии работ был проведен анализ популяционных последствий повышенной восприимчивости к малярии: а) высокая смертность среди детей, не имеющих признака серповидноклеточности, должна приводить к повышению частоты серповидноклеточности у взрослых по сравнению с детьми из той же популяции (табл. 6.12); б) высокая смертность среди лиц с нормальными эритроцитами, кроме того, должна привести к тому, что число выживших детей будет больше в браках, где происходит выщепление гетерозигот по серповидноклеточности. В табл. 6.13 приведены результаты подробного исследования по дан-
316 6. Популяционная генетика
ному вопросу [1790, 1718]. Детская смертность оказалась самой высокой среди потомков двух гетерозигот. Это неудивительно, поскольку в таких браках четверть детей должна быть гомозиготной по гену серповидноклеточности и, следовательно, страдать серповидноклеточной анемией. Однако браки между гетерозиготами и нормальными гомозиготами (AS x АА) были относительно фертильными и в то же время в них было самое низкое число умерших детей. Такие результаты ожидаются в том случае, когда риск смерти в раннем возрасте ниже для гетерозигот. Используя разницу между наблюдаемыми частотами генотипов АА, AS и SS во взрослом населении района Мусома и соответствующими частотами, ожидаемыми на основании закона Харди—Вайнберга, Аллисон [1718] вычислил относительную приспособленность разных генотипов w AA = = 0,7961; wAS = 1,000; wss = 0,1698, что соответствует s 1(отбор против АА) = 0,2039; s 2(отбор против SS) = 0,8302. Достаточно ли такое соотношение между коэффициентами отбора, чтобы поддерживать генетическое равновесие, соответствующее реально наблюдаемым частотам гена серповидноклеточности? Чтобы проверить это, вернемся к уравнению 6.6, определяющему условия равновесия:
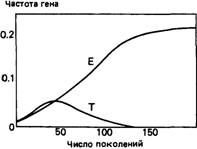
Генная частота такого порядка, соответствующая частоте гетерозигот, равной 31,7%, была действительно продемонстрирована для некоторых популяций. Таким образом, эти данные приблизительно соответствуют предсказаниям гипотезы сбалансированного полиморфизма. Через сколько поколений установится такое равновесие, если отбор начался заново? На рис. 6.18 представлены результаты, полученные методом математического моделирования 40 поколений. Если предположить, что продолжительность поколения равна 25 годам, то 40 поколений соответствуют тысяче лет. Поскольку тысячелетие - не такой уж долгий срок, модель является реалистичной и с этой точки зрения. Некоторые данные указывают на
6. Популяционная генетика 317 дополнительную потерю плодовитости, обусловленную плацентарной малярией у зараженных плазмодием нормальных женщин [1758]. Однако эти данные не вполне убедительны. Некоторые другие аспекты «гипотезы о малярии» [1829, 1830]. В последнее время «гипотеза о малярии» исследовалась с различных точек зрения. 1. Показано [1814], что в эндемичных районах, где малярия повсеместно распространена, приблизительно 15% детской смертности связаны с ней. Если учесть, что детская смертность достигает здесь ≈ 50%, такой уровень смертности является достаточным для того, чтобы любой ген, обеспечивающий хотя бы частичную защиту от малярии, имел селективное преимущество. 2. Малярия - древняя болезнь; вероятно, в Средиземноморье она возникла по крайней мере 2000 лет (80 поколений) назад. В некоторых областях Африки малярия, вероятно, появилась позднее; возможно, в результате применения подсечно-огневого земледелия [1812], которое способствовало размножению комаров в лужах с нагретой солнцем водой. Малярия и, следовательно, отбор в пользу гена серповидноклеточности зависят от экологических условий. Что будет, если преимущество гетерозигот исчезнет? Гетерозиготы по серповидноклеточности имеют преимущество только в случае высокой детской смертности от малярии; при ликвидации малярии оно исчезает. Несомненно, во многих случаях заболеваемость малярией стала значительно ниже того уровня, на котором она была 20-30 лет назад, хотя в некоторых областях эта болезнь появляется вновь. Это означает, что в настоящее время преимущество гетерозигот по серповидноклеточности невелико или вообще отсутствует. Последствия этого для частоты гена серповидноклеточности очевидны. Отбор против гена серповидноклеточности должен привести к постепенному понижению его частоты при условии, что отбор против аномальных гомозигот (больных серповидноклеточной анемией) продолжается. Скорость уменьшения частоты можно рассчитать с помощью формул, использованных при рассмотрении отбора, полностью элиминирующего гомозиготы. Поскольку большинство популяций негров Нового Света в течение нескольких поколений обитали в свободной от малярии среде, частота гена серповидноклеточности в них ниже, чем ожидается в результате притока генов белой расы (разд. 6.3.4). Ожидаемое уменьшение частоты гена серповидноклеточности наблюдалось у негритянского населения Курасао, где малярия отсутствует, тогда как в негритянском населении Суринама частота выше. Обе эти группы имеют сходное африканское происхождение [1797]. Малярией страдает только население Суринама, эта болезнь там сохранилась до настоящего времени. Сходные результаты были получены при изучении популяции североамериканских индейцев штата Джорджия, где для нескольких генетических маркеров оценили приток генов белой расы (см. разд. 6.3.4). Оказалось, что признак HbS даег гораздо более высокое значение оценки притока генов белой расы, чем другие маркеры. Эти результаты можно обяснить отбором против гетерозигот по HbS в отсутствие малярии [1729; 1797; 1884]. Популяционная генетика вариантов G6PD и тропическая малярия [1829; 1830]. До сих пор мы обсуждали только признак серповидноклеточности (HbS). Однако в тропических и субтропических областях распространены и другие генетические варианты эритроцитов. В качестве примера можно привести НbС в западной Африке, HbD в некоторых областях Индии, НbО в Аравии, НbЕ в Юго-Восточной Азии, различные типы α- и β-талассемии и некоторые варианты фермента глюкозо-6-фосфат—дегидрогеназы (G6PD). Весьма вероятно, что и для этих признаков малярия является селективным фактором. Однако полученные на этот счет данные далеко не так убедительны, как в случае серповидноклеточности. Здесь мы не можем обсуждать их подробное и ограничимся рассмотрением вариантов G6PD, талассемии и НbЕ. Вскоре после открытия недостаточности по G6PD обнаружилось, что она наблюдается в основном в популяциях, происхо- 318 6. Популяционная генетика дящих из тропических и субстропических регионов. Географическое распределение этого признака сходно с распределением малярии и предполагает, что, так же как и в случае серповидноклеточности, он определяется отбором вследствие малярии. Для развития малярии необходим глутатион (GSH). Поскольку его уровень при дефиците G6PD снижен, развитие малярии в этом случае может быть затруднено. Уменьшение уровня паразитирования связано с более низкой смертностью. Микрогеографическое картирование частот G6PD в областях высокой и низкой эндемичности тропической малярии показало, что высокая частота этого гена обнаруживается в районах с высокой частотой малярии, а низкая - там, где малярии нет или ее уровень невысок. Особенно убедительными были данные, полученные для населения Сардинии: в этой области частота G6PD была высокой на равнинах, где малярия эндемична, и низкой в холмистой местности, где малярия отсутствует. В отношении других генетических маркеров население равнин и холмов оказалось сходным. Убедительным свидетельством в пользу наличия отбора являются данные о том, что различные варианты G6PD (такие как А–, «средиземноморский» или «азиатские» типы) достигают высоких частот в разных областях земного шара. Положительная корреляция между частотой гена серповидноклеточности и G6PD А n показана для населения стран Африки, а между частотой β-талассемии и «средиземноморским» типом О6РD-для населения Сардинии. Другими словами, оба признака на данной территории обнаруживали высокую или низкую частоту в зависимости от наличия там прежде малярии. Поскольку недостаточность по G6PD сцеплена с полом, a HbS и β-талассемия - аутосомные признаки, эти корреляции не могут объясняться ничем, кроме отбора. Динамика отбора по признаку, сцепленному с Х-хромосомой, сложна, поскольку мужчины относятся к двум генотипическим классам (нормальному и мутантному), а женщины - к трем (нормальному, гомозиготному и гетерозиготному). Различные данные и теоретические расчеты свидетельствуют о том, что в этой системе женщины защищены лучшим образом и имеют большее селективное преимущество. Гетерозиготные женщины имеют эритроциты двух типов: с мутантной G6PD и нормальные (разд. 2.2.3.3). Показано, что в эритроцитах с мутантным ферментом присутствует меньшее количество малярийных плазмодиев, нежели в нормальных. Эти данные - прямое доказательство защитного свойства клеток с недостаточностью G6PD по отношению к тропической малярии. Изучение развития малярийного паразита в эритроцитах in vitro [1766; 1816; 1821; 1847]. Разработка методов культивирования малярийного плазмодия в эритроцитах дала возможность непосредственно изучать способность генетически дефектных клеток поддерживать развитие возбудителя малярии. Заметим, однако, что метод этот весьма трудоемкий и не всегда дает ясные результаты. Показано, что эритроциты особей, гетерозиготных по серповидноклеточности, в условиях гипоксии являются плохой средой для пролиферации малярийного паразита [1847]. Инвазия таких клеток также несколько снижена. Эритроциты мужчин с недостаточностью G6PD африканского или средиземноморского типа хуже поддерживают рост Plasmodium falciparum, чем нормальные клетки [1859; 1860], хотя некоторые исследователи не нашли между ними разницы [см. 1845]. Впрочем, по общему мнению, способность малярийного плазмодия размножаться в эритроцитах гетерозиготных по G6PD женщин прямо зависит от числа клеток, дефектных по G6PD [1860]. При изучении окрашенных препаратов было показано, что малярийные плазмодии реже встречаются у гетерозигот по G6PD, эритроциты которых представляют собой смесь дефектных и нормальных клеток [1823]. Вероятно, малярийный плазмодий развивается у гетерозигот по НbС и НbЕ так же, как и в нормальных клетках; данные относительно гомозигот НbЕЕ и НbСС противоречивы. В большинстве исследований не было показано разницы в пролиферации между нормальными клетками и клетками с Р-таллассемией [1861]. При α-талассемии только в случае болезни НbН, т. е. при отсутствии трех генов α(α –/– –), показано определенное уменьшение роста [1793]. В случае двух аномальных генов а данные менее убедительны, а в случае одной делеции Hbα (α-that 2) наблюдается нормальный рост. Вероятно, HbF ингибирует пролиферацию Р. falciparum [1847a]. Однако многие болезни, для 6. Популяционная генетика 319
которых характерно наследование фетального гемоглобина с его высоким уровнем у гетерозигот, не встречаются с той частотой, которую можно предположить исходя из результатов исследований in vitro. Овалоциты устойчивы к внедрению малярийного плазмодия in vitro; овалоцитоз распространен в некоторых областях Новой Гвинеи и Папуа [1799]. Эритроциты людей с группой крови En (а —) устойчивы к инвазии малярийного плазмодия in vitro [1846], но эта группа крови ни в одной популяции не достигает полиморфных частот. Многие исследования, проведенные in vitro, показали, что обнаружить разницу в способности малярийного плазмодия размножаться в каких-то клетках можно лишь в том случае, когда эта разница ощутима, как у гетерозигот по HbS. Наблюдаемые различия в пролиферации малярийного плазмодия у довольно редко встречающихся гомозигот по вариантам НbС и НbЕ не влияют на распространение этих генов в популяциях, однако подтверждают, что в лабораторных исследованиях выявляются только значительные генетические различия. Если различия несущественны, как в случае гетерозигот по НbЕ и НbС, этот метод может оказаться не настолько чувствительным, чтобы выявить их. В любом случае результаты, полученные in vitro, недостаточно убедительны и не могут ни доказать, ни опровергнуть «гипотезу о малярии». Выявление и измерение интенсивности отбора у человека. В этом разделе кратко излагаются некоторые экспериментальные методы, с помощью которых можно продемонстрировать и измерить интенсивность отбора у человека. Большинство этих подходов использовано для проверки «гипотезы о малярии» [1830]. 1. Между распространением заболевания, которое можно рассматривать как коллективный фактор, и геном, повышающим устойчивость к этому заболеванию, существует очевидная географическая корреляция. 2. Заболеваемость тяжелыми формами малярии и, следовательно, смертность снижены у гетерозигот по «защитному» гену по сравнению с нормальными гомозиготами. 3. Плодовитость гетерозигот A/S может быть выше, чем плодовитость нормальных гомозигот [1829; 1830]. 4. Дифференциальная смертность должна приводить к возрастной стратификации популяции. Если заболевание селективно повышает смертность детей раннего возраста, относительная частота «защитного» гена увеличивается с возрастом. Наиболее очевидный способ измерения отбора в раннем возрасте это сравнение частот генов у детей и во взрослой части популяции; в качестве дополнения можно провести сравнение эффективной плодовитости в семьях (табл.чб.11-6.13). Такой подход может быть успешным, если интенсивность отбора высока, как, например, в случае серповидноклеточности. Однако в популяциях человека ожидаемая интенсивность отбора, как правило, гораздо ниже. При рецессивном заболевании со 100%-ным отбором против гомозигот по соответствующему гену и 3%-ной селективной невыгодности нормальных гомозигот, равновесная частота (уравнение 6.6) не зависит от частоты гена и равна
Отсюда получаем, что частота гомозигот немного ниже 1:1000, что превышает частоту кистозного фиброза у населения Западной Европы. Для поддержания равновесия по более редким рецессивным генам селективная невыгодность нормальных гомозигот (s 1 ) должна быть гораздо ниже, чем у гетерозигот (табл. 6.14). Для определения селективной невыгодности такого порядка (0,5-3,0%) необходима выборка огромного размера. Если более редкий аллель встречается с достаточно высокой частотой, т.е. существует генетический полиморфизм, коэффициент отбора против нор-
320 6. Популяционная генетика
мальной гомозиготы будет выше и необходимый для его определения размер выборки становится более приемлемым. Большая часть работ по отбору была выполнена на полиморфных системах, таких как группы крови. Однако полученные результаты оказались неоднозначными [211]. Это неудивительно, поскольку наблюдаемые в настоящее время частоты генов либо отражают процессы отбора, происходившие в прошлом, либо вообще не являются результатом отбора. Детская смертность как таковая резко упала. Если исследования, результаты которых приведены в табл. 6.11-6.14, повторить в настоящее время в свободных от малярии районах, дифференциальную детскую смертность и различия в числе выживших детей вряд ли удастся продемонстрировать. Таким образом, изучение дифференциальной плодовитости и смертности в популяциях человека с целью оценки давления отбора может быть неосуществимо по чисто практическим причинам. Использование современных данных для определения интенсивности отбора, происходившего в прошлом, когда преобладали совершенно другие условия окружающей среды, часто приводит к искаженным результатам. 5. Трудности такого рода характерны для большинства современных исследований, посвященных отбору. Их можно избежать, если прямо анализировать предполагаемый механизм отбора. Для этого необходимо сформулировать конкретную гипотезу относительно механизма отбора. В случае «гипотезы о малярии» это не слишком трудно. Географическое распределение гена серповидноклеточности обнаружило большое сходство с распределением тропической малярии; кроме того, известно, что малярийный плазмодий внедряется именно в эритроциты. Вообще формулировка такой причинно-следственной гипотезы предполагает знание физиологической функции соответствующего гена. При наличии обоснованной гипотезы о механизме отбора задача проверки на отбор становится гораздо проще. Высказывалось даже мнение, что ни один случай сбалансированного полиморфизма ни у одного вида не был открыт без знания биологического механизма отбора или по крайней мере существования гипотезы относительно этого механизма (Б. Кларк, личное сообщение). 6.2.1.7. Естественный отбор и история популяций: НbЕ и β-талассемия 1) Часто обсуждается вопрос о том, как использовать генетические данные (например, по частотам полиморфных генов) для получения выводов относительно истории популяций и сходства между ними. Рассматриваемый ниже пример показывает, как для решения этого вопроса можно сочетать различные методы популяционного анализа с лингвистическими и историческими данными. Кроме того, этот пример демонстрирует важность моделирования на ЭВМ для популяционно-генетических исследований. Взаимодействие в популяции двух генов, кодирующих аномальные формы гемоглобина. Аллисон высказал предположение, что в областях, где одновременно присутствуют два гена, кодирующие аномальные формы гемоглобина и взаимодействующие таким образом, что против носителей соответствующих аллелей обоих локусов действует отбор, будет наблюдаться тенденция к взаимному исключению этих генов. В качестве иллюстрации этой проблемы рассмотрим взаимодействие генов, кодирующих НbЕ и талассемию, в популяциях Юго-Восточной Азии [1760]. Гомозиготность по талассемии была описана в разд. 4.3. Гомозиготность по НbЕ вызывает гемолитическую анемию, протекающую в гораздо более легкой форме, чем анемия, возникающая у гомозигот по HbS. Для большой β-талассемии (анемии Кули) характерны тяжелый гемолиз и пониженный синтез гемоглобина. Большинство двойных гетерозигот по β-талассемии и НbЕ (болезнь талассемия—НbЕ) страдают выраженной хронической анемией, приближающейся по тяжести протекания к анемии Кули. Гены, кодирующие варианты Нb β-цепи, такие как НbЕ и β-талассемия, сцеплены так тесно (разд. 4.3.4) в транс -положении, что их можно рассматривать как аллели. Распространение НbЕ и β -талассемии. Максимальная частота НbЕ в Юго-Восточной Азии
1) Для понимания последующих рассуждений данный раздел не обязателен. 6. Популяционная генетика 321
зарегистрирована среди кхмероязычного населения Северной Кампучии и прилежащих к ней районов северо-восточного Таиланда; здесь частота этого гена может достигать 0,3, что соответствует частоте гетерозигот 42%-одной из самых высоких частот, когда-либо достигнутых по гемоглобинопатии. В других областях Таиланда, на Малайском полуострове и в Индонезии, эта частота гораздо ниже. НbЕ встречается также в Китае, Ассаме и Бенгалии (рис. 6.19). Общее число носителей данного гена, возможно, составляет около 20 млн. Аллели β-талассемии встречаются в этих же областях, однако они распространены гораздо шире. НbЕ и малярия. После выявления ассоциации между HbS и тропической малярией поддержание полиморфизма по другим формам гемоглобина было логично объяснить сходным образом. Попытка проверить эту гипотезу прямо не увенчалась успехом. В популяциях, которые необходимо было для этого изучить, отсутствовало медицинское наблюдение. Проблема осложнялась и тем, что в этих популяциях отсутствовали другие защитные генетические механизмы, например талассемия и дефицит G6PD. Тем не менее было высказано предположение о защитном действии аллеля НbЕ у гетерозигот и гомозигот. При сравнении географического распространения НbЕ и малярии надо иметь в виду, что на территории материковой Юго-Восточной Азии основным переносчиком этой болезни является лесной комар Anopheles minimus, обитающий в холмистых и горных местностях. Поэтому распределение малярии в этом регионе противоположно ее распределению в странах Средиземноморья, где важнейшие переносчики - комары, размножающиеся в болотах и засоленных водоемах. В Юго-Восточной Азии малярия-болезнь холмов и лесов. Действительно, именно в этих областях частота НbЕ наиболее высока [1762]. Приспособленность генотипов НЬЕ и талассемии: проблема генетического равновесия. Каковы условия изменения генных частот в такой системе из трех аллелей (HbPA, HbβE, HbβT)? Для ответа на этот вопрос необходимо оценить величину приспособленности (т. е. селективное преимущество или невыгодность) генотипов. Исходя из генных частот в ядерной кхмерской группе и клинических проявлений анемии у гомозигот по НbЕ, были получены следующие значения приспособленности:
322 6. Популяционная генетика
где w - приспособленность генотипа относительно средней приспособленности популяции, asкоэффициент отбора (по определению s = 1 — w). При селективной благоприятности генотипа, как в случае.sAE, величина.s будет отрицательной. Гены, определяющие Hbβ A-, Нbβ Е- и Нb β-талассемию, для простоты обозначены буквами А, Е и Т. Возможно ли в таких условиях генетическое равновесие? В отличие от случая двух аллелей, описываемого уравнением (6.6), селективное преимущество гетерозигот в трехаллельной системе не обязательно приводит к возникновению стабильного генетического равновесия. Для поддержания стабильного равновесия необходимо выполнение следующих четырех условий:
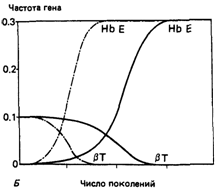
Вывод этих формул, который мы здесь не приводим, получен Пенроузом (Penrose et al., [1848]). На основании данных по приспособленности трех генотипов можно сделать следующие выводы: условие 1, селективная невыгодность гомозигот, в рассматриваемой системе удовлетворяется; условия 2 и 3 могут удовлетворяться при определенном, достаточно вероятном сочетании данных; с другой стороны, условие 4 (т. е. то, что произведение селективных ценностей двух гомозигот должно превышать квадрат селективной ценности двойной гетерозиготы) выполняется только при очень маловероятных сочетаниях коэффициентов отбора. Интенсивность отбора против двойной гетерозиготы по сравнению с гомозиготой Е/Е, вероятно, слишком высока для того, чтобы установилось равновесие, тем более стабильное. Этот вывод в большой степени не зависит от величины преимущества гетерозигот, значение которого может варьировать в зависимости от уровня контакта с малярией и основан на проявлениях заболевания, связанных с генотипами HbβE/E, HbβE/Т, НbβТ/T. Однако приспособленность этих двух гомозигот и двойной гетерозиготы очень мало зависит от условий среды. Каковы будут распределения частот генов Нb β Е и Нb β Т (q Eи q T ) в различных группах популяций при стабильном или полустабильном равновесии по сравнению со случаями нестабильного равновесия или отсутствия равновесия? При стабильном равновесии точки распределения, соотетствующие паре значений q E, q Tв двумерной системе координат, группируются вокруг некоторой точки равновесия. Если равновесие полустабильное, кластеризация точек уменьшается; после нарушения равновесия точки распределения не обязательно возвращаются к той же точке равновесия, что и раньше, а, как показал Пенроуз [1848], могут вернуться к некоторой точке, лежащей на прямой линии, связывающей независимые точки равновесия Нb β Е и Hb β T (когда присутствует только один аллель). Реально полученное распределение [1760] указывает на отсутствие в системе стабильного или полустабильного равновесия. Это означает, что при совместном существовании в популяции аллелей Hb β E и Hb β T их частоты обнаруживают тенденцию к падению ниже точки равновесия. Причиной этого реципрокного эффекта является сильное давление отбора против двойной гетерозиготы. Динамика Hb β E и Hb β T в популяциях. Если популяция не находится в состоянии равновесия, с какой скоростью и в каком направлении будут изменяться частоты генов? Или - если взглянуть на этот вопрос с точки зрения истории популяции - каким образом было достигнуто наблюдаемое в настоящее время распределение генных частот? В предыдущих разделах для некоторых частных случаев выведены формулы, описывающие изменения генных частот от поколения к поколению (Δ q). Сходным образом можно получить выражения для изменения генных частот в поколениях в трехаллельной системе. Таким образом удается проанализировать скорость изменения генных частот при различных интенсивностях отбора. В прежнее время, когда еще не было вычислительной техники, эту задачу нельзя было решить из-за огромного объема числовых расчетов, теперь она решается легко. Некоторые примеры приведены на рис. 6.20-6.23. На рис. 6.20 показана ситуация, когда аллель Е вводится в популяцию, где с высокой частотой присутствует аллель Т. Обе гетерозиготы А/Е и А/Т обладают высоким селективным преимуществом: аллель Е вытесняет аллель Т. Если селективное преимущество гетерозигот А/Е ниже, то существует некоторая его критическая величина, ниже которой аллель Е уже не может вытеснить аллель Т. Даже в том случае, когда это вытеснение происходит, его скорость сильно зависит от начальной частоты аллеля Е. Если значения приспособленности те же, а начальная частота аллеля Е высока, аллель Т не вытесняет аллель Е (рис. 6.21). Если приспособленность гетерозигот А/Е намного ниже, чем гетерозигот А/Т, Т может вытеснить Е (рис. 6.22). Если начальные частоты обоих аллелей А и 6. Популяционная генетика 323
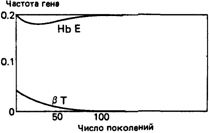
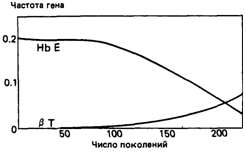
Т низки (т. е. оба они вновь вводятся в популяцию), вполне вероятно, что Е вытеснит Т, даже если селективное преимущество по отношению к гомозиготам А/А имеют только гетерозиготы АД, а не гетерозиготы А/Е (рис. 6.23). Релаксация отбора. Возможно, что в будущем малярия в Юго-Восточной Азии будет искоренена. Тогда селективное преимущество гетерозигот АД и А/Е исчезнет, но отбор против гомозигот Е/Е и ТД и гетерозигот ЕД сохранится. Каковы будут последствия этого для аллелей Е и Т? Две подобные ситуации показаны на рис. 6.24. В первом случае частота Т очень низка (как 324 6. Популяционная генетика
в северо-восточном Таиланде), во втором частоты Е и Т более сходны (как в центральном Таиланде). В обоих случаях наблюдается довольно быстрое - особенно в начале процесса - уменьшение частоты обоих аллелей. Падение частоты аллеля Е достигает такого порядка величины, что его можно выявить при сравнении выборок достаточного размера из двух разных популяций. Приложение этих результатов к истории популяций Юго-Восточной Азии. Генные частоты, наблюдаемые в популяциях в настоящее время, являются результатом не только давления отбора, но и демографических процессов в популяциях. Говоря конкретнее, если в двух разных популяциях адаптация к условиям внешней среды произошла различным образом (например, в одной популяции адаптация к малярии была достигнута за счет НbβЕ, а в другой - за счет талассемии) и если эти механизмы являются в какой-то степени взаимоисключающими, то сравнение генных частот и известных фактов истории этих популяций может пролить свет на их генетические взаимоотношения. Данных о неолитической культуре Юго-Восточной Азии имеется немного. Можно выделить три стадии общественного развития. Каждой из них соответствовала определенная экологическая ситуация. 1. Группы охотников и собирателей. Судя по существующим в настоящее время популяциям, находящимся на приблизительно такой же ступени развития, они обитали в лесах, расположенных на склонах холмов и гор. Если предположить, что распространение малярии в то время было сходно с теперешним, группы охотников и собирателей должны были испытывать ее интенсивное воздействие. Несмотря на это, условия распространения для гена, имеющего преимущество в гетерозиготном состоянии, были неблагоприятными из-за маленького эффективного репродуктивного размера популяций и низкой вероятности генного обмена между ними; в большинстве случаев даже благоприятные мутации в конечном счете элиминировались из популяции (разд. 6.4). 2. Приблизительно в 1000 г. н. э. с началом культивирования риса на орошаемых землях возникла социальная организация на уровне деревень. Большая часть поселений располагалась по периферии долин. При подобной социальной организации условия распространения гена, который поддерживался в популяции благодаря его защитным свойствам против малярии, были очень благоприятными. Период времени продолжительностью 3000 лет (или 120 поколений, если принять продолжительность поколения за 25 лет) достаточен для того, чтобы гены Hb β Т и Hb β E достигли частот, наблюдаемых в настоящее время (см. рис. 6.24). 3. В настоящее время большая часть населения стран Юго-Восточной Азии обитает в бассейнах и дельтах больших рек, которые в доисторические времена почти не были заселены. Социальные и политические события исторического времени привели к развитию равнинного земледелия. Между тем благодаря экологическим особенностям своего переносчика Anopheles minimus малярия в этой области редко встречается в равнинной местности. Следовательно, миграция населения на сравнительно свободные от малярии равнинные территории должна привести к значительному ослаблению отбора против гомозигот Hb β А и уменьшению селективного преимущества гетерозигот Hb β Е и Hb β Т. Действительно, гены HbβE и HbβT реже встре- 6. Популяционная генетика 325 чаются у населения равнин, нежели у жителей соседних гористых территорий. Сравнение с Hb β S Западной Африки. В Западной Африке основными переносчиками малярии являются комары, требующие для своего размножения открытого пространства и стоячих водоемов. Вероятно, ген серповидноклеточности появился в Западной Африке в эпоху неолита одновременно с подсечно-огневым земледелием. Благодаря такому способу ведения сельского хозяйства в этом районе Африки, там появились благоприятные для размножения комаров открытие участки земли, что в свою очередь вызвало распространение гена серповидноклеточности и установление полиморфизма по этому гену. Таким образом, сходные тенденции развития земледелия в двух разных популяциях при различных экологических потребностях переносчиков малярии привело к тому, что на равнинах Африки установился полиморфизм по Hb β С, а на холмах Юго-Восточной Азии – полиморфизм по Hb β Е. Гемоглобин β E в популяциях, принадлежащих к южноазиатской (мон-кхмерскоп) языковой группе. Южноазиатская языковая группа включает в себя кхмерский язык (Кампучия), племенные языки Вьетнама, язык мон в Южной Бирме, западном и северном Таиланде, племенные языки Таиланда, Бирмы и южного Китая и несколько языков Ассама и Бенгалии. Исторические и лингвистические данные свидетельствуют о том, что вся материковая территория Юго-
Восточной Азии, за исключением южной Малайи и некоторых областей Вьетнама, была заселена южноазиатскими народностями вплоть до V или VI в. н. э., когда началась миграция населения в широких масштабах. На рис. 6.25 указаны, во-первых, те области, население которых говорит на южноазиатских языках, и, во-вторых, те области, население которых полиморфно по гену HbβE. Совпадение очевидно; вероятно, оно объясняется параллельным распространением этих языков и гена HbβE. Возможно, что ген, о котором мы говорим, впервые появился в исходной южноазиатской группе, а затем вместе с языками постепенно распространился по материковой части ЮгоВосточной Азии. Моделирование генной динамики указывает на то, что в популяции, где происходило распространение данного гена, могла до этого с высокой частотой присутствовать талассемия, поскольку ген HbβE во многих селективных ситуациях вытесняет ген талассемии. Подтвержденное предположение. Как уже отмечалось, некоторые языки, принадлежащие к южноазиатской группе, встречаются вне материковой части Юго-Восточной Азии. Если рассмотренная нами гипотеза относительно гена HbβE верна, и малярия действительно является тем экологическим фактором, который поддерживает его высокую частоту, тогда популяции, принадлежащие к южноазиатской языковой группе, которые в течение долгого времени занимали зараженные малярией области, вне ЮгоВосточной Азии должны иметь высокую частоту НbβЕ. В Ассаме было проведено сравнение двух групп населения: хази, южноазиатской группы, сохранившей свое этническое своеобразие, и ахом, группы монголоидного происхождения, сравнительно недавно (в XIII в.) иммигрировавшей из Таиланда. Обе группы обитали в областях, где малярия была эндемичным заболеванием. Результаты сравнения приведены в таблице 6.15.Частота НbβЕ очень высока в обеих группах. Для группы хази подтверждается предположение о том, что ген HbβE должен быть очень распространенным в популяции, происходящей от южноазиатской группы и подверженной селективному давлению малярии. Однако иногда ген HbβE может быть внесен в соседнюю популяцию неюжноазиатского происхождения. При его поддержании отбором он может даже достичь в ней относительно высокой частоты, что и наблюдается в группе ахом [1752]. При обсуждении стратегии исследования в популяционной генетике человека мы высказали мнение, что такие исследования более плодот- 326 6. Популяционная генетика
ворны, если они опираются на какую-то гипотезу. Изучение НbЕ в южноазиатских популяциях Ассама служит примером научного поиска, основанного на конкретной популяционной гипотезе. Некоторые выводы, сделанные на основании исследования НbЕ и талассемии. Изучение распространения НbЕ и талассемии среди жителей Юго-Восточной Азии позволило сделать некоторые общие выводы, интерпретирующие межпопуляционные различия генных частот. Они касаются того, каким образом история популяций и естественный отбор определяют эти различия. При сравнении популяций, на которые воздействовал один и тот же естественный экологический фактор отбора (в данном случае малярия), обнаружились явные генетические различия, обусловленные разной историей этих популяций. В одной из них адаптация к экологическому фактору была достигнута благодаря наличию Hb β E, в другой - β-талассемии; показано, что эти системы адаптации являются до некоторой степени взаимоисключающими. Поскольку гомозиготы НbЕ/Е менее подвержены малярии, чем гомозиготы НbТ/Т, адаптация к малярии с использованием HbβE проходит легче и имеет тенденцию к замещению адаптации через р-талассемию. Такие результаты достигаются в течение длительного периода времени, несмотря на противодействующее влияние - частичное взаимоисключение двух этих генов, вызванное сильным давлением отбора против двойной гетерозиготы. Значительные генетические различия выявлены также при сравнении популяций, в разной степени испытывающих воздействие малярии. Hb p E и талассемия с большей частотой обнаруживаются среди жителей холмистых местностей, чем в популяциях, населяющих обширные равнины, где малярия встречается реже. Эти результаты содержат мало информации относительно этнических взаимодействий между популяциями холмов и равнин. Чтобы внести ясность в данный вопрос, необходимо иметь сведения о селективном факторе-в данном случае малярии. В литературе по антропологии и генетике человека часто проводится сравнение различных популяционных групп по генетическим маркерам. Однако критический анализ таких различий с учетом отбора, с одной стороны, и истории популяции, с другой, обычно отсутствует. Исследование полиморфизма по серповидноклеточности в Африке: стохастическая модель замещения одного аллеля другим [126]. В исследованиях подобного рода был проведен комплексный анализ, включающий изучение истории популяций Западной Африки, воздействия на них малярии и частот генов HbβS и НbβС. Наблюдаемая здесь ситуация сходна со случаем HbβE и талассемии в Юго-Восточной Азии: в популяции присутствуют два аллеля Hb β S и Hb β С, обладающие противомалярийными свойствами; значения приспособленности w i различны для гомо- и гетерозигот; против двойных гетерозигот действует сильный отбор. На рис. 6.26 показано изменение генных частот, происходящее при вытеснении аллеля Hb β С аллелем Hb β S; решающим фактором здесь является селективное преимущество гетерозиготы по Hb β S по сравнению с гетерозиготами по Hb β С. Как и в случае Hb β E и талассемии, использована детерминистическая модель отбора. Предполагается, что популяция имеет бесконечно большую величину. С другой стороны, в модели, приведенной на рис. 6.26,Б, эффективный репродуктивный размер популяции (разд. 6.4.1) принят равным 1000, поэтому возникают случайные флуктуации генных частот. Эта модель стохастическая. Общая тенденция здесь та же, что и на рис. 6.26,А, однако ясно видны случайные флуктуации частот. 6. Популяционная генетика 327
Изучение аномальных гемоглобинов у жителей Западной Африки, так же как и в Юго-Восточной Азии, внесло вклад в наши представления об истории популяций. На земном шаре существуют и другие регионы, где можно провести подобные исследования - их население имеет сложную популяционную историю; необходимо только изучить распространение разных вариантов G6PD и гемоглобина. Одним из таких регионов является Индия, особенно ее южные и восточные области. В популяциях Филиппин и Таиланда одновременно, с полиморфными частотами встречаются несколько типов недостаточности по G6PD. В африканских популяциях обнаружены только два основных варианта G6PD (А– и А+). Возможно, что эта ситуация возникла из-за смешения групп, каждая из которых исходно имела только одну мутацию G6PD. Для подробного анализа этого вопроса необходимы дальнейшие исследования вариантов G6PD и истории популяций этой части Азии. Дата добавления: 2015-12-16 | Просмотры: 758 | Нарушение авторских прав |