 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Навчальний матеріал для виконання завданняВикористання природних вод відкритих водоймищ для господарсько-питного водопостачання вимагає попереднього поліпшення властивостей води і її знезараження. В результаті обробки води на водопровідних станціях вона звільняється від зважених часток, запаху, присмаку, мікроорганізмів і різних домішок. Для поліпшення якості води проводять її освітлювання і знебарвлення, коагуляцію, відстоювання, фільтрацію. Спеціальні методи обробки води включають зм'якшування, опріснення, знезалізнення, фторування, знефторювання, дезодорування, дезактивацію, дегазацію. Очищення води здійснюється механічним (відстоювання), фізичним (фільтрування) і хімічним (коагуляція) методами. Відстоювання здійснюється в спеціальних спорудах – відстійниках. Фільтрація – процес повнішого звільнення води від зважених часток шляхом пропускання її через фільтруючий мілкопористий матеріал (пісок). Коагуляція – хімічний метод очищення води від забруднення зваженими частками, що знаходяться у воді, непіддатливих видаленню при відстоюванні і фільтрації. Коагуляція є найбільш ефективним методом очищення води і здійснюється шляхом додавання в неї коагулянтів, спеціальних речовин, що реагують із бікарбонатами кальцію і магнію. У якості коагулянтів широко використовуються сульфат алюмінію, поліакриламід, які при взаємодії з бікарбонатами кальцію і магнію піддаються гідролізу з утворенням пластівців. Пластівці випадають в осад, захоплюючи за собою зважені частки і бактерії. 2.4.1. Знезараження води хлоруванням Для знезараження води застосовують хімічні методи – хлорування, озонування, використання олігодинамічної дії срібла, а також фізичні методи – кип'ятіння, УФ-опромінення, ультразвук і так далі. Знезараження води хлоруванням є найбільш простим і широко поширеним методом. Для цього використовують газоподібний хлор і 1% розчин хлорного вапна (гіпохлорид кальцію та ін.). В основі бактерицидного ефекту лежить здатність впливати на цитоплазму бактерій недисоційованої молекули хлорноватистою кислотою, яка утворюється при введенні у воду з'єднань хлора: Са(ОС1)2 + 2Н2О = СаС12 + Са(ОН)2 + 2НОС1. Певною бактерицидною властивістю володіють ті, що також утворюються при дисоціації хлорноватистої кислоти іони гіпохлорида (ОСl-) і хлора (Сl-). Для знезараження індивідуальних запасів води використовують хлорвмісні пігулки: пантоцид, аквасепт і ін. 2.4.2. Визначення активного хлора в хлорному вапні Дана сполука випускається з вмістом 32-35% активного хлора. При зберіганні під впливом вологи і світла вміст хлора знижується. Для знезараження води допускається використовувати хлорне вапно з вмістом не менше 25% активного хлора, тому необхідно заздалегідь визначити вміст в ньому активного хлора. Хід аналізу. Готують 1% розчин хлорного вапна. Для цього в ступці 1 г хлорного вапна розчиняють після ретельного роздрібнення в невеликій кількості дистильованої води, потім переливають в мірну колбу і доводять до об'єму 100 мл. Ретельно перемішують і залишають розчин на 10 хв. для освітлювання. У колбу наливають 50 мл дистильованої води, 5 мл 1% освітленого розчину хлорного вапна, 5 мл 5% розчину йодиду калія, 1 мл хлористо-водневої кислоти в розведенні 1:3. Перемішують. В результаті реакції між хлором, хлорним вапном і йодидом калія виділяється певна кількість йоду, еквівалентна вмісту хлора. Йод титрують 0,01 н розчином тіосульфата натрію до слабо-жовтого забарвлення, після чого вводять 1 мл 1% розчину крохмалю і титрують до зникнення синього забарвлення. 1 мл 0,01 н розчину тіосульфата натрію зв'язує 1,269 міліграм йоду, що відповідає 0,355 міліграм хлора. Приклад. На титрування пішло 28,9 мл 0,01 н розчину тіосульфата натрію, з урахуванням поправки на титр 0,95 пішло: 28,9 х 0,95 = 27,45 мл. У 5 мл 1% розчину хлорного вапна міститиметься наступна кількість активного хлора: 27,45 х 0,355 = 9,744 міліграм, а в 1 мл – 9,744:5 = 1,94 міліграм. 1 мл 1% розчину містить 0,01 г сухої речовини хлорного вапна. Отже, в даному розчині міститься: 0,01 – 0,00194 100 – х
2.4.3. Визначення дози хлорного вапна для хлорування води Існує декілька способів хлорування води: хлорування нормальними дозами (доза хлору встановлюється по величині хлорпоглинання і санітарній нормі залишкового хлора), методом гіперхлорування, хлоруванням із аммонизацією та ін. Для здійснення надійного знезараження води необхідно правильно вибрати дозу 1% розчину хлорного вапна з урахуванням витрати її на окислення різних органічних і легкоокислюваних речовин, присутніх у воді. Потрібна доза хлора для хлорування нормальними дозами складається з хлорпоглинання (кількості хлора, що йде на окислення органічних речовин, і кількості, що йде на окислення мікробних кліток) і залишкового хлора. Оцінку ефективності хлорування проводять по залишковому вмісту активного хлора, який обов'язково має бути присутнім у воді після 30-хвилинного контакту її з хлором в кількості 0,3-0,5 мг/л. Цю кількість визначають дослідним шляхом У 3 склянки наливають по 200 мл води. У кожну склянку обережно по скляній паличці вводять 2, 4, 6 краплин 1% розчину хлорного вапна. Потім всі ретельно перемішують і залишають на 30 хв. За цей час органічні речовини і мікробні тіла піддаються окисленню. Після цього в кожну склянку доливають 1 мл хлористоводневої кислоти (1:5), 1 мл 5% розчину йодиду калія і 1 мл 1% розчину крохмалю. Суміш розчинів ретельно перемішують. При вмісті залишкового хлора вода забарвлюється в синій колір. Воду в склянках, де мало місце забарвлення, титрують по краплях 0,7% розчином тіосульфата натрію до знебарвлення, перемішуючи її після додавання кожної краплі. Розрахунок дози починають з тієї склянки, де сталося знебарвлення від 2 краплі тіосульфата натрію. Вміст залишкового хлора в цій склянці складає 0,4 мг/л (1 крапля 0,7% розчину тіосульфата натрію зв'язує 0,04 міліграм хлора, що відповідає при перерахунку на 1 л: 0,04 х 5 = 0,2 мг/л). Якщо знебарвлення сталося від 1 краплі, вміст залишкового хлора недостатній – 0,2 мг/л, при знебарвленні від 3 крапель вміст залишкового хлора надлишковий – 0,6 мг/л.
Приклад. З 3 стаканів після додавання крохмалю синє забарвлення сталося в 2-му і 3-му стаканах. Отже, залишкового активного хлора в 1-му стакані немає. Для розрахунку дози виберемо 2-й стакан, на визначення залишкового хлора в якому пішли 2 краплі 0,7% розчину тіосульфата натрію. У даний стакан на 200 мл води було додано 2 краплі 1% розчину хлорного вапна. Таким чином, на 1 л води необхідно додати 2 x 5 = 10 крапель, або 0,4 мл 1% розчину хлорного вапна (1 мл містить 25 крапель).
2.4.4. Визначення залишкового хлора у водопровідній воді У конічну колбу місткістю 500 мл вносять 250 мл водопровідної води (перед відбором проби воду 1-2 хв. спускають), 10 мл буферного розчину з рН 4,6 і 5 мл 10% розчину йодиду калія. Для приготування буферного розчину з рН 4,6 змішують 102 мл 1 М розчину оцтової кислоти (60 г 100% кислоти в 1 л води) і 98 мл 1 М розчину ацетату натрію (136,1 кристалічної солі в 1 л води) і доводять об'єм до 1 л прокип'яченою дистильованою водою. Після цього йод, що виділився, титрують 0,005 н розчином тіосульфата натрію до блідо-жовтого забарвлення. Потім доливають 1 мл 1% розчину крохмалю і титрують розчин до зникнення синього забарвлення. Вміст залишкового хлора у воді (х) розраховують за формулоюі:
де n - кількість 0,005 н розчину тіосульфата натрію, що пішов на титрування, мл; К - поправочний коефіцієнт розчину тіиосульфата натрію; 0,177 - кількість активного хлора, відповідна 1 мл 0,005 н розчину тіосульфата натрію, мг; V - об'єм води, взятої для аналізу, мл.
2.5. Контрольні запитання:
1. Розкажіть про методи контролю ефективності знезараження води на водопровідних станціях. 2. Які існують методи поліпшення якості води? 3. Розкажіть про хімічні методи знезараження води. 4. Розкажіть про фізичні методи знезараження води. 5. Якими методами проводиться очищення води на водопровідних станціях? 6. Які показники вказують на забруднення води органічними речовинами? 7. Які санітарні вимоги пред'являються до благоустрою децентралізованих джерел водопостачання? 8. Розкажіть про санітарно-бактеріологічні показники оцінки якості питної води централізованого водопостачання. 9. Який механізм знезараження води розчинами хлорного вапна? 10. Розкажіть про коагуляцію, фільтрацію, відстоювання води і їх призначення. 11. Які існують способи хлорування води джерел децентралізованого водопостачання? 12. Якими методами визначається активний хлор в хлорному вапні? 13. Як визначити дозу 1% розчину хлорного вапна для хлорування води?
ЗМ 1.2. САНІТАРНІ ВИМОГИ ДО РОЗМІЩЕННЯ ТА ЕКСПЛУАТАЦІЇ КАНАЛІЗАЦІЙНИХ ТА ВОДОПРОВІДНИХ СПОРУД. ОРГАНІЗАЦІЯ САНІТАРНОГО НАГЛЯДУ ЗА СИСТЕМАМИ ВОДОПОСТАЧАННЯ
Практична робота 3. Методика санітарного обстеження джерел водопостачання і відбору проб води для бактеріологічного і санітарно-хімічного дослідження
3.1. Мета заняття. Опанувати методику санітарного обстеження джерел водопостачання і відбору проб води для бактеріологічного і санітарно-хімічного аналізу. 3.2. Практічні навички Знати: 1. Гігієнічне значення води (фізіологічне, ендемічне, епідеміологічне, токсикологічне, бальнеологічне, клімато-погодоутворююче, господарсько-побутове, народно-господарське значення). 2. Класифікацію джерел водопостачання та їх гігієнічну характеристику. 3. Програму санітарного обстеження джерел водопостачання: санітарно-топографічного, санітарно-технічного, санітарно-епідеміологічного. Вміти: 1. Проводити санітарне обстеження джерел водопостачання. 2. Визначати місця відбору і здійснювати відбір проб води для дослідження, уміти заповнити супровідний бланк. 3. Визначати дебіт (продуктивність) джерел водопостачання. 3.3. Завдання Після перевірки початкового рівня знань студентів і обговорення теоретичних питань теми (п. 3.4.1) кожному студентові (або парі студентів) пропонується вирішити підготовлене викладачем ситуативне завдання. До завдання додається топографічна карта або ситуативний план й імітована проба води. Студенти виконують санітарне обстеження джерела водопостачання (п. 3.4.2) і відбирають проби води з крана водопроводу (п. 3.4.3). При цьому визначають і оцінюють (п. 3.4.4) низку показників якості води, які можна виконати безпосередньо біля джерела води, заповнюють супровідний бланк. Роботу оформляють протоколом. Дата добавления: 2015-12-16 | Просмотры: 553 | Нарушение авторских прав |
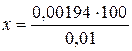 = 19,4% активного хлору.
= 19,4% активного хлору.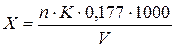 , мг/л
, мг/л