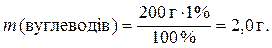|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Правильні відповіді. 1. Правильна відповідь б).1. Правильна відповідь б). Ендотермічною є реакція, яка супроводжується поглинанням теплоти, тому енергія продуктів буде більша, ніж енергія вихідних речовин. 2. Правильна відповідь б) і г). Екзотермічні реакції супроводжуються виділенням теплоти, отже, тепловміст у системі (ентальпія) зменшується.
3. Правильна відповідь б). Стандартна ентальпія (теплота) утворення ( буде дорівнювати нулю.
4. Правильна відповідь б). Запишемо термохімічне рівняння реакції: С(т) +2N2O(г) = CO2(г) + 2N2(г); Δ Н =... Розрахуємо значення теплового ефекту за наслідком закону Гесса, що був використаний при розв’язанні попередньої задачі, та значеннями стандартних ентальпій утворення за умовою. Пригадаємо, що для С(т) і N2(г) стандартні теплоти утворення дорівнюють нулю. Отже, будемо мати: Δ Н = Тобто, термохімічне рівняння матиме таку повну форму: С(т) + 2N2О(г) = СО2(г) + 2N2(г); Δ Н = – 556,61 кДж. Якщо в реакцію вступає 22 г N2О (або 0,5 моль, бо М (N2О) = 44 г/моль), у реакції буде виділятися у чотири рази менше тепла:
5. Правильна відповідь а). У цілому величина ентропії речовини залежить від її агрегатного стану і зменшується в ряду: газ – рідка речовина – тверда речовина. Для якісної оцінки зміни ентропії у хімічній реакції можна з певним припущенням порівнювати кількість моль тільки газоподібної речовини до і після реакції. Чим більшою буде кількість таких речовин, тим більшою буде і величина ентропії. Застосовуючи такий підхід, маємо для першої реакції: у лівій частині рівняння 1 моль газу, а у правій – 2 моль, отже Δ S > 0. У другій реакції справа буде менше газоподібних речовин, ніж зліва, тобто Δ S < 0, бо завжди Δ S = S S продуктів – S S вих. речовин .
6. Знаходимо масу білків, жирів і вуглеводів у маргарині:
Враховуючи калорійність 1 г білків, жирів і вуглеводів, знаходимо загальну калорійність 200 г маргарину: Q = (0,6 г + 2,0 г) × 17,18 кДж/г + 164,6 г × 38,97 кДж/г = 44,67 кДж + 6414,46 кДж = 6459,13 кДж. Отже, при повному окисленні 200 г маргарину організм одержить 6459,13 кДж енергії.
7. Правильна відповідь г). Як відомо, реакція легко відбувається самодовільно, якщо виконується критерій самодовільного перебігу реакцій, а саме: Δ G < 0. Оцінити знак зміни енергії Гіббса можна за знаками зміни ентальпії і зміни ентропії реакції за рівнянням: Δ G = Δ Н – Т Δ S. Отже, для того, щоб значення Δ G було від’ємним незалежно від температури, треба, щоб виконувалися умови: Δ Η < 0 і Δ S > 0.
8. Правильна відповідь б). Оскільки відомі величини зміни ентальпії реакції (Δ Н = –221кДж), треба розрахувати величину ентропії. Зміна ентропії реакції Δ S 0 розраховується як різниця суми стандартних ентропій продуктів реакції і суми стандартних ентропій вихідних речовин з урахуванням їхніх коефіцієнтів: Δ S = 2 × S 0(CO(г)) – 2 × S 0(C(т)) – S 0(O2(г)) = 2 × 197,68 – 2 × 5,74 – 205,17 = 395,36 – 11,48 – 205,17 = 178,71 Дж/(моль . К) = 0,1787 кДж/(моль . К). Тепер визначаємо зміну енергії Гіббса реакції (∆ G 0 = Δ Η 0 – Т ∆ S 0): Δ G 0 = Δ Η 0 – 298 × Δ S = – 221 – 298 × 0,1787 = – 274,25 (кДж). Оскільки Δ G 0 < 0, можна зробити висновок, що за стандартної температури (298 К) реакція буде йти самодовільно, але, враховуючи, що ΔН0 < 0 і ΔS0 > 0, треба оцінити цю реакцію як самодовільну, з термодинамічної точки зору, за будь - якої температури.
Дата добавления: 2015-12-15 | Просмотры: 526 | Нарушение авторских прав |
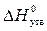 )дорівнює нулю для простих речовин, якщо вони за стандартних умов знаходяться у стійкому стані. Простою речовиною, з наведених у відповідях, є бром. Але стійким станом за стандартних умов для нього є рідина, отже тільки для Вr2(р)
)дорівнює нулю для простих речовин, якщо вони за стандартних умов знаходяться у стійкому стані. Простою речовиною, з наведених у відповідях, є бром. Але стійким станом за стандартних умов для нього є рідина, отже тільки для Вr2(р) 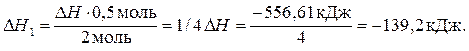
 ;
;  ;
;