 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Матеріали для самоконтролю. 1. Вказати, в якому випадку реакція є ендотермічною:1. Вказати, в якому випадку реакція є ендотермічною: а) якщо енергія продуктів дорівнює енергії вихідних речовин; б) якщо енергія продуктів більша, ніж енергія вихідних речовин; в) якщо енергія продуктів менша, ніж енергія вихідних речовин; г) це можна зробити, якщо відомо, виділяється теплота, чи поглинається. 2. Вибрати термохімічні рівняння екзотермічних реакцій: а) О2 + 1/2 О2 = О3; D Н = 142 кДж; б) 1/2 О2 + Н2 = Н2О(г); D Н = - 242 кДж; в) Н2О + 1/2 О2 = Н2О2; D Н = 98,2 кДж; г) Н2 + 1/2 О2 = Н2О(р); D Н = - 285,8 кДж. 3. Вказати, для якої з речовин стандартна ентальпія утворення дорівнює нулю: а) Вr2(г); б) Вr2(p); в) Вr2(т); г) НBr(г) .
4. Розрахувати кількість теплоти, що виділяється у реакції: С(т) + 2N2O(г) = CO2(г) + 2N2(г), якщо вступає в реакцію 22 г нітроген (І) оксиду, а ентальпії утворення дорівнюють: а) 475,1 кДж; б) 139,2 кДж; в) 278,3 кДж; г) 556,61 кДж.
5. Визначити якісну величину (знак) зміни ентропії у реакціях: 1. 2C(т) + O2(г) = 2CO(г); 2. 2H2(г) + O2(г) = 2H2O(г) . а) 1. D S > 0; 2. D S < 0; в) 1. D S > 0; 2. D S > 0; б) 1. D S < 0; 2. D S >0; г) 1. D S < 0; 2. D S < 0.
6. Розрахувати калорійність 200 г маргарину, що містить 0,3% білків, 82,3% жирів, 1%вуглеводів, якщо при згорянні в організмі 1 г білка або 1 г вуглевода виділяється 17,18 кДж енергії, а при згорянні 1 г жиру виділяється 38,97 кДж енергії.
7. Визначити умови зміни ентальпії і зміни ентропії реакції, при яких вона буде відбуватися самодовільно за будь - якої температури: а) Δ Н > 0, Δ S > 0; в) Δ Н > 0, Δ S < 0; б) Δ Н < 0, Δ S < 0; г) Δ Н < 0, ΔS > 0.
8. Оцінити, за якої температури буде відбуватися самодовільно процес, термохімічне рівняння для якого має вигляд: 2С(т) + О2(г) = 2СО(г); Δ Н 0 = - 221 кДж, якщо відомі значення стандартних ентропій речовин: S 0 (C(т)) = 5,74 Дж/(моль × К); S 0 (О2(г)) = 205,17 Дж/(моль × К); S 0 (CО(г)) = 197,68 Дж/(моль × К): а) буде відбуватися тільки за стандартної температури; б) буде відбуватися за будь - якої температури; в) не буде відбуватися за стандартної температури; г) не буде відбуватися за будь-якої температури. Дата добавления: 2015-12-15 | Просмотры: 745 | Нарушение авторских прав |
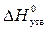 (N2O(г)) = 81,55 кДж/моль,
(N2O(г)) = 81,55 кДж/моль,