|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Коронарные стенты
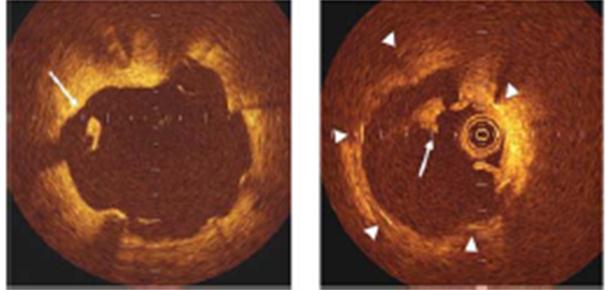
В 1964 году C.T.Dotter и M.P.Judkins сообщили о первой ангиопластике (С.Dotter, М.Judkins, 1964). A.Gruntzig провел первую баллонную ангиопластику коронарных артерий (A.Gruntzig, 1978). Коронарные стенты были разработаны в середине 80-х годов XX века, первая их имплантация выполнена U.Sigwart и соавт. (U.Sigwart et al., 1987). Применение стентов уменьшило необходимость экстренного проведения коронарного шунтирования, но сопровождалось подострой тромботической окклюзией коронарной артерии с частотой 18% в пределах 2 недель после имплантации (P.Serruys et al., 1991). Это специфическое осложнение потребовало разработки и использования комплексной антитромботической терапии, ассоциировавшейся с высоким риском кровотечений (R.van Domburg et al., 1999). Другой проблемой при имплантации стента является гиперплазия интимы внутри него (R.Hoffmann et al., 1996), приводящая к рестенозу в 20-30% случаев (D.Moliterno, 2005). Проблема рестеноза была в значительной мере решена путем внедрения стентов, обработанных антипролиферативными препаратами. В 2005 году такие стенты применялись в США в 80-90% случаев (A.Jeremias, A.Kirtane, 2008). Однако в 2006 году был поставлен вопрос об отдаленной безопасности обработанных лекарствами стентов из-за наблюдавшейся тенденции к увеличению частоты поздних тромбозов стентов (A.Nordmannet al.,2006; E.Camenzind et al., 2007; B.Lagerqvist et al., 2007), после чего их использование резко сократилось. Появился стимул для разработки новых моделей стентов, отвечающих требованиям высокой безопасности. Первым для обработки стентов начали применять сиролимус (рапамицин) – антибиотик из класса макролидов, ограничивающий пролиферацию неоинтимы (S.Marx, A.Marks, 2001). Такой стент (Sypher) был впервые имплантирован в 1999 году (B.Rensing et al., 2001). Новая технология резко снижала частоту рестенозов по сравнению с простыми металлическими стентами, обеспечивая уменьшение частоты повторной реваскуляризации при сопоставимом числе ИМ и смертельных исходов (A.Kirtane et al., 2009). Сообщалось даже о снижении риска тяжелых сердечно-сосудистых осложнений в случаях имплантации обработанных сиролимусом стентов (P.Serruys et al., 2010). Несколько позднее появились стенты, обработанные паклитакселем (TAXUS), первоначально демонстрировавшие результаты лечения, сходные с достигавшимися при использовании стентов Sypher (J.Daemen et al., 2006). Первая модель стента TAXUS (Express) была усовершенствована до TAXUS Liberte, которая, в сравнении с предшествовавшей, обеспечивала достоверное снижение риска ИМ (2,9% против 10,4%; р=0,01) и кардиальной смерти (1,5% против 6,7%; р=0,03) (M.Turco, 2009). Между тем по данным мета-анализа 16 рандомизированных исследований, сравнивавших стенты Sypher и TAXUS (n=8695), имплантация первых сопровождалась статистически значимым уменьшением потребности в повторной реваскуляризации на 26% (р<0,001) и случаев тромбоза стента на 34% (р=0,02), тенденцией к снижению частоты ИМ на 16% (р=0,10) и смертельного исхода на 8% (р=0,43) при 2-летнем наблюдении (A.Schomig et al., 2007). По сравнению с простыми металлическими стентами, стенты, обработанные сиролимусом или паклитакселем, уменьшали необходимость повторной реваскуляризации целевой артерии на 70% (р<0,0001) и 58% (р<0,001) соответственно по данным 4-летнего наблюдения (C.Stettler et al., 2007). В 2006-2007 годах появлялись сообщения о повышении смертности при применении стентов Sypher по сравнению с простыми металлическими (6,3% против 3,9%; р=0,03), вероятно в результате тромбоза стента в сроки более 1 года (после отмены клопидогрела) с развитием больших фатальных ИМ (E.Camenzind et al., 2007). Однако последующие данные крупных регистров с участием около 48000 (S.James et al., 2009) и 263000 пациентов (P.Douglas et al., 2009), мета-анализа рандомизированных исследований (A.Kirtane et al., 2009) показали отсутствие существенных различий прогноза больных, получавших простые металлические, а также стенты Sypher или TAXUS. Впрочем отсутствие таких преимуществ у стентов, обработанных антипролиферативными средствами, лишь демонстрирует возможность достижения сходного результата при в разы меньшей стоимости вмешательства. Food and Drug Administration (FDA) США рекомендовано имплантировать стенты Sypher при стенозах протяженностью не более 30 мм в артерии с нативным диаметром 2,5-3,5 мм, а стенты TAXUS – при параметрах до 28 мм и 2,5-3,7 мм соответственно. Однако 70-75% таких стентов применяется вопреки показаниям (A.Farb, A.Boam, 2007). Предполагается, что имплантация обработанных лекарствами стентов не по показаниям является важной причиной худших результатов по сравнению с использованием простых металлических стентов по показаниям (B.Brodie et al., 2008). При этом нельзя отрицать возможность тромбоза стента в отдаленном периоде из-за нарушения эндотелизации внутренней его поверхности и реакции гиперчувствительности на полимер, выделяющий антипролиферативный препарат. Нарушение эндотелизации стентов, обработанных антипролиферативными средствами, подтверждено у человека с помощью прижизненных ангиоскопии и оптической когерентной томографии (M.Awata et al., 2007;G.Guagliumi et al., 2010). На рисунке 3 представлены полученные с помощью оптической когерентной томографии изображения тромбов, образовавшихся в просвете стентов, слева – на фоне неполного раскрытия стента, справа – при отсутствии неполного раскрытия стента. Важный независимый фактор риска тромбоза стента – преждевременное, в сроки до 12 месяцев, прекращение двойной антитромбоцитарной терапии (отмена клопидогрела) (F.Airoldi et al., 2007; J.van Werkum et al., 2009), обусловленное низкой комплаентностью пациента, необходимостью проведения хирургической операции, геморрагическим осложнением, плохим инструктированием больного, аллергией на клопидогрел, экономическими причинами (J.Spertus et al., 2006). R.Rossini и соавт. (2011) сообщили об учащении всех главных неблагоприятных сердечно-сосудистых исходов при досрочном прекращении приема клопидогрела или сразу двух антитромбоцитарных средств у 8,8% из 1358 больных, которым имплантировали стенты с антипролиферативным покрытием (таблица 2).
Рисунок 3. Тромбообразование в просвете стента, прижизненно выявленное с помощью оптической когерентной томографии.
Согласно имеющимся данным, значительное повышение риска тромбоза стента отмечается при отмене клопидогрела в первые 6 месяцев после ангиопластики (S.Schulz et al., 2009), но частота этого опасного осложнения обычно невелика – около 1% (P.Serruys, J.Daemen, 2007). Немногочисленные данные о целесообразности продолжения двойной антитромбоцитарной терапии более 12 месяцев достаточно противоречивы. G.Tanzilli и соавт. (2009) сообщили о снижении риска тромбоза стента при 24-месячной продолжительности лечения по сравнению с 12-месячной (0,4% против 3%; р=0,03). S.Park и соавт. (2010) сопоставили результаты продления лечения клопидогрелом и аспирином и приема одного аспирина после 1 года двойной антитромбоцитарной терапии. В среднем 19 месяцев наблюдения за 2701 пациентом выявили тенденцию к повышению суммарной частоты кардиальной смерти и ИМ (1,8% против 1,2%; р=0,17), а также общего числа случаев ИМ, инсульта и смерти от кардиальных причин (на 84%; р=0,06) при нерекомендованном сегодня продлении двойной антитромбоцитарной терапии более 12 месяцев. Эти данные должны быть подтверждены или опровергнуты в крупных рандомизированных клинических исследованиях с длительным периодом наблюдения.
Таблица 2 Частота осложнений у больных, прекративших прием одного или двух антитромбоцитарных препаратов в пределах года после имплантации стентов, обработанных антипролиферативными препаратами
Сравнение результатов двойной антитромбоцитарной терапии меньшей и большей продолжительности в сравнении с рекомендованной 12-месячной проводится в рандомизированных проектах ISAR-SAFE, OPTIMIZE, DAPT (S.Garg, P.W.Serruys, 2010). Серьезным ограничением для пролонгирования двойной антитромбоцитарной терапии является прогрессирующее повышение риска геморрагических осложнений (G.Tanzilli et al., 2009). Более новые антитромбоцитарные средства, по-видимому, превосходят клопидогрел в способности предупреждать тромбоз стента. Так, прасугрел оказался лучше него в исследовании TRITON-TIMI 38 (1,13% против 2,35%; р=0,03) (S.Wiviott et al., 2008), а тикагрелор в проекте PLATO (1,3% против 1,9%; р=0,009) (L.Wallentin et al., 2009). Еще одной причиной тромбоза стента может являться резистентность к аспирину и/или клопидогрелу, встречающаяся примерно в 40% случаев (D.Angiolillo et al., 2005), и, вероятно, подающаяся коррекции путем повышения дозы антитромбоцитарного препарата без увеличения риска кровотечения (G.Lemesle et al., 2009). Частота тромбоза стента зависит от вида выделяемого им препарата с антипролиферативным действием. Сравнение стентов, обработанных эверолимусом, со стентами, обработанными паклитакселем, выявило существенные различия частоты этого осложнения при 12-месячном наблюдении в исследованиях SPIRIT IV (0,29% против 1,06%; р=0,003) (G.Stone et al., 2010) и COMPARE (0,7% против 2,6%; р=0,002) (E.Kedhi et al., 2010) соответственно. Попытки использования стентов, обработанных новыми антипролиферативными средствами (зотаролимусом – Endeavor RESOLUTE, эверолимусом – PROMUS Element, новолимусом – Elixir DESyne) пока не продемонстрировали их клинического превосходства в сравнении со стентами Sypher и TAXUS Element (С.Stettler et al., 2007). Разработка и внедрение биодеградируемых за 6-9 месяцев полимеров, выделяющих антипролиферативные препараты сравнительно более короткий период времени, теоретически позволяет снизить риск позднего тромбоза стента без увеличения частоты рестеноза. Однако доказательств улучшения клинических исходов при использовании этого нового типа стентов пока не имеется (S.Garg, P.Serruys, 2010). Созданы и стенты, выделяющие антипролиферативные средства без использования полимерной платформы (M.Basalus et al., 2009), которые теоретически могут позволить уменьшить ее отрицательное влияние на организм, ограничить продолжительность двойной антитромбоцитарной терапии. В проекте ISAR-TEST 3 при использовании стентов без полимера отмечалось уменьшение частоты рестенозов по сравнению со стентами, выделявшими сиролимус или зотаролимус из полимерной платформы, в сочетании с равной отдаленной безопасностью (R.Byrne et al., 2010). Разработаны модели стентов, в которых вместо стали применен магний (R.Erbel et al., 2007), что должно уменьшать воспаление и тромбогенность, или вместо металла используется полиангидридный эфир салициловой кислоты, подверженный быстрой биодеградации (R.Jabara et al., 2008). Сообщалось об исследованиях стентов, покрытых эндотелиальными прогениторными клетками (M.Beijk et al., 2010;S.Garg et al., 2010), клиническая выгода которых еще не установлена. Представлялись стенты, раскрывающиеся без использования баллона, предназначенные для зон бифуркации артерий, уязвимых бляшек и артерий малого диаметра (S.Garg, P.Serruys, 2010).
Дата добавления: 2015-02-06 | Просмотры: 1174 | Нарушение авторских прав |