 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Натрію тіосульфат(Natrii thiosulfas) Na2S203*5Н20
Добування. Натрію тіосульфат не є природним продуктом, його отримують синтетично окисненням полісульфідів: 2CaS2 + 302 à2CaS203 CaS203 + Na2S04àNa2S203+CaS04 Властивості. Кристали безбарвні, прозорі. В сухому повітрі вивітрюється, у вологому - злегка розпливається. Дуже легко розчинний у воді, практично нерозчинний у 96 % спирті. Як видно з формули, ступінь окиснення атомів сульфуру в молекулі різна. Один атом сульфуру має ступінь окиснення +6, інший -2. Присутність атомів сульфуру в різних ступенях окиснення обумовлює властивості лікарського засобу. Так, маючи в молекулі S2-, натрію тіосульфат виявляє відновні властивості. Відновні властивості натрію тіосульфату використовують як для ідентифікації, так і для кількісного аналізу. Ідентифікація: 1. Субстанція знебарвлює розчин калію йодиду йодований, за рахунок своїх сильних відновних властивостей. При взаємодії з йодом натрію тіосульфат діє як відновник. Приймаючи електрони від S2-, йод відновлюється до І-, а натрію тіосульфат окиснюється до тетратіонату натрію: І2 + 2 Na2S203à2NaI +Na2S406 буро- безбарвний жовте розчин забарвлення При додаванні по краплям розчину йоду, який має жовто-буре забарвлення, до розчину натрію тіосульфату спостерігається знебарвлення розчину. 2. При додаванні до лікарської речовини надлишку аргентуму нітрату утворюється білий осад, який швидко забарвлюється в жовтуватий, потім у чорний колір:
Ag2S203à Ag2S03 + S жовтий осад
чорний осад
чорний осад Тому, якщо при дії на натрію тіосульфат аргентуму нітратом утворюється одразу чорний осад, це свідчить про забруднення лікарського засобу сульфідами. 3. Натрію тіосульфат не є стійкою сполукою і легко розкладається під дією кислот. Цю властивість натрію тіосульфату розкладатися кислотами з виділенням сірки використовують для ідентифікації JI3. При додаванні до розчину субстанції кислоти хлористоводневої спостерігається помутніння розчину внаслідок виділення сірки:
4. Субстанція дає характерні реакції на катіон натрію (забарвлення полум'я та реакція з калію піроантимонатом). Випробування на чистоту: Сульфіди визначаються з натрію нітропрусидом: Na2S+Na2[Fe(CN)5NO]àNa4[Fe(CN)5NOS] Не повинне з'являтися фіолетове забарвлення (недопустима домішка). Кількісне визначення. Йодометрія, пряме титрування, індикатор - крохмаль; (s=2). Метод відноситься до групи методів окиснення - відновлення - базується на окисно - відновних реакціях, тобто реакціях, пов'язаних з переносом електронів: І2 + 2е à 2I- 2S2032- — 2е — S4062- Методом прямої йодометрії визначають речовини, які мають сильні відновні властивості. В даному випадку натрію тіосульфат має сильні відновні властивості, тому можливе його визначення методом прямої йодометрії. Титрантом є розчин йоду в калію йодиді (враховуючи незначну розчинність йоду у воді, його робочий розчин готують розчиненням наважки йоду в концентрованому розчині калію йодиду). При титруванні йде окисно - відновна реакція між натрію тіосульфатом та йодом: 2Na2S203 + І2 à 2NaI + Na2S406 В точці еквівалентності (титранту додано в кількості, еквівалентній кількості натрію тіосульфату) реакція закінчується і надлишкова крапля розчину йоду вступає в реакцію з індикатором - утворюється комплексна сполука йоду з крохмалем інтенсивно-синього кольору (І2 + крохмаль - синє забарвлення), тобто титрують від безбарвного до блакитного забарвлення розчину. Крохмаль є специфічним реактивом на йод (І2). Зберігання. У добре закупореній тарі (вимагає захисту від дії газів, що містяться у навколишньому середовищі). Також натрію тіосульфат містить кристалізаційну воду, яка легко вивітрюється, тому зберігати його потрібно в прохолодному місці, в склянках темного скла, так як світло сприяє його розкладанню. Застосування. Детоксикуючий, десенсибілізуючий (протиалергічний) засіб. Детоксикуюча дія заснована на відновних здібностях натрію тіосульфату, завдяки яким токсичні сполуки (ціаніди, сполуки Арсену, Меркурію, Плюмбуму) при взаємодії з натрію тіосульфатом перетворюються в менш токсичні.
Na2S203 + 2НСІ à 2NaCI + S02 + S +H20 Світло-жовтий осад Дата добавления: 2015-12-15 | Просмотры: 1912 | Нарушение авторских прав 12 |
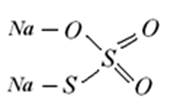
 Na2S203 + 2AgN03àAg2S203 + 2NaN03
Na2S203 + 2AgN03àAg2S203 + 2NaN03 Білий осад
Білий осад Ag2S03 + S + Н20 àAg2S + H2S04
Ag2S03 + S + Н20 àAg2S + H2S04  За допомогою цієї реакції можна відрізнити тіосульфат-іон (S2032-) від сульфід-іону (S2-) - останній при взаємодії з розчином аргентуму нітрату відразу утворює осад аргентуму сульфіду чорного кольору: Na2S + 2AgN03 à 2NaN03 + Ag2S
За допомогою цієї реакції можна відрізнити тіосульфат-іон (S2032-) від сульфід-іону (S2-) - останній при взаємодії з розчином аргентуму нітрату відразу утворює осад аргентуму сульфіду чорного кольору: Na2S + 2AgN03 à 2NaN03 + Ag2S
 Na2S203 + 2НСІ à 2NaCI + S02 + S +H20
Na2S203 + 2НСІ à 2NaCI + S02 + S +H20
 Іноді застосовується як інсектицидний засіб. Дем'янович запропонував для лікування корости використовувати реакцію натрію тіосульфату з кислотою хлористоводневою. Утворена при цьому сірка і має високу протипаразитарну дію та знешкоджує дію кліща:
Іноді застосовується як інсектицидний засіб. Дем'янович запропонував для лікування корости використовувати реакцію натрію тіосульфату з кислотою хлористоводневою. Утворена при цьому сірка і має високу протипаразитарну дію та знешкоджує дію кліща: