|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
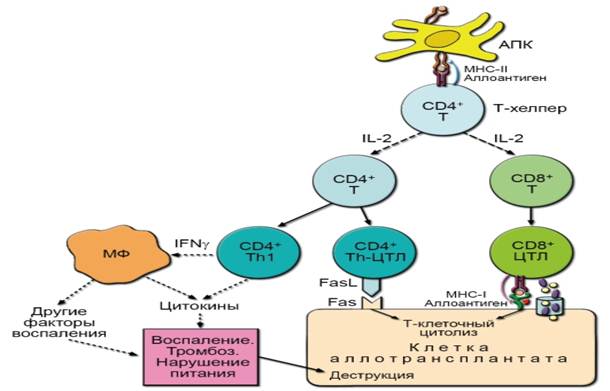
ИММУННАЯ ТОЛЕРАНТНОСТЬИммунная толерантность - отсутствие активации лимфоцитов (и, следовательно, выработки ими эффекторных молекул) при наличии доступного специфичного антигена. В природе толерантность лимфоцитов как отсутствие ответа на доступный антиген нужна только по отношению к антигенам собственных неповреждённых тканей организма. • Следует отличать иммунную толерантность от супрессии уже состоявшегося иммунного ответа: - супрессия - продуктивная активация клона начинается, реализуется, затем подавляется; - толерантность - продуктивной активации антигенспецифичного клона лимфоцитов не происходит. Механизмы супрессии и толерантности одинаковы - апоптоз и подавление внутриклеточного метаболизма сигналами с ингибирующих рецепторов, однако эти механизмы реализуются на разных этапах лимфопоэза и иммуногенеза лимфоцитов. • Делеция клона. Делеция аутореактивных клонов на стадии лимфогенеза приводит к установлению центральной толерантности. По механизму делеции клона, т.е. путём апоптоза лимфоцитов, связавших антиген, происходит элиминация аутореактивных B-лимфоцитов в костном мозге и негативная селекция тимоцитов в тимусе. • Анергия клона. Анергией клона называют отсутствие полной активации лимфоцитов, распознавших антиген, но не получивших при этом полноценных костимуляторных сигналов. Это один из основных механизмов развития периферической толерантности лимфоцитов после их выхода из центральных органов иммунной системы в периферические для прохождения иммуногенеза. Анергия, вероятно, имеет несколько разных механизмов реализации. Продуктивная активация аутореактивного лимфоцита может развиться, если он распознаёт комплексы собственных пептидов со «своими» MHC и получает дополнительный сигнал от корецепторов при взаимодействии с активированной АПК. Сверхпороговый уровень экспрессии костимулирующих молекул достигается только при внешней стимуляции АПК, наиболее очевидный фактор которой - воспаление покровных тканей, повреждённых внедрившимся внешним патогеном (в естественных условиях - инфекционным). Таким образом, если организм не травмирован и инфекция не индуцировала развитие вос- паления, иммунная толерантность лимфоцитов к собственным антигенам - единственно возможное их состояние. Трансплантация Трансплантацией называют пересадку тканей или органов, изъятых из одного организма (донора), во внутреннюю среду другого организма (реципиента). Если трансплантацию проводят между организмами одного вида, то это аллотрансплантация, а антигены трансплантата - аллоантигены, реакция иммунной системы - ответ на аллоантигены. Если же трансплантацию проводят между организмами разных видов, то это ксенотрансплантация. ОТТОРЖЕНИЕ ТРАНСПЛАНТАТА Трансплантация может быть успешной только при развитии иммунной толерантности организма-реципиента к антигенам трансплантата (на практике это достигается путём медикаментозной иммуносупрессии со всеми её побочными эффектами), в противном случае на тех или иных сроках после операции происходит отторжение пересаженных тканей. • Сверхострое отторжение происходит во время или вскоре после операции. При этом развивается окклюзия кровеносных сосудов, связывающих трансплантат с организмом реципиента. Это происходит, если реципиент уже был иммунизирован антигенами донора (или антигенами, перекрёстно реагирующими с антигенами донора) и в крови реципиента есть достаточное количество антител к антигенам стенок сосудов или клеток крови донора. Эти антитела немедленно связываются со стенкой сосудов трансплантата, активируют комплемент и систему коагуляции крови, что приводит к быстрому тромбозу сосудов и выключению органа из кровотока. • Острое отторжение - нормальный первичный иммунный ответ на трансплантат при отсутствии медикаментозной иммуносупрессии. В разрушение трансплантата могут быть вовлечены все известные эффекторные механизмы иммунного ответа - антителозависимые (антителозависимая клеточная цитотоксичность, активация комплемента иммунными комплексами и др.) и антителонезависимые (CD8+ ЦТЛ; Th1-клетки, активируют макрофаги, индуцируя ГЗТ; Тh2-клетки активируют эозинофилы посредством продуцируемого ими ИЛ-5). • Отсроченное отторжение по эффекторным механизмам аналогично острому, однако в результате эффективной иммуносупрессии индукция иммунного ответа откладывается на несколько лет. В отторжении аллогенного траснплантата участвуют практически все механизмы адаптивного иммунитета (рис. 9-3). Основными эффектора-
Рис. 9-3. Клеточные факторы и механизмы отторжения трансплантата. ThЦТЛ - это CD4+ T-клетки с цитотоксическим фенотипом. Сплошные стрелки обозначают последующую дифференциацию одной клетки в другую. Стрелки с пунктиром - секретируемые цитокины, воздействующие на другие клетки. Мелкая красная структура - β2-микроглобулин. А цилиндрическая структура рядом схематично показывает проникновение перфорина (мелкие фиолетовые овалы) c гранзимами (мелкие жёлтые кружочки) ми отторжения являются клеточные факторы. CD8+ Т-клетки, которые обычным путём дифференцируются в цитотоксические Т-лимфоциты (ЦТЛ), вызывают гибель клеток трансплантата преимущественно по механизму перфоринзависимого и Fas-индуцированного цитолиза. CD4+ Т-клетки участвуют в отторжении с помощью двух групп механизмов. Одна из них включает индукцию гибели клеток трансплантата по механизму Fas- и ФНО-зависимого апоптоза. Вторая группа объединяет действие различных факторов воспаления, развивающегося в трансплантате вследствие развития Th1-клеток и активации с их участием макрофагов. Причиной гибели при этом в первую очередь является нарушение питания трансплантата, вызванное изменением микроциркуляции и развитием тромбозов, а также прямое действие цитокинов, ферментов и других факторов, выделяемых в очаге воспаления. Роль антител в отторжении трансплантата заведомо второстепенна. Связываясь с антигенами трансплантата, антитела блокируют их, не давая возможности проявиться клеточным механизмам защиты. Привлечение в качестве эффекторных агентов факторов комплемента при этом невозможно в связи с активностью на аллогенных (как и на сингенных) клетках системы контроля комплемента, немедленно разрушающих связанные факторы комплемента. В то же время иммунные комплексы, образующиеся при соединении антител с мембранными антигенами трансплантата, могут привлечь клеточные эффекторные механизмы, основанные на распознавании Fc-частей молекул антител. В роли эффекторных клеток-киллеров могут выступать FcR+-клетки - NK-клетки и макрофаги. Такие реакции обозначают как антителозависимый клеточный цитолиз. Трансплантация костного мозга. Особый случай - пересадка костного мозга или органов и тканей, содержащих много профессиональных АПК. На этих клетках присутствуют все костимуляторные молекулы, необходимые и достаточные для продуктивной активации T-лимфоцитов. Именно поэтому при пересадке кроветворных тканей отторжение MHC-совместимого трансплантата может произойти быстрее, чем MHC-несовместимого, поскольку T-лимфоциты реципиента будут эффективнее работать с АПК донорского происхождения (как с «родными» по MHC). Кроме того, лимфоциты донора могут начать атаковать клетки организма реципиента, вызывая реакцию «трансплантат против хозяина». Дата добавления: 2014-12-12 | Просмотры: 1973 | Нарушение авторских прав |