 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Проблема биоэквивалентности лекарственных средствВыше уже упоминалось о том, что каждое лекарство может быть представлено на рынке как в брендовой, так и в генерической форме, причем генерические средства могут иметь несколько вариантов торговых названий. Например, транквилизатор диазепам представлен на рынке 10 генерическими препаратами, противовоспалительное средство диклофенак – 14. Все это многообразие лекарственных средств отличается часто не только внешним видом, но и стоимостью (причем, разница в цене иногда может быть довольно ощутимой). Естественно, что врач и пациент предполагают, что все это многообразие лекарств должно обеспечить равное по эффективности лечение болезни. Т.е. они исходят из предположения об эквивалентности различных препаратов одного и того же лекарственного средства, произведенного разными фирмами. Различают 3 вида эквивалентности: [ Химическая (фармацевтическая) эквивалентность – означает, что 2 лекарственных препарата содержат одно и то же лекарственное вещество в равных количествах и в соответствии с действующими стандартами (фармакопейными статьями). При этом неактивные ингридиенты лекарственных препаратов могут различаться. Например, таблетки ренитека и энама по 10 мг являются химически эквивалентными, т.к. содержат по 10 мг эналаприла малеата (ингибитора АПФ). [ Биоэквивалентность – означает, что два химически эквивалентных лекарственных препарата различных производителей при введении в организм человека в равных дозах и по одинаковой схеме всасываются и поступают в системный кровоток в равной степени, т.е. обладают сопоставимыми показателями биодоступности. Доказательство биоэквивалентности генерического лекарственного препарата его брендовому аналогу – необходимое условие регистрации любого генерического препарата. Основным критерием биоэквивалентности является отношение площадей под фармакокинетической кривой для двух изучаемых лекарственных средств, а также отношение максимальных концентраций этих лекарств в крови пациента:
Считают, что допустимыми колебаниями этих параметров является диапазон 0,8-1,2 (т.е. биодоступность двух сравниваемых лекарств не должна различаться более чем на 20%). Если генерический лекарственный препарат является небиоэквивалентным его брендовому аналогу то данное лекарство не может быть зарегистрировано и разрешено к применению. Показателен пример с препаратами пиридинолкарбамата. Это средство было представлено на рынке в виде таблеток пармидин (Россия), продектин (Венгрия) и ангинин (Япония)[5]. Разница показателей биодоступности между пармидином и ангинином составляла 7,1%, тогда как та же разница для продектина и ангинина была 46,4%. Неудивительно, что доза продектина должна была быть в 2 раза больше дозы ангинина, чтобы оказать сопоставимое терапевтическое действие. Доказательств биоэквивалентности не требуется для отдельных лекарственных препаратов: дигоксина, фенитоина, оральных контрацептивов. Это связано с тем, что обеспечить равную биодоступность для этих средств сложно даже в пределах одного производителя – иногда разные серии препарата, изготовленные на одном заводе могут иметь значимые колебания показателей биодоступности. Следует помнить, что биоэквивалентность лекарств еще ничего не говорит об их терапевтической эквивалентности. Ниже приведен пример подобной ситуации. [ Терапевтическая эквивалентность. Данное понятие означает, что 2 лекарственных препарата, содержащих одно и то же лекарственное средство, которые применяют в равных дозах и по одинаковой схеме вызывают сопоставимый терапевтический эффект. Терапевтическая эквивалентность не зависит от биоэквивалентности лекарственных препаратов. Два препарата могут быть биологически эквивалентны, но при этом иметь разную терапевтическую эквивалентность. Примером может служить ситуация, которая сложилась после выхода на рынок лекарств 2 препаратов коллоидного висмута субцитрата – брендового препарата «Де-нол» (Yamanouchi Europe B.V., Нидерланды) и «Трибимол» (Torrent House, Индия), которые были биоэквивалентны. Однако, изучение их антигеликобактерной активности показало, что незначительное изменение фирмой Torrent технологии производства практически лишило трибимол активности в отношении H. pylori. Следует отдать должное сотрудникам фирмы – они исправили допущенную ошибку (хотя репутация фирмы при этом несколько пострадала). Возможна иная ситуация, когда два биологически неэквивалентных препарата оказываются терапевтически эквивалентными. В частности, два оральных контрацептива - новинет (Gedeon Richter) и мерсилон (Organon) содержат по 150 мг дезогестрела и 20 мкг этинилэстрадиола. Несмотря на одинаковый состав, они являются бионеэквивалентными, но при этом равноэффективно предупреждают беременность. Дата добавления: 2015-01-12 | Просмотры: 947 | Нарушение авторских прав |
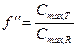 и
и 