|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
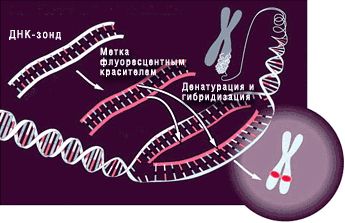
Флуоресцентная гибридизация in situ (FISH)
FISH сочетает в себе преимущества классических цитологических, цитогенетических и новейших молекулярных методов. Подобно классическим методам в гистологии, цитологии и цитогенетике, FISH может проводиться на тканевых, клеточных и хромосомных препаратах. Однако объектом исследования в данном случае являются не морфологические особенности ткани, клеток или хромосом, а уникальные нуклеотидные последовательности конкретной хромосомы или ее отдельного участка. Соответственно, выявляемые изменения являются генетическими (этиопатогенетическими), а не морфологическими (фенотипическими), и относятся к более тонкому уровню организации наследственного материала клетки.
Подобно цитологическим и классическим цитогенетическим методам, FISH метод позволяет оценить генетический статус отдельной клетки и выявить, к примеру, несколько этиопатогенетически значимых аномальных клеток среди тысяч других с нормальным генотипом. Такое не под силу ни одному методу, даже такому распространенному молекулярному методу как ПЦР, при котором ДНК всех клеток смешивается и результат усредняется.
В описываемом методе используются короткие последовательности ДНК, называемые зондами, которые являются комплементарными по отношению к последовательностям ДНК, представляющим объект изучения. Зонды гибридизуются (связываются) с комплементарными участками ДНК и благодаря тому, что они помечены флуоресцентной меткой, позволяют видеть локализацию интересующих генов в составе ДНК или хромосом. В отличие от других методов изучения хромосом, требующих активного деления клетки, FISH можно выполнять на неделящихся клетках, благодаря чему достигается гибкость метода.
Рис.1
FISH может применяться для различных целей с использованием зондов трех различных типов:
Материалом для исследования является кровь, костный мозг, биопсия опухоли, плацента, эмбриональные ткани или амниотическая жидкость. Образцы для исследования должны доставляться в лабораторию в свежем виде. Препараты (слайды) готовятся непосредственно из образцов ткани или после их культивирования. Могут использоваться как метафазные, так и интерфазные препараты клеток. Меченные флуоресцентными метками специфические ДНК-зонды гибридизуюся с хромосомной ДНК, причем можно одновременно использовать множественные зонды к разным локусам.
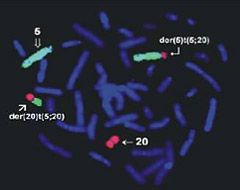
FISH является полезным и чувствительным методом цитогенетического анализа при выявлении количественных и качественных хромосомных аберраций, таких как делеции (в том числе и микроделеции), транслокации, удвоение и анэуплоидия. FISH на интерфазных хромосомах служит быстрым методом пренатальной диагностики трисомий по 21, 18 или 13 хромосомам или аберраций половых хромосом. В онкологии с помощью FISH можно выявлять рад транслокаций (bcr/abl, MLL, PML/RARA, TEL/AML1), связанных с гематологическими злокачественными новообразованиями. Метод также может использоваться для мониторинга остаточных явлений онкозаболевания после химиотерапии и пересадки костного мозга и выявления усиленных онкогенов (c-myc/n-myc), связанных с неблагоприятным прогнозом в отношении некоторых опухолей. FISH также используется для контроля приживаемости аллотрансплантата костного мозга, полученного от индивида противоположного пола.
FISH является чувствительным методом для идентификации хромосомных аберраций и одномоментного быстрого анализа большого (>500) числа клеток. Метод обладает высокой точностью при идентификации природы хромосом и неизвестных фрагментов хромосомной ДНК.
Рис.2
Однако, флуоресцентная гибридизация in situ имеет один существенный недостаток. Зонды являются специфичными только к одному участку генома и, как следствие, при одном исследовании можно определить наличие или число копий только этого участка (или нескольких при использовании многоцветных зондов). Поэтому важным является правильная клиническя предпосылка, а FISH анализ может только подтвердить иди не подтвердить диагноз. В последнем случае анализ призодится повторять в отношении сходных синдромов и это далеко не всегда приносит желаемый результат. Альтернативой этому методу является хромосомный микроматричный анализ, который при такой же точности, чувствительности и специфичности определяет количество генетического материала в сотнях тысяч (и даже миллионах) точек генома, что дает возможность диагностики пактически всех известных микроделеционных и микродупликационных сииндромов.
Наиболее частой причиной синдрома (70-75% случаев) является делеция участка 15q11-13 хромосомы 15, унаследованной от отца. Около четверти случаев обусловлено однородительской дисомией хромосомы 15 upd(15)mat, когда обе 15-е хромосомы у пациента являются копиями материнского происхождения. В незначительном числе случаев синдром связан с нарушением импринтинга или наличием сбалансированной транслокации с точкой разрыва внутри участка 15q11-13[1]. Дата добавления: 2015-02-02 | Просмотры: 2744 | Нарушение авторских прав |