|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
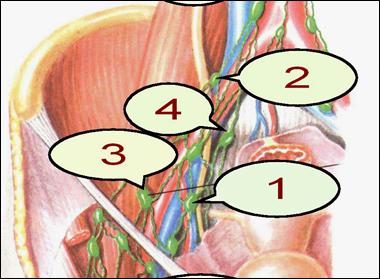
Классификация рака эндометрияКлассификация применима для рака и злокачественных смешанных мезодермальных опухолей. Должно быть гистологическое подтверждение диагноза и определена гистопатологическая дифференцировка и grade (G). Диагноз должен основываться на данных исследования материала, полученного при частичном выскабливании. Для оценки категорий Т, N и М применяются следующие методы. Т-категории - физикальный осмотр и методы визуализации, включая урографию и цистоскопию; N-категории - физикальный осмотр и методы визуализации, включая урографию; М-категории - физикальный осмотр и методы визуализации. Регионарные лимфатические узлы. Регионарными лимфатическими узлами матки являются тазовые (подчревные, запирательные), общие, внутренние и наружные подвздошные, расположенные около матки, крестцовые (рис. 27).
Рис. 27. Регионарные лимфоузлы. 1 - внутренние подвздошные (включая запирательные); 2 - общие подвздошные; 3 - внешние подвздошные; 4 - боковые крестцовые.
Критерий «Т» – является характеристикой первичной опухоли. Для сравнения в таблице наряду с критериями TNM приведены данные классификации Всемирной организации акушеров и гинекологов (FIGО) (табл. 3). Таблица 3 Классификация TNM и классификация Всемирной организации акушеров и гинекологов (FIGО) рака эндометрия
Примечание: FIGО (2001) рекомендует классифицировать опухоли с 1 стадией, получающих лучевую терапию, следующим образом: стадия 1 – опухоль ограничена телом матки; стадия 1А – длина полости матки ≤ 8 см; 1В – длина полости матки > 8 см. Данная рекомендация в настоящее время не используется.
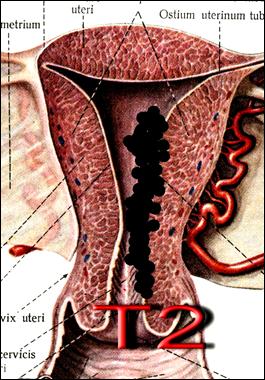
а Рис. 28. Стадирование злокачественного новообразования тела матки по символу T.
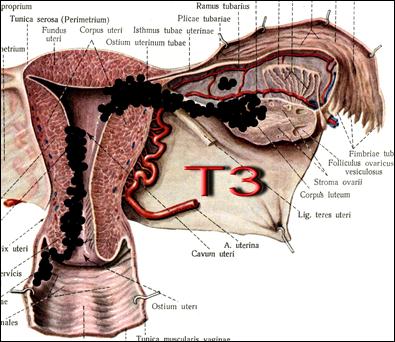
Рис. 29. Стадирование злокачественного новообразования тела матки по символу T. Переход опухоли на стенку влагалища, выход за пределы матки (Т3).
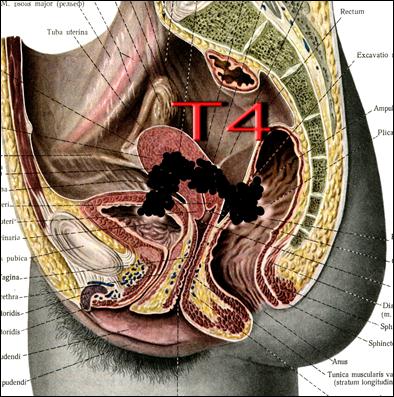
Рис. 30. Стадирование злокачественного новообразования тела матки по символу T. Непосредственное прорастание опухолью слизистой мочевого пузыря и/или прямой кишки. (Т4).
N - регионарные лимфатические узлы Nx - недостаточно данных для оценки состояния регионарных лимфатических узлов; No - нет признаков поражения метастазами регионарных лимфатических узлов; N1 - метастазы в регионарных лимфатических узлах; М - отдаленные метастазы Mх - недостаточно данных для определения отдалённых метастазов; M0 - нет признаков отдалённых метастазов; M1 - имеются отдалённые метастазы. Гистопатологическая дифференцировка (G) Gх – степень дифференцировки не может быть установлена; G1 – высокая степень дифференцировки; G2 – средняя степень дифференцировки; G3 – низкая степень дифференцировки. Группировка по стадиям с учетом вышеназванных критериев представлена в таблице 4. Таблица 4 Группировка рака эндометрия по стадиям развития процесса
2.8. Лечение рака эндометрия Наиболее часто компонентами комбинированной терапии рака эндометрия является оперативный этап и лучевая терапия. Минимальным радикальным объёмом для данной патологии является экстирпация матки с придатками, но имеется ряд особенностей, когда выбирается более агрессивное вмешательство. Так, при опухоли, ограниченной телом матки, но расположенной в нижней трети её полости, значительно повышается риск метастазирования в регионарные лимфоузлы. Такой же риск мы отмечаем и при наличии низкодифференцированных форм опухолей. В этом случае имеются прямые показания для выполнения расширенной экстирпации матки с лимфаденэктомией, а при распространении опухоли на цервикальный канал особенности её метастазирования начинают напоминать таковые при раке шейки матки, поэтому необходимым вмешательством в данном случае будет являться операция Вертгейма. Европейские программы лечения данной патологии во всех случаях рекомендуют выполнять расширенную экстирпацию матки по Вертгейму. Лучевой компонент реализуется чаше всего в виде сочетанной лучевой терапии. Лечение начинается через 10-14 дней после операции и проводится в виде дистанционной гамма-терапии на область малого таза и регионарного лимфооттока (40-46 Гр в зависимости от дифференцировки опухоли) и внутриполостной гамма-терапии на стенку и купол влагалища с помощью кольпостата до 12-21 Гр. У пациенток, имеющих противопоказания к оперативному лечению (экстрагенитальная патология), проводится сочетанная лучевая терапия в самостоятельном варианте. Химиотерапия становится частью комплексного лечения карцином эндометрия при местнораспространённых и распространённых формах опухоли. Схемой выбора является САР (циклофосфан, адриабластин, цисплатин). Первые успехи гормонотерапии в онкологии были получены при лечении больных с распространённым раком эндометрия, имеющим метастазы в лёгкие. Именно использование препаратов с прогестагенной активностью показало высокую эффективность в отношении опухолей с сохранённым рецепторным аппаратом к половым стероидам. Гестагены могут быть использованы у пациенток с опухолью эндометрия более чем Т1аN0M0 и наличием G1-2 (либо наличием в опухоли рецепторов к эстрадиолу и прогестерону). Для лечения могут быть использованы следующие схемы: гестонорон капронат (депостат) по 200 мг в/м 1 раз в неделю; медроксипрогестерон ацетат (провера, фарлутал) по 200-800 мг внутрь ежедневно; депо-провера по 500-1500 мг в/м еженедельно; 17 ОПК по 500-1000 мг в/м 2-3 раза в неделю; мегестрол ацетат (мегейс) по 160-320 мг в день. Кроме гестагенов в схемы могут быть включены антиэстрогены (тамоксифен). Продолжительность лечения составляет, как правило, от 6 месяцев до 2 лет. Гормонотерапия может назначаться пожизненно, при III-IV стадиях, а также при рецидивах и метастазах рака тела матки. Исследования последних лет указывают на наличии раскола среди авторов относительно адъювантной гормонотерапии. Поскольку продолжительность жизни таких пациенток не изменяется, а количество тромботических осложнений увеличивается, частота профилактического назначения гестагенов в последнее время снижается. Наблюдение за пациентками в условиях поликлиники онкологического диспансера проводится в 1-ый год после лечения - 1 раз в 3 месяца, со второго по четвёртый годы после лечения - 1 раз в 6 месяцев, а затем 1 раз в год.
2.9. Контрольные вопросы 1. Приведите эпидемиологические показатели рака тела матки в Омском регионе? 2. Перечислите факторы риска злокачественных заболеваний тела матки. 3. Какова последовательность диагностических процедур (алгоритм) при подозрении на злокачественный процесс тела матки? 4. В чём состоит основное отличие между фоновой и предраковой патологией тела матки? 5. По каким критериям осуществляется классификация рака эндометрия? 6. Охарактеризуйте европейские программы лечения опухолей тела матки. 7. В каких случаях имеются противопоказания к оперативному лечению опухолей тела матки?
2.10. Тестовые задания
Задание с выбором одного правильного ответа 1. Злокачественные заболевания тела матки характеризует следующее утверждение: а) В структуре онкогинекологической заболеваемости находятся на лидирующих позициях, занимают третье место в структуре смертности от данных заболеваний. б) В структуре онкогинекологической заболеваемости и смертности занимают второе место. в) Это наиболее редко встречающиеся онкогинекологические опухоли, но занимающие лидирующие позиции по смертности. г) Этим опухолям принадлежат лидирующие позиции в структуре заболеваемости и смертности.
Задание с выбором одного правильного ответа 2. Рассматривая стадийную диагностику злокачественных опухолей тела матки, можно утверждать, что в России: а) Соотношения суммы I-II и III-IV стадий заболевания примерно равны. б) Опухоли диагностируются преимущественно в III-IV стадиях. в) Опухоли диагностируются преимущественно в I-II стадиях. г) Ни одно из утверждений не верно.
Задание с выбором одного правильного ответа 3. Истинным предраком эндометрия следует считать а) полипы эндометрия б) железисто-кистозную гиперплазию эндометрия в) атипическую гиперплазию эндометрия г) CIN
Задание с выбором одного правильного ответа 4. Наиболее частыми симптомами злокачественных опухолей эндометрия в постменопаузе является а) маточное кровотечение б) обильная менструация в) аменорея г) увеличение живота за счёт асцита
Задание с выбором одного правильного ответа 5. Преморбидным фоном для злокачественных опухолей эндометрия следует считать а) артериальную гипертензию б) сахарный диабет в) ожирение г) верны все ответы
Задание с выбором одного правильного ответа 6. Гистологическим вариантом злокачественной опухоли эндометрия чаще является: а) аденокарцинома б) плоскоклеточный рак в) гиперплазия эндометрия г) лимфома
Задание с выбором одного правильного ответа 7. Методологической базой скрининга для опухолей эндометрия в постменопаузе может являться: а) тазовая эхография б) гистероскопия в) исследование СА – 125 г) исследование SCC
Задание с выбором одного правильного ответа 8. Наиболее важным эхографическим признаком патологии эндометрия в постменопаузе является а) наличие миомы матки б) изменения соотношения между телом и шейкой матки в) увеличение толщины М-эха более 4 мм г) наличие кисты яичника Задание с выбором одного правильного ответа 9. Термин «раздельное выскабливание» означает, что а) следует разделить соскоб из полости матки на несколько порций б) следует выполнить выскабливание эндоцервикса, а затем полости матки в) следует выполнить выскабливание полости матки, а затем эндоцервикса г) следует выполнить вначале штрих-биопсию эндометрия, а затем биопсию шейки матки
Задание с выбором одного правильного ответа 10. Регионарными лимфатическими узлами для тела матки считают а) паховые и влагалищные лимфоузлы б) лимфоузлы малого таза. в) паховые, тазовые, парааортальные лимфоузлы г) все лимфоузлы, доступные пальпации
Задание с выбором одного правильного ответа 11. Опухоль эндометрия, ограниченная телом матки, классифицируется как а) Т1 б) Т2 в) Т3 г) Т4
Задание с выбором одного правильного ответа 12. При злокачественной опухоли эндометрия распространение на яичник следует расценивать как: а) М1 б) N1 в) Т4 г) Т3
Задание с выбором одного правильного ответа 13. При распространении опухоли эндометрия на цервикальный канал следует провести операцию в объёме а) экстирпации матки с придатками б) расширенной экстирпации матки с придатками и тазовой лимфадеэктомией по Вертгейму в) ампутации матки с придатками г) электрохирургической аблации эндометрия
Задание с выбором одного правильного ответа 14. В большинстве случаев при раке эндометрия I стадии проводится а) только операция б) только лучевая терапия в) операция с последующей лучевой терапией (комбинированное лечение) г) операция с последующей лучевой и химиотерапией (комплексное лечение)
Задание с выбором одного правильного ответа 15. При раке эндометрия в адъювантном режиме может быть использована гормонотерапия а) глюкокортикоидами б) инсулином в) эстрогенами г) гестагенами
Задание с выбором одного правильного ответа 16. Наиболее неблагоприятно протекают опухоли эндометрия а) развивающиеся по первому (гормонозависимому) варианту по Бохману б) развивающиеся по второму (гормононезависимому) варианту по Бохману в) опухоли, ограниченные пределами эндометрия г) все опухоли эндометрия имеют крайне неблагоприятное течение
2.11. Рекомендуемая литература
1. TNM Атлас: Иллюстрированное руководство по TNM классификации злокачественных опухолей / К.Виттекинд, Ф.Л.Грин и др. Под ред. Ш.Х.Ганцева. – М.: «Медицинское информационное агентство», 2007. c.224 – 274. 2. Бохман Я.В. Лекции по онкогинекологии.- М.: ООО «Медицинское информационное агентство», 2007. – 304 с. 3. Ганцев Ш.Х. Руководство к практическим занятиям по онкологии.– М.: Медицинское информационное агентство, 2007. c.360 – 368. 4. Давыдов М.И. Энциклопедия клинической онкологии: Руководство для практикующих врачей / М.И.Давыдов, Г.Л.Вышковский и др. – М.: РЛС, 2005. – 1536 с. 5. Онкология: национальное руководство/ под редакцией В.И.Чиссова, М.И.Давыдова. – М.: ГЭОТАР-Медиа. 2008. c. 812 – 848. 6. Онкология: учебник с компакт диском /под редакцией В.И.Чиссова, С.Л.Дарьяловой. – М.: ГЭОТАР – Медиа, 2007. c.448 – 470. 7. Практическая онкология: избранные лекции /под редакцией С.А.Тюляндина и В.М.Моисеенко. – Санкт-Петербург: Центр ТОММ, 2004. – 784 с 8. Справочник по классификации злокачественных опухолей. Официальные рекомендации Американской объединенной комиссии по злокачественным новообразованиям/Перевод с английского. – С.- Пб.: Медакадемия, 2007. c.256 – 305. 9. Здравоохранение Омской области 2007 году: Стат. Сб./ Омскстат.- Омск, 2007. – 63 c. 10. Минимальные клинические рекомендации европейского общества медицинской онкологии (ESMO). М.: Издательская группа РОНЦ им. Н.Н. Блохина РАМН, 2007. – 146с. 11. Шайн А.А. Онкология: Учебник для студентов медицинских вузов. – Тюмень: Изд. центр «Академия», 2007. 12. Онкологическая помощь населению / под редакцией В.М.Мерабишвили. – С.Пб, 2001 – 199 с. 13. Ошибки в клинической онкологии: Руководство для врачей / под ред. В.И.Чиссова, А.Х.Трахтенберга. – М.: Медицина, 2001. – 544с. 14. Elagoz S, Arici DS, Aker Н. Relationship between FIGO grade and AgNOR, SIOO-positive langerhans cells in endometrial adenocarcinoma. \\ Pathol Int 2000 Aug;50(8):616-9Related Articles, Books, LinkOut. 15. Scully R.E., Bonfiglio T.A., Kurman R.J. et at. Uterine corpus// In: Histological Classification of Female Genital Tract Tumours- WHO- New York.Springer-Verlag.-1994.-P.13-31 Модуль 3. РАК ЯИЧНИКОВ
Brettes et Dufour. Faculte de medecin de Strasbourg: Prs. Марьенко А.С. ассистент кафедры онкологии ОмГМА, к.м.н.
Требования к уровню усвоения содержания учебного материала
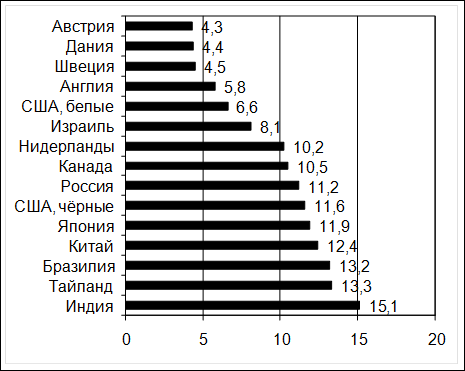
3.1. Эпидемиология Пристальное внимание, уделяемое проблемам лечения больных раком яичников, объясняется не только частотой встречаемости этого заболевания. Занимая третье место в структуре онкогинекологической патологии, рак яичников удерживает лидирующие позиции среди причины смерти у онкогинекологических больных. Так, по данным МАИР (Международного агентства по изучению рака), ежегодно в мире регистрируется 166000 новых случаев этой патологии и из них 100000 женщин умирает в течение первого года. Встретить ЗНО яичников у женщин можно практически в любом возрасте (как у новорождённых девочек, так и у женщин после 80 лет). Отсутствие выраженных клинических признаков, поздняя обращаемость к врачу, недостаточная диагностическая база и ошибки в ведении этих больных являются основными причинами того, что у 2/3 больных первично диагностируется местнораспространённый и распространённый рак яичников. Внедрение дорогостоящих диагностических и лечебных мероприятий в III и IV стадиях заболевания не могут значительно изменить показателей лечения и выживаемости этих больных. В ранней диагностике важно не только своевременное «появление» больного, но и технология его обследования. Известно, что около половины больных первоначально обращаются к врачам общей практики (хирургам, терапевтам); правильный диагноз в этом случае устанавливается у 17-20% больных. Неутешительно, что при обращении к гинекологам 50% заболеваний также остаются нераспознанными. Злокачественные опухоли репродуктивной системы (рак молочной железы и гинекологические опухоли - рак тела, шейки матки и яичников) являются наиболее частыми в структуре онкологической заболеваемости женщин, и их суммарная доля превышает 35%. Рак яичников составляет 4-6% среди злокачественных опухолей у женщин и занимает седьмое место по частоте. Если удельный вес рака яичников в онкологической заболеваемости женщин во всех странах мира примерно одинаков, то частота заболеваемости на 100000 женского населения значительно варьирует. В Европе, особенно в Северных странах и Великобритании, а также в Северной Америке, стандартизованные показатели заболеваемости наиболее высокие (10 и более на 100000). В Центральной и Южной Америке, Африке и Азии, включая индустриальные страны, такие как Япония, но исключая Израиль, эти показатели значительно ниже (7 и менее на 100000) (рис. 31).
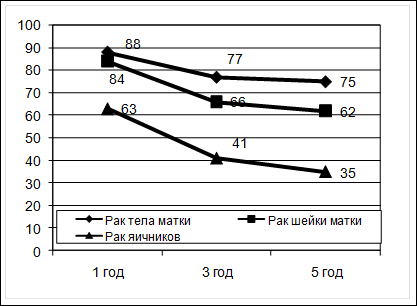
Рис. 31. Стандартизованные показатели заболеваемости раком яичников в мире За последние 20 лет уровни заболеваемости раком яичников в большинстве стран с высоким риском (Скандинавия, Великобритания, США, Канада) остаются стабильными и даже несколько снижаются. В то же время отмечено повышение заболеваемости в странах с низким риском, таких как Япония, Индия, Сингапур, а также в некоторых странах Южной и Восточной Европы (Португалии, Испании, Югославии, Польше). В России ежегодно рак яичников выявляется более чем у 11000 женщин (10,17 на 100000). За последние 10 лет в стране произошел прирост заболевания на 8,5%. Интерпретация трендов в заболеваемости раком яичников крайне затруднительна, особенно в экономически развитых странах. С одной стороны, необходимо учитывать широкое применение оральных контрацептивов и факторов, обладающих протективным эффектом, как роды и лактация. С другой стороны, сокращение в цивилизованных странах числа беременностей и родов, приводящее к «непрекращающейся овуляции», способствует, возможно, повышению риска развития неоплазии в яичнике, как и применение препаратов, стимулирующих овуляцию в лечении бесплодия, и эстрогенов в терапии климактерических расстройств. Кроме того, нельзя не учитывать и фактора питания. Увеличение животных белков в рационе питания не исключает увеличения риска заболевания раком яичников. В большинстве индустриальных стран мира рак яичников имеет самые высокие показатели смертности среди всех гинекологических опухолей, что связано с поздней диагностикой заболевания. По сводным данным популяционных раковых регистров стран Европы, 1-летняя выживаемость больных раком яичников составляет 63%, 3-летняя - 41%, 5-летняя - 35%. На рисунке 32 представлены показатели выживаемости больных основными гинекологическими опухолями.
Рис. 32. Относительная выживаемость больных гинекологическим раком по сводным данным популяционных раковых регистров Европы в 1990-е годы (в %). Практическая онкология: избранные лекции /под редакцией С.А.Тюляндина и В.М.Моисеенко. – Санкт-Петербург: Центр ТОММ, 2004. – 784 с За последнее десятилетие отмеченное в Европе увеличение 5-летней выживаемости больных злокачественными опухолями яичников на 3% (с 32 до 35%), а в США - на 4% (с 36 до 39%) объясняется не столько улучшением диагностики, сколько эффективным применением химиотерапии в лечении диссеминированных форм рака яичников и герминогенных опухолей. Рассматривая онкогинекологические показатели заболеваемости и смертности в Омской области за 5 лет (с 2003 по 2007 годы) можно сказать, что в целом основные тенденции соответствуют Российским и мировым. Успех лечения и прогноз дожития больных всецело зависит от стадии развития злокачественного процесса и своевременности диагностики. К сожалению, статистика свидетельствует, что опухоль выявляется в III-IV стадиях настолько часто (до 40%), что на долю так называемых ранних форм приходится ничтожно малое количество случаев, в основном диагностируемых случайно. Именно количеством диагностируемых у больных ранних опухолей определяются хороший прогноз их полного излечения.
3.2. Молекулярная генетика рака яичников Наследственным факторам еще десять лет назад не придавали особого значения, хотя отдельные указания на существование семейной предрасположенности к данному заболеванию появились довольно давно. Сегодня роль генетической составляющей в патогенезе РЯ не вызывает сомнений. Суть молекулярно-генетических изменений в опухолях сводится к трём компонентам: 1) активирующие мутации в онкогенах; 2) инактивирующие мутации в антионкогенах; 3) геномная нестабильность. Онкогены кодируют белки, играющие важную роль в процессах позитивной регуляции клеточного деления и дифференцировки; если их экспрессия избыточна или протекает в измененном виде, то это индуцирует неконтролируемую пролиферацию клеток. Гены-супрессоры, называвшиеся до недавнего времени антионкогенами, ответственны за синтез белков, осуществляющих негативный контроль клеточного деления или индукцию апоптоза. В противоположность онкогенам функционально значимые мутации в супрессорных генах носят инактивирующий характер. Соматические мутации. Одним из наиболее изученных онкогенов, активация которого достаточно часто обнаруживается при раке яичников, является ген K-ras. Продукт гена K-ras относится к классу G-белков и участвует в самых разнообразных аспектах регуляции клеточных процессов. Мутации K-ras встречаются значительно чаще в муцинозных, по сравнению с немуцинозными РЯ, что позволяет обсуждать перспективность данного теста для дифференциальной диагностики. Другой онкоген, к которому привлечено в последние годы пристальное внимание, - это c-erbB2/HER2, кодирующий мембранный гликопротеид семейства рецепторов эпидермального фактора роста. Гиперэкспрессия данного гена наблюдается в 10-50% случаев. Во многих работах показано, что активация c-erbB2/HER2 указывает на неблагоприятный прогноз течения рака яичника. Существенное место в патогенезе РЯ принадлежит супрессорному гену р53. Продукт гена р53 отвечает за самоустранение клеток, получивших критические повреждения ДНК. Инактивация р53 наблюдается примерно в половине опухолей РЯ. Нарушения в различных генах клеточного цикла, по-видимому, могут иметь весьма сходные функциональные проявления. Известно, что регуляция клеточного цикла находится под контролем белкового комплекса, состоящего из циклинов и циклин-зависимых киназ (Cdk). Считается, что активирующие события в генах циклинов и Cdk имеют онкогенный эффект, в то время как Cki выступают как гены-супрессоры. В последние годы внимание широкого круга специалистов, в том числе и онкологов, привлечено к ферменту теломеразе. Основная функция теломераз состоит в препятствовании укорочению концевых участков хромосом в процессе деления клеток. Установлено, что при многих типах опухолей наличие активной теломеразы коррелирует с неблагоприятным прогнозом. Теломеразная активность обнаруживается в 92% карцином яичника. При этом следует заметить, что наиболее высокая активность фермента обнаруживается в низкодифференцированных карциномах. Роль генного полиморфизма в патогенезе рака яичников. Предполагается, что некоторые варианты генов, продукты которых участвуют в синтезе андрогенов и эстрогенов, могут несколько увеличивать риск новообразований репродуктивной сферы. В частности, к кандидатам относятся гены группы цитохрома р450 (CYP1A1, CYP17 и CYP19). Значительный интерес представляют гены, ответственные за метаболизм эндогенных и экзогенных канцерогенов, например группы полициклических ароматических углеводородов (ПАУ). В метаболизме ПАУ ключевая роль принадлежит ферментам группы цитохрома р450. Полиморфизм этих генов может участвовать в формировании целого ряда новообразований. Молекулярная генетика наследственного рака яичников. Хотя семейные раки яичника достаточно редки, их молекулярная генетика изучена значительно лучше по сравнению со спонтанными опухолями. Эпидемиологические исследования и анализ семейной истории РЯ позволили выявить, что около 10% случаев эпителиального РЯ обусловлены передаваемыми в поколениях генетическими изменениями. В настоящее время описаны две независимые формы наследственного РЯ: 1) синдром рака молочной железы и яичников, на который приходится 90-95% всех случаев наследственного РЯ; 2) синдром, ассоциированный с высокой семейной встречаемостью рака толстой кишки и раком эндометрия (5-10% случаев). Успехи молекулярной генетики привели к разработке методик прямого обнаружения случаев наследственного РЯ (табл. 5). Таблица 5 Молекулярно-генетические детерминанты наследственного рака яичников
Как показывает генетический анализ, большинство случаев наследственного РЯ связано с врождёнными мутациями гена BRCA1 и гена BRCA2. Синдром неполипозного семейного рака толстой кишки в сочетании с РЯ и раком эндометрия определяется наличием наследственного дефекта в каком-либо из пяти известных генов, MSH2, МLH1, MSH6, PMS2 или PMS1. В заключение остановимся коротко на том, какое клиническое значение имеют данные о наследственной природе определенной группы опухолей яичников. Накопленные к настоящему времени результаты исследований не дают еще полного представления об особенностях течения и прогнозе наследственного РЯ. Не вызывает сомнений, что BRCA-1 - ассоциированный РЯ морфологически относится к серозному типу и диагностируется обычно у более молодых женщин. Кроме того, создается впечатление, что в случае BRCA мутаций опухоли проявляют несколько большую чувствительность к химиотерапии. Идентификация мутаций в генах наследственных раковых синдромов имеет решающее значение для превентивной медицины. Предполагается, что лабораторные генетические тесты позволят сфокусировать мероприятия, направленные на раннюю диагностику новообразований, именно на тех лицах, которые в них больше всего нуждаются. В частности, обнаружение зародышевых мутаций, ассоциированных с семейным РЯ, свидетельствует о необходимости учащённых ультразвуковых обследований органов брюшной полости, пристального внимания за состоянием молочных желёз. В некоторых случаях ставился вопрос о целесообразности профилактической овариэктомии и мастэктомии. По данным исследований, проведённых на базе Омского областного онкологического диспансера, установлено, что у больных с запущенными формами рака яичников пре- и постменопаузального периода отмечается выраженная иммунная дисфункция, характеризующаяся как количественными, так и функциональными нарушениями Т-клеточного иммунитета. Кроме того, при этом: 1) снижались показатели субклассов Ig G1, IgG2, IgG3 в 3,2-4,8 раза; 2) С4 комплемента в 2,5 раза; 3) лактоферрина в 5,7-7,0 раз по сравнению с контрольной группой; 4) уровень ЦИК превышал показатели контрольной группы в 1,6-1,7 раза. Подводя краткий итог, можно заключить, что в последние годы наши знания о молекулярных механизмах туморогенеза яичников существенно изменились. Хотя многие детали этого сложнейшего процесса остаются не до конца ясными, стало очевидным, что формируются научные основы повышения эффективности диагностики и лечения данной группы злокачественных новообразований. 3.3. Клинические проявления рака яичников Клиническая картина рака яичников обусловлена анатомическими особенностями и морфологической структурой опухоли: 1) яичники свободно расположены в брюшной полости на довольно длинной ножке, которая гипертрофируется с увеличением овариального образования. Рост опухоли, как правило, не сопровождается сдавлением рядом расположенных органов, и клиническая картина может длительное время отсутствовать; 2) яичник не имеет серозной оболочки, следствием чего является быстрое имплантационное метастазирование по органам брюшной полости; 3) яичник содержит элементы всех трёх зародышевых листков и таким образом имеет исходные зачатки для развития любой злокачественной опухоли. Можно выделить 2 группы симптомов и синдромов, характерных для злокачественных опухолей яичников: 1) общие неспецифичные – характерны для любого морфологического варианта опухоли; 2) специфичные – связаны с особенностями морфологического строения опухоли. Подробно остановимся на общих неспецифичных симптомах и синдромах. Увеличение живота. Является наиболее частым симптомом при раке яичников. Увеличение живота может происходить как за счёт асцита или значительных размеров опухоли, так и за счет обоих этих факторов. Нередко с увеличением живота пациентка отмечает похудание верхних и нижних конечностей. Реже больная самостоятельно обнаруживает опухоль в животе. Болевой синдром. Может существенно варьировать по характеру и интенсивности в зависимости от механизма его возникновения: 1) чаще всего болевой синдром не выражен и проявляется неопределённого характера болью в различных отделах живота, небольшой интенсивности. Больная предъявляет жалобы на дискомфорт, тяжесть, чувство распирания в животе; 2) при возникновении некроза капсулы опухоли боль усиливается и пациентка может конкретно указать область живота, где её беспокоят довольно интенсивные боли режущего характера. При пальпации боль усиливается и может быть локальный симптом Щёткина; 3) периодически возникающие схваткообразные боли в животе, сопровождающиеся его вздутием, характерны для хронической кишечной непроходимости. Причиной данного болевого синдрома является сдавление и/или врастание метастазов опухоли, реже первичного очага, в различные отделы кишечника; 4) внезапно возникшие острые боли в низу живота, высокой интенсивности, режущего характера, с иррадиацией в прямую кишку и крестец характерны для перекрута ножки опухоли и могут быть первым признаком заболевания. Одышка. Нередкий симптом заболевания. Причиной одышки являются: 1) значительное увеличение живота, асцит, сопровождающиеся существенным подъёмом купола диафрагмы, что влечёт за собой уменьшение жизненной ёмкости лёгких и разворот сердца от физиологической оси с нарушением функции сердечной деятельности; 2) плеврит, причиной которого зачастую бывает канцероматоз плевры; 3) анемия, которая связана с большим объёмом опухолевой ткани и резорбцией продуктов распада и жизнедеятельности опухоли, а также с нарушением функции органов желудочно-кишечного тракта вследствие их сдавления и вторичного поражения опухолью. Повышение температуры тела. У большинства пациенток это связано с некрозом опухоли и/или её капсулы, более редкая причина – метастатическое поражение печени, лёгких и плевры. Кровянистые выделения из половых путей. Появление кровянистых выделений обусловлено: 1) прорастанием опухоли в матку; 2) гормональной активностью опухоли яичника и связанными с ней гиперпластическими процессами эндометрия, которые сопровождаются дисфункциональными маточными кровотечениями и кровотечениями в менопаузе; 3) наличием первично-множественной злокачественной опухоли тела или шейки матки.
3.4. Диагностика рака яичников По литературным данным, причинами врачебных ошибок при диагностике рака яичников являются недостаточное знание семиотики злокачественных опухолей и тактические, состоящие в длительном наблюдении больной без уточнения диагноза, а именно: 1) длительное наблюдение за больными с «небольшими» кистами яичников; 2) длительное безуспешное проведение противовоспалительной терапии при аднекстуморах; 3) длительное наблюдение за больными с предполагаемым диагнозом узловатой миомы матки; 4) длительное наблюдение за больными с опухолями в малом тазу неясной локализации; 5) непатогномоничные для гинекологических заболеваний признаки (нелокализованная боль в брюшной полости, немотивированная слабость, расстройства диспепсического характера, нарушение функции мочевых органов, субфебрильная температура, повышение СОЭ), которые не связываются с опухолями яичников; 6) недиагностированные небольшие раковые опухоли яичников, которые могут давать массивные метастазы и сопровождаться асцитом. Такие пациентки нуждаются в тщательном комплексном обследовании, вплоть до диагностической лапаротомии.
Дата добавления: 2015-02-05 | Просмотры: 1880 | Нарушение авторских прав |
 б
б