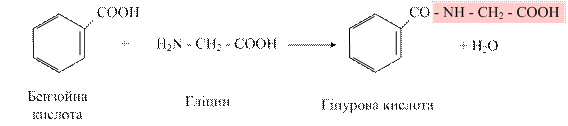|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Порушення біохімічних процесів у печінці при окремих захворюванняхПечінкова енцефалопатія – симптомокомплекс порушень діяльності ЦНС, який виникає при печінковій недостатності. Причинами виникнення цієї патології можуть бути гострі (вірусні та медикаментозні гепатити, алкогольна інтоксикація, ураження печінки промисловими та виробничими токсинами тощо) та хронічні (гепатити, цирози, природжені порушення обміну жовчних кислот тощо) захворювання та злоякісні новоутвори печінки. Ключова роль у розвитку печінкової енцефалопатії належить порушенню знешкоджувальної функції печінки та впливу на мозок токсичних речовин, найбільшою мірою – аміаку та меркаптанів. Механізм токсичного впливу аміаку на головний мозок полягає в зменшенні утворення та використання клітинами мозку АТФ; зниженні вмісту нейромедіатора g-аміномасляної кислоти; збільшенні концентрації амінобутирату, який володіє властивостями нейроінгібітора. У розвитку печінкової енцефалопатії важливе значення має накопичення в крові інших церебротоксичних речовин: сірковмісних амінокислот (тауринова кислота, метіонін, цистеїн), продуктів окиснення метіоніну (метіонінсульфон, метіонінсульфоксид), продуктів метаболізму триптофану (індол, індоліл), коротколанцюгових жирних кислот (масляна, валеріанова, капронова), похідних піровиноградної кислоти. у зв’язку з тим, що печінкова недостатність супроводжується посиленим катаболізмом білка та використанням у якості енергетичного джерела амінокислот із розгалуженим ланцюгом (валіну, лейцину, ізолейцину), у кров’яне русло надходить значна кількість ароматичних амінокислот (фенілаланіну, тирозину, триптофану), метаболізм яких за умов норми відбувається в печінці. Ароматичні амінокислоти є попередниками «неправдивих» нейромедіаторів – октоплазміну, b-фенілетиламіну, тираміну, які конкурують з нормальними медіаторами (норадреналіном, дофаміном, адреналіном) і спричинюють пригнічення діяльності нервової системи та розвиток енцефалопатії. Найтяжчою стадією цієї патології є печінкова кома. Гострий гепатит – велика група ушкоджень печінки запального характеру. найчастішою причиною цього захворювання є віруси (вірусний гепатит А, В, С, Е тощо), дія лікарських препаратів (похідні ізонікотинової кислоти, інгібітори моноамінооксидази), промислових отрут (фосфор, фосфорорганічні інсектициди), отруйні гриби (бліда поганка), великі дози алкоголю. Гострий гепатит може виникнути і як наслідок радіаційного ураження, тяжких інфекційних захворювань, токсикозу вагітних. ключову роль у пошкодженні гепатоцитів при вірусному гепатиті відіграє взаємодія між імунною системою господаря (клітинна та гуморальна відповіді), вірусними антигенами та зміненою антигенами (внаслідок інфекції) плазматичною мембраною гепатоцитів. Порушення структурної цілісності клітин печінки супроводжується зростанням в крові активності низки ферментів (АсАТ, АлАТ, ізоформ ЛДГ4 та ЛДГ5, фруктозо-1-фосфатальдолази, сорбітдегідрогенази тощо), підвищенням концентрації ціанокобаламіну та заліза, виникненням гіпербілірубінемії (за рахунок прямого білірубіну). Про деструкцію субклітинних структур гепатоцитів свідчить висока активність у сироватці крові глутаматдегідрогенази (ГлДГ) і аспартатамінотрансферази (мАсАТ), які за умов норми локалізуються в матриксі мітохондрій. Тривале систематичне вживання алкогольних напоїв спричинює розвиток алкогольної хвороби печінки, яка характеризується порушеннями її структури та функцій. Спожитий алкоголь (90 – 98 %) окиснюється в печінці з утворенням ацетальдегіду та подальшим його послідовним перетворенням на ацетатну кислоту та ацетил-КоА. Перетворення етанолу на ацетальдегід відбуваються завдяки наявності в гепатоцитах трьох ферментних систем: алкогольдегідрогеназної (АлДГ), яка знаходиться в цитозолі і для функціонування якої необхідний НАД+; цитохром-Р-450-залежної мікросомальної системи, яка локалізується в агранулярному ендоплазматичному ретикулумі гепатоцитів; каталазної системи, яка знаходиться в пероксисомах цитоплазми та мітохондріях. Перетворення ацетальдегіду на ацетил-КоА відбувається за участі мітохондріальної ацетальдегіддегідрогенази, згодом ацетил-КоА включається в цикл Кребса та окиснюється до СО2 і Н2О. Окиснення невеликої кількості алкоголю відбувається, здебільшого, за допомогою системи АлДГ, гіперфункціонування якої призводить до зростання співвідношення НАДН/НАД+, що зумовлює гіперлактатемію, посилення синтезу жирних кислот і зниження їх b-окиснення в печінці, кетонемію та кетонурію, гіпопротеїнемію. В окисненні великої кількості алкоголю беруть участь переважно мікросомальна та каталаза системи, гіперфункціонування яких супроводжується проліферацією ендоплазматичного ретикулуму, збільшенням секреції ліпопротеїдів, гіперліпідемією, гепатомегалією, ожирінням печінки. Хронічне вживання алкоголю призводить до неспроможності мітохондрій окиснювати ацетальдегід, зростає дисбаланс між його утворенням і деградацією. Ацетальдегід у 30 разів токсичніший за етанол, він стимулює пероксидне окиснення ліпідів і порушує відновлення глутатіону, що сприяє утворенню та накопиченню вільних радикалів, які пошкоджують гепатоцити та їх структури; порушує функціонування ферментів, зв’язаних із мембранами гепатоцитів; пригнічує печінкову секрецію; сприяє утворенню алкогольного гіаліну, який, своєю чергою, викликає автоімунні реакції. Надлишок ацетил-КоА спричинює надмірний синтез ліпідів, посилюється естерифікація вільних жирних кислот на тригліцериди, що сприяє ожирінню печінки (стеатозу). Надмірний синтез проколагену І типу та фібронектину спричинюють розвиток фіброзу, а згодом – цирозу печінки. Хронічний гепатит – це широко розповсюджене поліетіологічне ураження печінки запального та дистрофічного характеру з помірно вираженим фіброзом без порушення архітектоніки печінки. Найчастіше причиною хронічного гепатиту є перенесений гострий вірусний гепатит, а також неповноцінне харчування, хронічний алкоголізм, патологія жовчовидільної системи, вплив токсичних сполук (хлороформ, сполуки свинцю тощо) та лікарських препаратів (метилдофа, ізоніазид, аміназин тощо). токсичні сполуки безпосередньо впливають на мітохондрії та ендоплазматичний ретикулум гепатоцитів із подальшим розвитком їх некрозу. Біохімічні зміни варіюють у залежності від причин виникнення захворювання. Так, «синдром недостатності гепатоцитів» супроводжується зниженням вмісту в крові тих сполук, які в них синтезуються: альбуміну, протромбіну, фібриногену, холестерину; «синдром ушкодження гепатоцитів» – підвищеною активністю в крові амінотрансфераз, ЛДГ; «синдром запалення» проявляється зростанням у крові різних фракцій глобулінів (переважно a- та g-глобулінів); для «синдрому холестазу» характерна підвищена активність у крові лужної фосфатази, вмісту жовчних кислот, кон’югованого білірубіну, міді. Часті рецидиви захворювання призводять до виникнення цирозу. Цироз печінки – хронічне прогресуюче захворювання, яке характеризується ураженням паренхіми та строми органа зі значним зменшенням кількості функціонуючих гепатоцитів, наростаючим фіброзом, перебудовою нормальної структури паренхіми та судинної системи печінки з подальшим розвитком печінкової недостатності. Причиною виникнення цієї патології можуть бути перенесений вірусний і токсичний гепатити, хронічний алкоголізм, холестаз, нераціональне харчування (дефіцит у харчовому раціоні білків і вітамінів, особливо В1, В6 та фолієвої кислоти) тощо. Біохімічні зміни залежить від тривалості процесу та від ступеня ураження печінки. Так, порушення функції гепатоцитів проявляється, зокрема, гіпоальбумінемією та гіперглобулінемією (γ-фракція), сповільнюється інактивація кортикостероїдів, яка здійснюється переважно гепатоцитами, що при цирозі проявляється відносним гіпоальдостеронізмом. Зростання активності трансаміназ і підвищення вмісту аміаку в крові вказує на появу декомпенсації функцій печінки. При тяжких випадках цирозу спостерігають порушення згортання крові внаслідок зниження вмісту факторів згортання – ІІ, V, VII. Розвиток портальної гіпертензії призводить до виникнення важливих клінічних проявів цирозу – порто-кавальних анастомозів, асциту та спленомегалії, а в тяжких випадках – до розвитку порто-кавальної коми. Жовчокам’яна хвороба – захворювання гепатобіліарної системи, яке виникає внаслідок порушення обміну речовин і характеризується утворенням жовчних каменів у жовчному міхурі (холецистолітіаз), загальній жовчні протоці (холедохолітіаз) і в печінкових жовчних протоках (внутрішньопечінковий холелітіаз). Утворення каміння також має місце при порушенні відтоку жовчі (холестаз) та інфікуванні жовчного міхура. Зазвичай жовчні камені містять кальцію білірубінат, холестерину моногідрат, аморфний або кристалічний вуглекислий кальцій. Внутрішнє ядро каменя складається з білка та містить жовчні пігменти, воно пошарово оточене холестерином (до 90 % загальної маси каміння) і білірубіновокислим кальцієм (приблизно 10 %). Існує два основних види жовчного каміння: пігментне та холестеринове. Пігментне каміння, своєю чергою, поділяють на два підтипи: чорне та коричневе. Чорне каміння, подібне до ягід шовковиці (смокви), складається переважно з кальцію білірубінату та зазвичай знаходиться у жовчному міхурі. Коричного або землистого кольору каміння переважно локалізується в жовчній протоці та містить крім кальцію білірубінату жирні кислоти, які утворюються під дією бактеріальних фосфоліпаз із лецитинів жовчі. Порушення складу жовчі, утворення агрегатів холестерину, дисфункція жовчного міхура є факторами, що сприяють формуванню холестеринового каміння. Нерозчинний у воді холестерин секретується в просвіт канальців у вигляді фосфоліпідних мікровезикул, які під дією жовчних кислот перетворюються на змішані ліпідні міцели. У жовчі, насиченій холестерином, або за умов зниження в ній концентрації жовчних кислот відбувається агрегація холестерину з утворенням великих багатошарових структур, в яких моногідрати холестерину кристалізуються з утворенням ядра. Незважаючи на те, що високий вміст холестерину в жовчі передбачає утворення каміння, однак фактори інгібування агрегації та нуклеації холестерину протидіють процесу каменеутворення. Прикладом можуть служити хворі з високим вмістом холестерину в крові, але без холестеринового каміння в жовчі. ризик утворення холестеринового каміння зростає за умов медикаментозного використання естрогенів і гормональних контрацептивів. При проходженні каменя через жовчну протоку утруднюється відтік жовчі, виникає напад сильного болю, а після нього розвивається жовтяниця, яка має ознаки обтураційної. При тривалому знаходженні в жовчному міхурі камені можуть викликати атрофію та склероз стінки жовчного міхура, у рідкісних випадках – його пролежні та перфорацію. Дискінезії жовчних шляхів – це функціональні порушення тонусу та моторики жовчного міхура та жовчних шляхів внаслідок порушення нейрогуморальної регуляції, які поділяють на гіпертонічно-гіперкінетичні та гіпотонічно-гіпокінетичні. Вони можуть бути прояваминеврозів, гіпо- та гіпертиреозу, недостатності яєчників та надниркових залоз, а також виникають рефлекторно при виразковій хворобі, коліті, апендициті тощо. При біохімічних дослідженнях крові суттєвих змін не відмічають. Гіперкінетична форма дискінезії супроводжується зростанням у жовчі вмісту жовчних кислот і фосфоліпідів, а гіпокінетична – їх зниженням. Концентрація інших компонентів жовчі практично не змінюється. Холецистит – це запалення жовчного міхура вірусного, бактеріального, токсичного або алергійного походження, яке може бути гострим і хронічним. Хронічний холецистит часто виникає у хворих на гастрит і хронічний панкреатит, ожиріння. У фазі загострення спостерігають зростання гострофазних показників у крові: С-реактивного білка, α2-глобулінів, сіалових кислот, фібриногену вмісту холестерину, фосфоліпідів, тріацилгліцеролів, гіперферментемію (зростання активності трансфераз). Суттєвою діагностичною ознакою є зміна міцелярних властивостей жовчі з прогресуючим зниженнямконцентрації холевої та інших жовчних кислот, білірубіну, фосфоліпідів, зростання кількості холестерину та загальних ліпідів. Часто запальний процес у жовчному міхурі слугує поштовхом для утворення там каменів або виникнення гепатиту. Патологічні процеси в печінці та жовчовивідних шляхах нерідко призводять до виникнення ахолічного синдрому, який виникає внаслідок порушення утворення та відтоку жовчі та характеризується повним або частковим припиненням її надходження в дванадцятипалу кишку. Для цього синдрому характерні розлади перетравлення та всмоктування ліпідів внаслідок порушення процесів емульгування жирів, зниження активності панкреатичної ліпази, яка активується жовчю, порушення утворення міцел, які за умов норми всмоктуються в тонкій кишці. Внаслідок цього виникає стеаторея; порушується всмоктування жиророзчинних вітамінів з подальшим розвитком гіповітамінозів А, Е, К; зменшується надходження в організм ненасичених жирних кислот, необхідних для утворення фосфоліпідів клітинних мембран. При цьому зменшуються бактерицидні властивості жовчі, посилюються гнилісні та бродильні процеси в кишці, що призводить до збільшення навантаження на детоксикаційну систему печінки. РОЗДІЛ… БІОТРАНСФОРМАЦІЯ КСЕНОБІОТИКІВ І ЕНДОГЕННИХ ТОКСИНІВ У ПЕЧІНЦІ: МІКРОСОМАЛЬНЕ ОКИСНЕННЯ, ЦИТОХРОМ Р-450
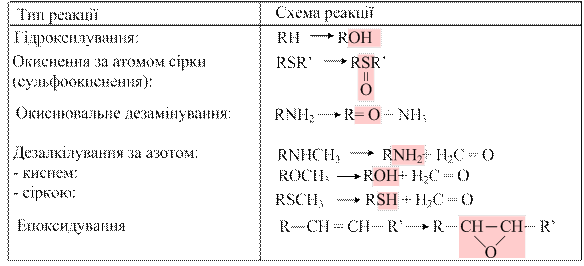
Велике значення для збереження життєдіяльності організму має детоксикаційна функція печінки, завдяки якій відбувається знешкодження низки отруйних для організму речовин, які або утворюються в процесі метаболізму (білірубін, аміак, продукти гниття амінокислот тощо), або потрапляють в організм ззовні (чужорідні сполуки, у тому числі, лікарські препарати). Механізм процесу детоксикації полягає в перетворенні токсичної хімічної сполуки на таку молекулярну форму, яка є менш токсичною, або втрачає токсичні властивості зовсім. Так, знешкодження білірубіну відбувається в печінці шляхом кон’югації з глюкуроновою кислотою з утворенням диглюкуроніду білірубіну, який виводиться в складі жовчі; аміак використовується в орнітиновому циклі і включається в молекулу сечовини, котра виділяється в складі сечі; скатол, який утворюються при розпаді триптофану в товстій кишці, деметилується з утворенням індолу, який шляхом гідроксилування та кон’югації перетворюється на тваринний індикан, виводиться в складі сечі та може слугувати показником інтенсивності процесів гниття білків у травному тракті та функціонального стану печінки. У печінці також відбувається інактивація гормонів: пептидні гормони зазнають гідроксилування протеазами, тироксин у гепатоцитах підлягає трансамінуванню, катехоламіни – окиснювальному дезамінуванню за участі моноамінооксидази, стероїдні гормони гідроксилуються в мікросомальній фракції за участі гідроксилаз. Чужорідні речовини, які можуть потрапляти в організм різними шляхами (через шкіру, дихальні шляхи, травний тракт, кров) теж надходять у печінку, де підлягають модифікації. Біотрансформація ксенобіотиків і ендогенних токсинів. Речовини, які потрапляють в організм із навколишнього середовища (з продуктами харчування, вдихуваним повітрям, через шкіру) і не використовуються ним для побудови тканин організму або як джерела енергії називають чужорідними речовинами, або ксенобіотиками. Вони є об’єктом детального вивчення ксенобіохімії – напрямку досліджень, що вивчає закономірності перетворення ксенобіотиків, до яких належать тяжкі метали, нафтопродукти, фреони, пластмаси, пестициди, миючі засоби, парфумерні вироби, лікарські препарати, харчові добавки тощо. Гідрофільні ксенобіотики виводяться з організму в незміненому вигляді в складі сечі, тоді як гідрофобні, зв’язуючись з білками або утворюючи комплекси з ліпідами клітинних мембран затримуються в тканинах і спричинюють виникнення алергійних реакцій, зниження імунітету, порушення обміну речовин, розвиток специфічних захворювань (у тому числі, професійних хвороб, новоутворів). Біотрансформація ксенобіотиків – це перетворення токсичних речовин екзогенного чи ендогенного походження на полярні водорозчинні метаболіти, які легко виводяться з організму. У метаболізмі ксенобіотиків беруть участь понад 30 ферментів. Цей складний процес складається з двох фаз: мікросомального окиснення та реакцій кон’югації, послідовне функціонування яких забезпечує знешкодження десятків тисяч чужорідних речовин усіх хімічних класів. Метаболізм ксенобіотиків відбувається у найвіддаленіших від ядра та мітохондрій ділянках клітини – ендоплазматичному ретикулумі та гіалоплазмі, а їх виведення з клітини забезпечується р-глікопротеїном, який являє собою транспортну АТФазу. Більш гідрофільні ксенобіотики далі поступають у плазму, а звідти виводяться через нирки у складі сечі; більш гідрофобні, а також ті, що мають велику молекулярну масу, потрапляють у кишку в складі жовчі та виділяються з каловими масами. Реакції мікросомального окиснення. Перша фаза біотрансформації ксенобіотиків відбувається в мембранах ендоплазматичного ретикулуму гепатоцитів за допомогою мікросомальних ферментів (мікросоми – це уламки мембран ендоплазматичного ретикулуму), які каталізують реакції окиснення, відновлення, окиснювального дезамінування, сульфоокиснення, епоксидування, С-гідроксилування, О-, N-, S-дезалкілування тощо з утворенням або вивільненням груп -OH, -COOH, -SН, -NH2 (табл. …). Найпоширенішим є окиснювальне гідроксилування.
Таблиця... Типи реакцій мікоросомального окиснення
Наприклад, гідроксилування карбоциклічних і гетероциклічних сполук відбувається за схемою:
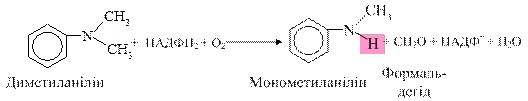
окиснення диметиланіліну:
N-окиснення з утворенням N-оксидів і N-гідроксил амінів:
Сульфоокиснення:
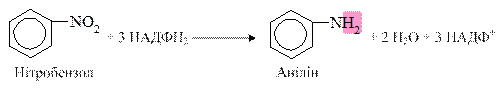
Відновлення нітросполук:
Ферменти, які локалізуються в мембранах ендоплазматичного ретикулуму та формують мікросомальну систему називаються мікросомальними оксидазами. Ті з них, які каталізують відновлення одного атома молекули О2 з утворенням води і включенням другого атома кисню в окиснювальну сполуку, отримали назву мікросомальних монооксигеназ:
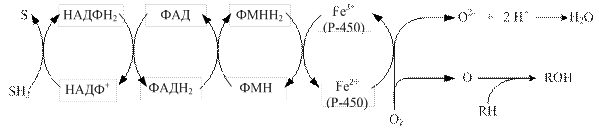
На відміну від мітохондріального окиснення, в якому важливу роль відіграють реакції дегідрування (молекулярний кисень є кінцевим акцептором електронів і протонів лише для утворення води, а виділена енергія акумулюється у вигляді АТФ), у реакціях мікросомального окиснення активний кисень використовується як пластична речовина. Молекули АТФ в цьому процесі не утворюються, енергія використовується для окиснення субстратів, тому роль мікросомального окиснення полягає в гідроксилуванні субстрату, а не в окиснювальному фосфорилуванні. Електронно-транспортні ланцюги ендоплазматичного ретикулуму. У процесі мікросомального окиснення беруть участь два електронно-транспортні ланцюги: перший складається з двох ферментів – НАДФН-Р450-редуктази та цитохрому Р-450, а другий містить фермент НАДН-цитохром-b5-редуктазу, цитохром b5 і стеароїл-КоА-десатуразу. Донором електронів для першого ланцюга слугує НАДФН2, який окиснюється НАДФН-Р450-редуктазою. Цей фермент у якості простетичної групи містить 2 коферменти – ФАД і ФМН, які, своєю чергою, окиснюються цитохромом Р-450 (рис….).
Рис… Схема електронно-транспортного ланцюга ендоплазматичного ретикулуму, донором електронів у якому слугує НАДФН2
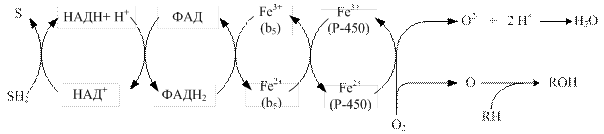
Донором електронів для другого ланцюга слугує НАДН2. Коферментом НАДН-цитохром-b5-редуктази є ФАД, який передає електрони на цитохром b5, що містить у своєму складі залізо. Від нього електрони можуть передаватися на цитохром Р-450 або на стеароїл-КоА-десатуразу, яка, переносячи електрони на кисень з утворенням води, каталізує утворення подвійних зв’язків у жирних кислотах (рис….).
Рис… Схема електронно-транспортного ланцюга ендоплазматичного ретикулуму, донором електронів у якому слугує НАДН2
НАДН-цитохром b5-редуктаза та цитохром b5 не фіксуються на строго визначених ділянках мембрани ендоплазматичного ретикулуму і можуть змінювати свою локалізацію. Індуктори та інгібітори мікросомальних монооксигеназ. Регуляція активності мікросомальної системи в цілому здійснюється на рівні транскрипції. Шляхом індукції можна збільшити кількість ферментів у відповідь на надходження чи утворення в організмі речовин, виведення яких не може відбуватися без участі мікросомального окиснення. Численні індуктори мікросомальних монооксигеназ можна поділити на два класи: до першого належать лікарські препарати (у тому числі, фенобарбітал та інші барбітурати), гормони (кортизол, тироніни, статеві гормони) та інсектициди, а до другого – в основному, поліциклічні вуглеводні бензпірен, метилхолантрен, найпотужнішим серед яких є 2,3,7,8-тетрахлордибензо-р-діоксин (ТХДД). Його ефективна доза становить 1 мкг/кг маси, тоді як інші індуктори діють у значно вищих концентраціях (понад 10 мг/кг). Фенобарбітал спричинює виражену проліферацію гладкого ендоплазматичного ретикулуму в гепатоцитах і зростання активності цитохрому Р-450, у результаті чого підвищується активність таких процесів як деметилування, гідроксилування та епоксидування ксенобіотиків. Індукція, викликана поліциклічними вуглеводнями, не супроводжується проліферацією гладкого ендоплазматичного ретикулуму, але при цьому суттєво зростає активність цитохрому Р-450, трансфераз і гідроксилаз. Інгібітори синтезу білка (пуроміцин, метіонін, циклогексимід) та інгібітори синтезу РНК (актиноміцин Д) блокують індукцію мікросомальних ферментів. Інгібувати дію ферментів мікросомального окиснення за конкурентним механізмом, виступаючи в ролі «альтернативних субстратів», можуть етиловий спирт і нікотинамід, а також реакційноздатні проміжні метаболіти, які одночасно пригнічують активність ферментів кількох типів у місці їх утворення (чотирихлористий вуглець, дихлоретан), недоокиснені продукти обміну, кініни, катехоламіни, альдегіди, кетони, біогенні аміни, низькомолекулярні пептиди, сечовина, сечова кислота, креатинін, левоміцетин і бутадіон, антихолінестеразні засоби. Мікроелемент кобальт пригнічує дію цитохром Р-450-залежних оксидаз шляхом інгібування синтезу гему, який слугує їх простетичною групою. Поєднання з терапевтичною метою кількох лікарських препаратів, які метаболізуються одним мікросомальним ферментом, може призвести до модифікації, посилення або зниження фармакологічного ефекту одного з них або обох одночасно. Генетичний поліморфізм та індуцибельність синтезу цитохрому Р-450. цитохром P-450 – головний компонент мікросомальної системи – належить до гемопротеїнів (молекулярна маса коливається в межах 44 000 – 60 000 Да), у якості простетичної групи містить гем і має ділянки зв’язування для кисню та субстрату (ксенобіотики, стероїди, жирні кислоти тощо). Описана велика кількість генів цитохрому P-450, які кодують різні ізоформи цього фермента. Ізоформи поділяють на сімейства (1, 2, 3 тощо) та підсімейства A, B, C, D, E, у межах яких ізоформи позначають порядковими номерами. У залежності від виконуваних функцій усі ізоформи поділяються на три основних класи: до першого належать цитохроми, що беруть участь у метаболізмі лікарських препаратів і ксенобіотиків (Р-450 1А1, Р-450 1А2, Р-450 1В1 тощо), до другого – ті, ще беруть участь у синтезі стероїдів (Р-450 19А1, Р-450 21А2 тощо), до третього – ті, що беруть участь в інших важливих ендогенних процесах організму (Р-450 27А1, Р-450 1В1 тощо). Незалежно від структури та хромосомної локалізації цитохроми Р-450 поділяють на конститутивні та індуцибельні. Конститутивні ізоформи постійно продукуються клітинами, тоді як експресія індуцибельних може контролюватися різними хімічними сполуками. Індукція цитохрому Р-450 нерідко стає наслідком різних звичок (прийом алкоголю, паління), професійного та екологічного контакту з речовинами (органічні розчинники, діоксини, інсектициди тощо), тривалого прийому лікарських препаратів (барбітурати, антибіотики тощо). Так, деякі цитохроми Р-450 є високо індуцибельними, наприклад, експресія Р-450 1А1 зростає в печінці у понад 100 разів під впливом поліциклічних ароматичних вуглеводнів, Р-450 2Е1 – під впливом етанолу, ацетону, ізоніазиду, імідазолу, Р-450 3А – під впливом синтетичних стероїдів і фенобарбіталу. Слід також зазначити, що в організмі людини абсолютна більшість канцерогенів утворюється з проканцерогенів за участі, основним чином, цитохрому Р-450 1 сімейства, а розвиток псоріазу пов’язують із поліморфізмом цитохрому Р-450 2С19. Система цитохрому р-450 перетворює хлороформ (засіб для загального наркозу) на бойову отруйну речовину фосген, знеболювальний і жарознижуючий препарат парацетамол – на метаболіт N-ацетилімідохінон, який у великих дозах ушкоджує клітини печінки та нирок, тому вказаний препарат з обережністю призначають людям з патологією цих органів.
Реакції кон’югації в гепатоцитах належать до другої фазибіотрансформації та відбуваються за участі відповідних трансфераз (табл. …). При цьому токсичні сполуки стають полярнішими, менш ліпідорозчинними, втрачають свої властивості та швидше виводяться з організму.
Таблиця …. Основні ензими та метаболіти, які беруть участь у реакціях кон’югації
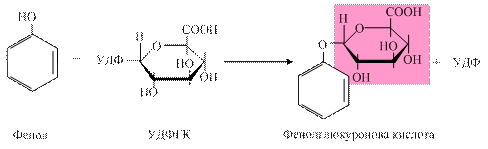
Реакції глюкуронування – основний тип кон’югації в організмі людини та тварин як ксенобіотиків, так і ендогенних субстратів, у яких бере участь активна форма глюкуронату – УДФ-глюкуронова кислота (УДФГК). Вона утворюється шляхом окиснення УДФ-глюкози (УДФГ) НАД-залежною УДФГ-дегідрогеназою: УДФГ + 2 НАД+ ® УДФГК + 2 НАДН2 R-OH + УДФГК ® R-O-глюкуронід + УДФ Фермент, що каталізує реакції глюкуронування – УДФ-глюкуронілтрансфераза, локалізується в мембранах ендоплазматичного ретикулуму гепатоцитів і деяких інших органів (нирок, травного тракту, шкіри), що також беруть участь в реакціях детоксикації. У результаті утворюються глюкуроніди білірубіну, стероїдних гормонів, продуктів гниття білків (фенолу, крезолу), вітаміну Д тощо. Залежно від хімічної природи субстрату, розрізняють реакції O-, N- та S-глюкуронування. наприклад, під впливом ферментів бактерій у товстій кишці з тирозину шляхом руйнування бічних ланцюгів можуть утворюватися токсичні сполуки фенол і крезол, які з током крові надходять у печінку, де знешкоджуються, вступаючи в реакцію кон’югації з глюкуроновою кислотою:
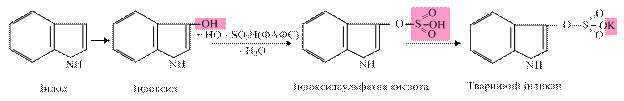
Утворені продукти реакції добре розчиняються у воді і виводяться в складі сечі. У реакціях сульфування донором сульфатних радикалів є біологічно активна форма сульфатної кислоти – 3’-фосфоаденозин-5’-фосфосульфат (ФАФС). так, вільний індол, який утворюється в товстій кишці в результаті дії ферментів мікроорганізмів на L-триптофан, далі шляхом мікросомального окиснення (І фаза біотрансформації) у печінці перетворюється на індоксил і вступає в реакцію кон’югації з ФАФС (ІІ фаза біотрансформації). Утворений у ході реакції індоксилсульфат, виводиться в складі сечі у вигляді калієвої солі, яка отримала назву “тваринного індикану”:
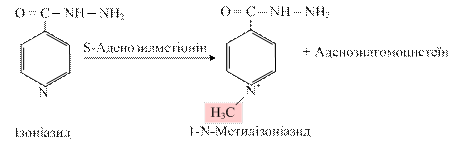
Індиканурію спостерігають при інтенсивному гнитті білкових речовин у кишці (коліт, закрепи, непрохідність кишок, рак, абсцес, перитоніт). Реакції метилування та ацетилування – поширений тип кон’югації, у цих реакціях беруть участь S-аденозилметіонін та ацетил-KoA: R-OH + S- аденозилметіонін ® R-O-СН3 + S-Аденозилгомоцистеїн Шляхом метилування відбувається біотрансформація ізоніазиду (похідного ізонікотинової кислоти), який широко застосовують для лікування туберкульозу:
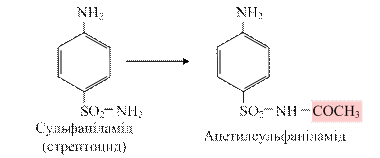
Ацетилування – основний шлях метаболізму сульфаніламідів, поширених хіміотерапевтичних препаратів і ароматичних амінів: R- NH2 + СН3-CO-SKoA ® R-NH-CO-CH3 + HS-KoA
У реакціях кон’югації з гліцином відбувається утворення гіпурової кислоти:
Швидкість цієї реакції відображає функціональний стан печінки. У клінічній практиці з метою дослідження детоксикаційної функції печінки проводять пробу Квіка: кількість гіпурової кислоти, яка екскретується у складі сечі через 4 години після введення per os стандартної дози натрію бензоату за умов норми повинна становити 2,0 – 2,5 г. Система знешкодження за участі глутатіону відіграє унікальну роль у формуванні резистентності організму людини до найрізноманітніших впливів і є одним із найважливіших захисних механізмів клітини. R + GSH → GSRH У ході біотрансформації деяких ксенобіотиків із глутатіоном під впливом глутатіонтрансферази шляхом низки послідовних перетворень утворюються токсичні сполуки – меркаптани, проте більшість кон’югованих із глутатіоном ксенобіотиків менш реакційно здатні, більш гідрофільні порівняно з вихідними речовинами і тому легко виводяться з організму. Дата добавления: 2015-11-25 | Просмотры: 1639 | Нарушение авторских прав |


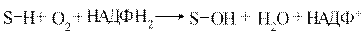
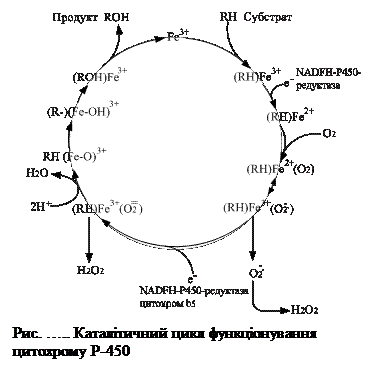 Характерною особливістю цитохрому Р-450 є його поліфункціональність. Механізм його дії полягає в наступному: за допомогою цитохрому Р-450 відбувається перетворення молекулярного кисню (інертного в триплетному стані) на синглетний, реакційно-спроможний кисень. Зв’язування в активному центрі цитохрому Р-450 ліпофільної сполуки RН і молекули кисню посилює окиснювальну активність фермента. Приєднання кисню відбувається з великою швидкістю. Потрійний комплекс фермент-субстрат-кисень відновлюється іншим електроном, який надходить із НАДФН-специфічного ланцюга перенесення електронів, що має в своєму складі НАДФН цитохром b5-редуктазу (рис. …). Наступна стадія характеризується утворенням пероксикомплексу. Згодом за участі двох протонів відбувається гетеролітичний розрив зв’язку О-О з вивільненням води та утворенням комплексу RH(Fe-O)3+, в якому міститься електрондефіцитний оксеноїдний атом кисню. Оксеноїдний комплекс вважають найважливішим окисником у циклі цитохрому Р-450. Його взаємодія з молекулою субстрату спричинює вивільнення атома водню й утворення радикалу субстрату та координованого з залізом гідроксильного радикалу. У подальшому відбувається їх рекомбінація, при цьому гідроксильна група включається в молекулу субстрату, після чого окиснений субстрат відділяється від фермента.
Характерною особливістю цитохрому Р-450 є його поліфункціональність. Механізм його дії полягає в наступному: за допомогою цитохрому Р-450 відбувається перетворення молекулярного кисню (інертного в триплетному стані) на синглетний, реакційно-спроможний кисень. Зв’язування в активному центрі цитохрому Р-450 ліпофільної сполуки RН і молекули кисню посилює окиснювальну активність фермента. Приєднання кисню відбувається з великою швидкістю. Потрійний комплекс фермент-субстрат-кисень відновлюється іншим електроном, який надходить із НАДФН-специфічного ланцюга перенесення електронів, що має в своєму складі НАДФН цитохром b5-редуктазу (рис. …). Наступна стадія характеризується утворенням пероксикомплексу. Згодом за участі двох протонів відбувається гетеролітичний розрив зв’язку О-О з вивільненням води та утворенням комплексу RH(Fe-O)3+, в якому міститься електрондефіцитний оксеноїдний атом кисню. Оксеноїдний комплекс вважають найважливішим окисником у циклі цитохрому Р-450. Його взаємодія з молекулою субстрату спричинює вивільнення атома водню й утворення радикалу субстрату та координованого з залізом гідроксильного радикалу. У подальшому відбувається їх рекомбінація, при цьому гідроксильна група включається в молекулу субстрату, після чого окиснений субстрат відділяється від фермента.