 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Диссипативная функция многофазной гетерогенной среды1. Термодинамика многофазной гетерогенной среды 2. Вывод выражения для изменения энтропии системы 3. Структура выражения для изменения энтропии 4. Характеристика производства энтропии 5. Структура производства энтропии 6. Структура движущей силы массоотдачи 7. Колебания при кристаллизации фосфорной кислоты 8. Массоперенос с учётом наличия межфазных поверхностей
1. Термодинамика многофазной гетерогенной среды Рассмотрим многофазную полидисперсную среду, где одна фаза (сплошная, несущая) - газ или жидкость, а другие фазы (дисперсные r -фазы) – включения твёрдых частиц, капель жидкости или газовых пузырьков (подробное описание см. в разделе "Математическое описание многофазной гетерогенной среды"). Смесь в целом неравновесна, но можно допустить, что в каждом локальном объёме смеси существует локальное термодинамическое равновесие внутри каждой из фаз. При этом между самими фазами равновесия не существует даже в локальном объёме смеси, т.е.
Здесь Для каждой из фаз в локальном объёме смеси выполняется [7] соотношение Гиббса:
Здесь
Энтропия рассматриваемой системы определяется соотношением:
Здесь r – средняя плотность смеси; Изменение энтропии многофазной полидисперсной среды во времени [6] имеет вид:
Здесь
2. Вывод выражения для изменения энтропии системы Подставим в формулу (3.2) соотношения Гиббса для каждой из фаз (3.1), а в них – уравнения изменения внутренней энергии (2.8), (2.9) и концентраций компонентов (2.10) и, приведя подобные члены, получим:
где
Проинтегрируем соотношение (3.3) по объёму V, занимаемому смесью, используя формулу Гаусса-Остроградского:
где А – вектор; Аn – проекция вектора А на нормаль к поверхности FS. При этом получим выражение для изменения энтропии всего объёма V рассматриваемой системы:
3. Структура выражения для изменения энтропии Выражение (3.4) для изменения энтропии многофазной полидисперсной среды можно представить в виде суммы двух слагаемых:
Первое слагаемое в выражении (3.5) отражает изменение энтропии рассматриваемой системы за счёт обмена энергией и веществом с окружающей средой:
где Второе слагаемое в выражении (3.5) определяет приращение энтропии системы за счёт внутренних необратимых процессов и называется производством энтропии s:
Члены в правой части выражения (3.6) описывают следующие необратимые процессы, протекающие в полидисперсных гетерогенных средах: первый – вязкое взаимодействие в сплошной фазе; второй – распространение тепла в сплошной фазе за счёт теплопроводности; третий – перенос массы в сплошной фазе за счёт процесса диффузии; четвёртый – теплообмен между сплошной и дисперсной фазами; пятый – вязкое взаимодействие между сплошной и дисперсной фазами; шестой – массообмен между сплошной и дисперсной фазами.
4. Характеристика производства энтропии 1. Рассмотрим изолированную систему. Для изолированных систем обмен энергией и веществом с окружающей средой невозможен; поэтому изменение энтропии изолированной системы равно производству энтропии:
Согласно второму началу термодинамики энтропия изолированной системы может только возрастать, и, следовательно, изменение энтропии во времени не может быть отрицательным. На основании этого получаем, что производство энтропии – также неотрицательная величина:
2. Рассмотрим открытую систему, находящуюся в стационарном состоянии. В стационарном состоянии все параметры открытой системы, в том числе и энтропия, не меняются во времени:
Потоки энергии и вещества, поступающие в систему из окружающей среды, определяют отрицательный поток энтропии
5. Структура производства энтропии Производство энтропии системы является диссипативной функцией и представляет собой сумму произведений термодинамических потоков
Под термодинамической движущей силой понимают разность каких-либо потенциалов (концентраций, температур, давлений и т.д.), которая вызывает протекание соответствующего процесса, является его причиной. Под термодинамическим потоком – количественное выражение процесса, изменение характеризующей его величины за единицу времени. В состоянии термодинамического равновесия движущие силы всех необратимых процессов, протекающих в гетерогенных полидисперсных средах, равны нулю и все связанные с ними потоки отсутствуют:
Поэтому естественно предположить, что по крайней мере для состояний вблизи равновесия между потоками и движущими силами существуют линейные однородные соотношения:
Таким образом, анализируя производство энтропии системы, можно получить в явном виде структуры движущих сил и вблизи равновесия определить потоки, соответствующие силам. Выпишем из соотношения (3.6) потоки и соответствующие им движущие силы, классифицируя их по тензорной размерности:
6. Структура движущей силы массоотдачи Рассмотрим подробнее структуру движущей силы массоотдачи (массообмена между сплошной фазой и r -фазой), полученной с использованием аппарата механики гетерогенных сред:
Выражение (3.8) состоит из двух частей: 1. разности химических потенциалов Планка, обусловленной неравновесностью составов фаз
2. энтальпийной составляющей, характеризующей тепловую неравновесность фаз
При этом оба фактора равнозначны по своему влиянию на скорость массообмена между фазами. Следует отметить, что классическая теория массообмена не рассматривает влияние тепловой неравновесности фаз. Данное влияние является синергетическим, то есть учитывает эффекты, непосредственно не связанные с процессом межфазного массообмена. Оно впервые было получено именно из анализа производства энтропии многофазной полидисперсной среды. Таким образом, выражение (3.8) для движущей силы массоотдачи имеет элемент новизны. Если в процессе межфазного массообмена температура фаз практически не изменяется, то энтальпийной составляющей можно пренебречь и описывать процесс массообмена классическими зависимостями. Однако если процессы межфазного массообмена сопровождаются большими тепловыми эффектами, в системе могут происходить явления, которые на основе классической теории массообмена объяснить невозможно; для их объяснения требуется учёт тепловой неравновесности. В качестве примера рассмотрим аномальные явления, наблюдающиеся при кристаллизации фосфорной кислоты.
7. Колебания при кристаллизации фосфорной кислоты В процессе кристаллизации фосфорной кислоты из растворов (85-87 %) при понижении температуры могут наблюдаться колебания концентрации фосфорной кислоты (см. рисунок). Уменьшение концентрации раствора соответствует нормальному течению процесса кристаллизации, то есть образованию и росту кристаллов. Повышение концентрации раствора означает, что в данный момент времени доминирует обратный процесс – растворение кристаллов. Однако при этом кривая текущей концентрации раствора фосфорной кислоты (кривая 1) не пересекает кривую равновесной концентрации (кривая 2), а находится выше неё при тех же температурных условиях. Таким образом, наблюдаемое периодическое растворение кристаллов происходит в условиях пересыщенного раствора. Для объяснения описанного явления рассмотрим движущую силу процесса кристаллизации (3.8), полученную на основе аппарата механики гетерогенных сред и анализа производства энтропии. С учётом соотношений для химических потенциалов и энтальпии
выражение (3.8) приводится к виду:
где Поскольку процесс кристаллизации ведётся при пересыщении, концентрация раствора фосфорной кислоты больше равновесной, и, следовательно, первое слагаемое в правой части уравнения (3.9) положительно. Величина теплового эффекта при кристаллизации фосфорной кислоты достигает значения 223,4 кДж/кг, поэтому температура кристаллов фосфорной кислоты Т 2 постоянно превышает температуру раствора Т 1, и, следовательно, второе слагаемое в правой части уравнения (3.9) отрицательно. В зависимости от того, какое из слагаемых в тот или иной момент времени больше по абсолютной величине, процесс роста кристаллов может чередоваться с их растворением не смотря на то, что раствор остаётся при этом пересыщенным.
8. Массоперенос с учётом наличия межфазных поверхностей
Для каждой из фаз рассматриваемой системы были записаны законы сохранения [6] и на их основе получено выражение для диссипативной функции производства энтропии, анализ которой позволил выявить структуру движущей силы массоотдачи с учётом градиентов поверхностного натяжения: · движущая сила массоотдачи вещества к поверхности раздела фаз
· движущая сила массоотдачи вещества от поверхности раздела фаз
Первый член в выражениях (3.10), (3.11) представляет собой разность химических потенциалов Планка, которая обусловлена неравновесностью составов фаз; второй – энтальпийную составляющую, характеризующую тепловую неравновесность фаз; третий – анизотропию давления вблизи поверхности раздела фаз, обусловленную влиянием поверхностных сил. Разность давлений
С учётом (3.12) и при отсутствии тепловой неравновесности
Полученные выражения были проверены [6] на процессах ректификации, абсорбции, кристаллизации, экстракции для систем, в которых большую роль играют градиенты поверхностного натяжения.
Дата добавления: 2015-11-26 | Просмотры: 432 | Нарушение авторских прав |

 – химический потенциал k -го компонента в i -й фазе;
– химический потенциал k -го компонента в i -й фазе;  – температура и давление i -й фазы;
– температура и давление i -й фазы; 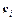 – средняя массовая скорость i -й фазы (i = 1, 2).
– средняя массовая скорость i -й фазы (i = 1, 2).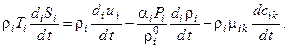 (3.1)
(3.1) – удельная энтропия i -й фазы;
– удельная энтропия i -й фазы;  – удельная внутренняя энергия i -й фазы;
– удельная внутренняя энергия i -й фазы;  – истинная и средняя плотности i -й фазы;
– истинная и средняя плотности i -й фазы; 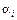 – объёмная доля i -й фазы;
– объёмная доля i -й фазы;  – концентрация k -го компонента в i -й фазе. Обозначение
– концентрация k -го компонента в i -й фазе. Обозначение  означает субстанциональную производную (2.4), (2.7).
означает субстанциональную производную (2.4), (2.7).
 – число включений в единице объёма смеси с размером от r до r + dr; R – наибольший размер включений.
– число включений в единице объёма смеси с размером от r до r + dr; R – наибольший размер включений. (3.2)
(3.2) – наблюдаемая скорость изменения размера включения.
– наблюдаемая скорость изменения размера включения. (3.3)
(3.3) – поток массы между сплошной фазой и r -фазой (для процесса кристаллизации
– поток массы между сплошной фазой и r -фазой (для процесса кристаллизации  );
);  – поток тепла между сплошной фазой и r -фазой, не связанный с фазовыми переходами;
– поток тепла между сплошной фазой и r -фазой, не связанный с фазовыми переходами;  – диффузионный поток k -го компонента в сплошной фазе;
– диффузионный поток k -го компонента в сплошной фазе; 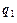 – поток тепла в сплошной фазе за счёт процесса теплопроводности;
– поток тепла в сплошной фазе за счёт процесса теплопроводности; 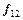 – сила взаимодействия между сплошной фазой и включениями, возникающая вследствие действия сил трения при контакте фаз;
– сила взаимодействия между сплошной фазой и включениями, возникающая вследствие действия сил трения при контакте фаз;  – тензор вязких напряжений;
– тензор вязких напряжений;  – тензор скоростей деформаций несущей фазы;
– тензор скоростей деформаций несущей фазы;  – энтальпия r -фазы.
– энтальпия r -фазы.
 (3.4)
(3.4)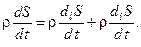 (3.5)
(3.5)
 – потоки тепла и массы через поверхность системы FS.
– потоки тепла и массы через поверхность системы FS.

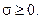

 , который компенсируется производством энтропии благодаря необратимым процессам, протекающим внутри системы. Отрицательный поток энтропии
, который компенсируется производством энтропии благодаря необратимым процессам, протекающим внутри системы. Отрицательный поток энтропии  на термодинамические движущие силы
на термодинамические движущие силы  необратимых процессов, протекающих в системе:
необратимых процессов, протекающих в системе:
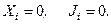
 (3.7)
(3.7) – поток вязких напряжений в сплошной фазе
– поток вязких напряжений в сплошной фазе
 – приведённый тензор скоростей деформаций
– приведённый тензор скоростей деформаций
 – поток силы взаимодействия между сплошной фазой и r -фазой:
– поток силы взаимодействия между сплошной фазой и r -фазой:

 – движущая сила взаимодействия между сплошной фазой и r -фазой
– движущая сила взаимодействия между сплошной фазой и r -фазой
 – поток тепла внутри сплошной фазы:
– поток тепла внутри сплошной фазы:
 – закон Фурье
– закон Фурье
 – движущая сила переноса тепла в сплошной фазе
– движущая сила переноса тепла в сплошной фазе
 – поток массы внутри сплошной фазы:
– поток массы внутри сплошной фазы:

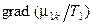 – движущая сила переноса массы в сплошной фазе
– движущая сила переноса массы в сплошной фазе
 – поток тепла между сплошной фазой и r -фазой:
– поток тепла между сплошной фазой и r -фазой: 
 – движущая сила теплообмена между сплошной фазой и r -фазой
– движущая сила теплообмена между сплошной фазой и r -фазой
 – поток массы между сплошной фазой и r -фазой:
– поток массы между сплошной фазой и r -фазой:

 –
движущая сила массообмена между сплошной фазой и r -фазой
–
движущая сила массообмена между сплошной фазой и r -фазой
 (3.8)
(3.8)



 (3.9)
(3.9) – концентрация раствора фосфорной кислоты,
– концентрация раствора фосфорной кислоты,  – равновесная концентрация раствора фосфорной кислоты,
– равновесная концентрация раствора фосфорной кислоты,  – теплоёмкость кристаллов фосфорной кислоты, R – универсальная газовая постоянная; индекс k в формулах опущен, поскольку рассматривается только один компонент – фосфорная кислота.
– теплоёмкость кристаллов фосфорной кислоты, R – универсальная газовая постоянная; индекс k в формулах опущен, поскольку рассматривается только один компонент – фосфорная кислота. Мы рассмотрели пример массопереноса вещества через поверхность раздела фаз без учёта анизотропии давления вблизи поверхности раздела фаз и влияния градиентов поверхностного натяжения. Чтобы учесть эти факторы, необходимо ввести понятие s-фазы. Под s-фазой понимается неоднородная зона толщиной h между двумя соприкасающимися фазами, внутри которой происходит изменение локальных свойств, таких как плотность, концентрация, тензор давления, вектор поляризации и т.д. Наличие s-фазы подтверждено экспериментально с помощью голографической интерферометрии. Схема строения элемента физико-химической системы на границе раздела фаз представлена на рисунке.
Мы рассмотрели пример массопереноса вещества через поверхность раздела фаз без учёта анизотропии давления вблизи поверхности раздела фаз и влияния градиентов поверхностного натяжения. Чтобы учесть эти факторы, необходимо ввести понятие s-фазы. Под s-фазой понимается неоднородная зона толщиной h между двумя соприкасающимися фазами, внутри которой происходит изменение локальных свойств, таких как плотность, концентрация, тензор давления, вектор поляризации и т.д. Наличие s-фазы подтверждено экспериментально с помощью голографической интерферометрии. Схема строения элемента физико-химической системы на границе раздела фаз представлена на рисунке. (3.10)
(3.10) (3.11)
(3.11) возникает за счёт действия сил Ван-дер-Ваальса, перекрытия граничных слоёв, наличия двойного электрического слоя. Между этой величиной и поверхностным натяжением в жидкости
возникает за счёт действия сил Ван-дер-Ваальса, перекрытия граничных слоёв, наличия двойного электрического слоя. Между этой величиной и поверхностным натяжением в жидкости  существует связь:
существует связь: (3.12)
(3.12) выражения (3.10), (3.11) преобразуются к виду:
выражения (3.10), (3.11) преобразуются к виду: