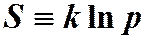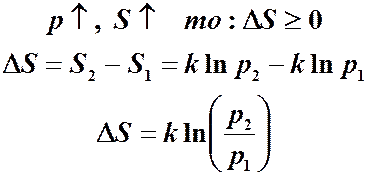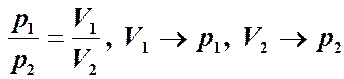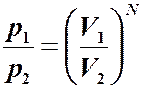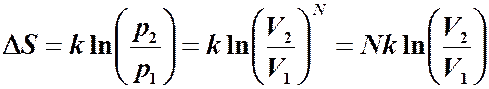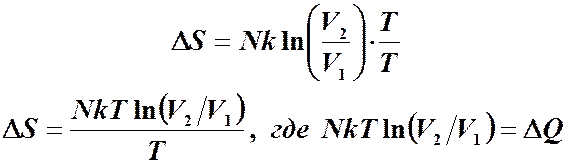|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Идеальный газ.
Энтропия План лекции. Энтропия. Закон возрастания Статистический вес. Обращение времени. 5.Формулировка II -го начала термодинамики. Энтропия. Хотя количество тепла является функцией процесса, тем не менее при равновесных процессах его можно выразить через изменение функции состояния, называемой энтропией. Энтропия является мерой неупорядоченности системы многих частиц. Чем выше степень беспорядка в координатах и скоростях частиц системы, тем больше вероятность p того, что система будет находиться в состоянии беспорядка. Энтропия системы определяется как:
,где k – постоянная Больцмана. В соответствии с определением вероятности система будет находиться в состоянии с большей вероятностью чаще, чем в состоянии с меньшей вероятностью. Стремление к состоянию с большей вероятностью:
Чтобы вычислить изменение энтропии, достаточно знать отношение вероятностей. Идеальный газ. Вычислим изменение энтропии при расширении газа от V1 до V2. Запишем относительную вероятность того, что частица в V1, а не в V2. Для одной частицы: Для N частиц: то:
Дата добавления: 2015-11-26 | Просмотры: 474 | Нарушение авторских прав |