 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Выделение чистой культуры анаэробов схематичноКультивирование анаэробных организмов в основном является задачей микробиологии. Сложнее дело обстоит с культивированием анаэробных многоклеточных организмов, поскольку для их культивирования часто необходима специфическая микрофлора, а также определённые концентрации метаболитов. Применяется, например, при исследовании паразитов человеческого организма. Для культивирования анаэробов применяют особые методы, сущность которых заключается в удалении воздуха или замены его специализированной газовой смесью (или инертными газами) в герметизированных термостатах — анаэростатах[7]. Другим способом выращивания анаэробов(чаще всего микроорганизмов) на питательных средах — добавление содержащих редуцирующие вещества(глюкозу, муравьинокислый натрий и др.), уменьшающие окислительно-восстановительный потенциал. Общие питательные среды для анаэробных организмов Для общей среды Вильсона — Блера базой является агар с добавлением глюкозы, сульфита натрия и двуххлористого железа. Клостридии образуют на этой среде колонии чёрного цвета за счет восстановления сульфита до сульфид — аниона, который соединяясь с катионами железа (II) дает соль чёрного цвета. Как правило, черные на этой среде образования колонии, появляются в глубине агарового столбика.[8] Среда Китт — Тароцци состоит из питательного бульона, 0,5 % глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20 — 30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина или вазелинового масла для изоляции от доступа кислорода. [править] Общие методы культивирования для анаэробных организмов GasPak — система химическим путем обеспечивает постоянство газовой смеси приемлемой для роста большинства анаэробных микроорганизмов. В герметичном контейнере, в результате реакции воды с таблетками боргидрида натрия и бикарбоната натрия образуется водород и диоксид углерода. Водород затем реагирует с кислородом газовой смеси на палладиевом катализаторе с образованием воды, уже вторично вступающей в реакцию гидролиза боргидрида. Данный метод был предложен Брюером и Олгаером в 1965 году. Разработчики представили одноразовый пакет, генерирующий водород, который был позднее усовершенствован ими до саше, генерирующих двуокись углерода и содержащих внутренний катализатор[9][10]. Метод Цейсслера применяется для выделения чистых культур спорообразующих анаэробов. Для этого производят посев на среду Китт-Тароцци, прогревают 20 мин при 80 °C (для уничтожения вегетативной формы), заливают среду вазелиновым маслом и инкубируют 24 ч в термостате. Затем производят посев на сахарно-кровяной агар для получения чистых культур. После 24-часового культивирования интересующие колонии изучаются — их пересеивают на среду Китт-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод Вейнберга используется для получения чистых культур облигатных анаэробов. Культуры, выращенные на среде Китта-Тароцци, переносят в сахарный бульон. Затем одноразовой пастеровской пипеткой материал переносят в узкие пробирки (трубки Виньяля) с сахарным мясо-пептонным агаром, погружая пипетку до дна пробирки. Засеянные пробирки быстро охлаждают, что позволяет фиксировать бактериальный материал в толще затвердевшего агара. Пробирки инкубируют в термостате, а затем изучают выросшие колонии. При обнаружении интересующей колонии на её месте делают распил, материал быстро отбирают и засеивают на среду Китта-Тароцци (с последующим контролем чистоты выделенной культуры). Метод Перетца Метод Перетца — в расплавленный и охлаждённый сахарный агар вносят культуру бактерий и заливают под стекло, помещённое на пробковых палочках(или фрагментах спичек) в чашку Петри. Метод наименее надежен из всех, но достаточно прост в применении.
Среды Гисса: К 1 % пептонной воде добавляют 0,5 % раствор определенного углевода (глюкоза, лактоза, мальтоза, маннит и др.) и кислотно-щелочной индикатор Андреде, разливают по пробиркам, в которые помещают поплавок для улавливания газообразных продуктов, образующихся при разложении углеводородов.
Среда Ресселя применяется для изучения биохимических свойств энтеробактерий(шигелл, сальмонелл). Содержит питательный агар, лактозу, глюкозу и индикатор (бромтимоловый синий). Цвет среды травянисто-зелёный. Обычно готовят в пробирках по 5 мл со скошенной поверхностью. Посев осуществляют уколом в глубину столбика и штрихом по скошенной поверхности. Среда Плоскирева (бактоагар Ж) — дифференциально-селективная среда, поскольку подавляет рост многих микроорганизмов, и способствует росту патогенных бактерий (возбудителей брюшного тифа, паратифов, дизентерии). Лактозоотрицательные бактерии образуют на этой среде бесцветные колонии, а лактозоположительные — красные. В составе среды — агар, лактоза, бриллиантовый зелёный, соли желчных кислот, минеральные соли, индикатор (нейтральный красный). Висмут-сульфитный агар предназначен для выделения сальмонелл в чистом виде из инфицированного материала. Содержит триптический гидролизат, глюкозу, факторы роста сальмонелл, бриллиантовый зелёный и агар. Дифференциальные свойства среды основаны на способности сальмонелл продуцировать сероводород, на их устойчивости к присутствию сульфида, бриллиантового зелёного и лимоннокислого висмута. Маркируются колонии в чёрный цвет сернистого висмута (методика схожа со средой Вильсона — Блера).
Метаболизм анаэробных организмов имеет несколько различных подгрупп: Организмы способные использовать анаэробное дыхание (другие окислители — серу, азот (см.Анаэробное дыхание), хлораты, перхлораты, хроматы и перманганаты[11])
Организмы, энергетический обмен которых опирается на катаболизм высокомолекулярных/высокоэнергетических соединений (например, гликолиз). Анаэробный энергетический обмен в тканях человека и животных[12] Дата добавления: 2015-12-15 | Просмотры: 1029 | Нарушение авторских прав |
 Метод Фортнера — посевы производят на чашку Петри с утолщенным слоем среды, разделённым пополам узкой канавкой, вырезанной в агаре. Одну половину засевают культуру аэробных бактерий, на другую — анаэробных. Края чашки заливают парафином и инкубируют в термостате. Первоначально наблюдают рост аэробной микрофлоры, а затем (после поглощения кислорода) — рост аэробной резко прекращается и начинается рост анаэробной.
Метод Фортнера — посевы производят на чашку Петри с утолщенным слоем среды, разделённым пополам узкой канавкой, вырезанной в агаре. Одну половину засевают культуру аэробных бактерий, на другую — анаэробных. Края чашки заливают парафином и инкубируют в термостате. Первоначально наблюдают рост аэробной микрофлоры, а затем (после поглощения кислорода) — рост аэробной резко прекращается и начинается рост анаэробной. Дифференциально — диагностические питательные среды
Дифференциально — диагностические питательные среды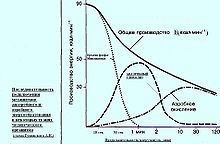 Использующие циклическое фотосинтетическое фосфорилирование (лучевую энергию (чаще всего Солнца)) — фототрофные анаэробы (см. также Аноксигенный фотосинтез)
Использующие циклическое фотосинтетическое фосфорилирование (лучевую энергию (чаще всего Солнца)) — фототрофные анаэробы (см. также Аноксигенный фотосинтез)