|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Функции печениПатология печени
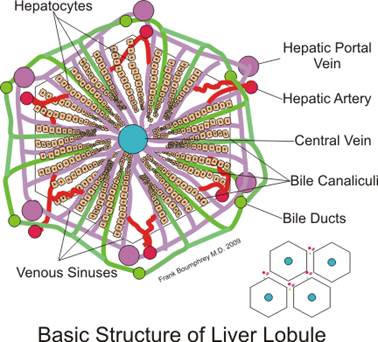
В реализации этих функций ключевая роль принадлежит гепатоцитам, которые входят в состав структурно-функциональных элементов печени – печеночных долек. Кровоснабжается печень преимущественно из бассейна воротной вены и только на 20% - из печеночной артерии. В печеночных дольках берут начало желчные протоки. По ним желчь поступает в систему наружных желчных путей, а затем в кишечник для участия в процессах пищеварения. Печень состоит из двух долей: правой и левой. В правой доле выделяют ещё две вторичные доли: квадратную и хвостатую. Паренхима печени дольчатая. Печёночнaя долька является структурно-функциональной единицей печени
Схема строения печёночной дольки Этиология Разнообразие функций печени во многом определяют особенности возникновения и проявлений болезней этого органа. В силу главенствующей роли печени в процессах обезвреживания чужеродных веществ наиболее частыми причинами патологии печени являются токсические поражения и инфекция. При хроническом воздействии на печень различных патогенных факторов в органе часто развивается прогрессирующий и плохо поддающийся лечению фиброз. Печень обладает уникально высокой способностью гепатоцитов к регенерации после острого повреждения, но эта способность утрачивается в присутствии вирусной инфекции или хронического воспаления печеночной ткани. В печени редко возникают первичные злокачественные опухоли (гепатомы), но зато в этом органе часто выявляются метастазы рака из органов бассейна воротной вены. Болезни печени бывают первичными (наследственными, врожденными) и вторичными (приобретенными). Для практической фармации наибольшее значение имеют заболевания печени, приобретенные в процессе индивидуального развития. Патологию печени вызывают биологические, химические и физические этиологические факторы, а также ей способствуют неблагоприятные внутренние и внешние условия. Среди биологических факторов повреждения гепатоцитов наибольшее значение имеют: РНК- и ДНК-содержащие вирусы;бактерии:стрептококки, стафилококки, сальмонеллы, палочки Коха; паразиты: эхинококки, амёбы, лямблии и другие. Химические повреждения печени вызывают лекарства: противоопухолевые препараты, барбитураты, антибиотики, вакцины, противотуберкулезные препараты, сульфаниламиды, особенно при их длительном применении, а также гепатотропные яды. Печень часто повреждается при тяжелой механической травме. Патология печени возникает не только вследствие прямых повреждений гепатоцитов, но и опосредованно, в результате острых или хронических нарушений кровообращения (тяжелый шок, хроническая сердечная недостаточность и др.), неполноценного питания (недостаток незаменимых аминокислот, ненасыщенных жирных кислот, витаминов, избыток животных жиров и углеводов), других нарушений исполнительных и регуляторных систем. Патогенез По клиническому течению патология печени бывает острой и хронической, она носит очаговый или диффузный характер повреждения. Нарушения печеночных функций могут полностью компенсироваться, а потому длительно не проявляться или не компенсироваться, они бывают обратимыми или носят необратимый характер. Патологические процессы в печени протекают преимущественно в виде воспаления, дистрофии, холестаза, цитолиза, печёночно-клеточной недостаточности. В зависимости от тяжести и распространенности повреждения печеночных клеток возникают различные нарушения обмена углеводов, липидов, белков, ферментов, гормонов, витаминов, а также других печеночных функций. Заболевания печени проявляются в виде клинико-лабораторных симптомокомплексов – синдромов, в основе которых лежат различные формы печеночной недостаточности. Печеночная недостаточность (ПН) характеризуется снижением одной, нескольких или всех функций печени ниже уровня, необходимого для обеспечения нормальной жизнедеятельности организма. Наиболее тяжело протекает острая печёночная недостаточность (ОПН). К развитию ОПН чаще всего приводят вирусные и лекарственные поражения печени. При ОПН, прежде всего, подавляется синтез белков крови (альбуминов), а также нарушается выработка факторов системы свертывания крови. Печеночная недостаточность по числу нарушенных функций бывает парциальная (одна), субтотальная (несколько) и тотальная (все). По течению ПН подразделяют на острую и хроническую, а по исходу заболевания - на летальную и нелетальную. Общий патогенез. Под действием повреждающих факторов (инфекционных или неинфекционных) происходит изменение молекулярной архитектоники мембран гепатоцитов и усиление в клетках процессов перекисного окисления белков и липидов (ПОЛ). Продукты перекисного окисления липидов (гидроперекиси, гидроксильные радикалы и др.) вызывают деструкцию клеточных мембран и повышение их проницаемости. Высвобождение лизосомальных ферментов (гидролаз) приводит к дополнительной деструкции клеток. Продукты распада клеток подвергаются фагоцитозу, а выделяемые при этом макрофагами цитокины (ФНО, ИЛ-1 и др.) способствуют развитию воспалительной реакции в печени. Изменение антигенных свойств поврежденных гепатоцитов приводит к включению в процесс механизмов иммунного воспаления, а также к образованию аутоантител и аутосенсибилизированных T-лимфоцитов (киллеров) к печеночным клеткам. Каждое из перечисленных патогенетических звеньев на определенной стадии развития печеночной недостаточности может стать доминирующим в развитии повреждений печеночных функций. Нарушения углеводного обмена. При патологии печени снижается способность гепатоцитов извлекать избыток глюкозы из крови и превращать ее в гликоген и наоборот - расщеплять гликоген до глюкозы при увеличении потребности органов и тканей в сахаре. Поэтому концентрация глюкозы в крови становиться неустойчивой. При повреждении рецепторных и внутриклеточных механизмов транспорта углеводов в клетках печени нарушается толерантность к глюкозе, а ее концентрация в крови может становиться повышенной - развиваться гипергликемия. При тяжелом молниеносном гепатите и на конечных стадиях цирроза вследствие истощения резервов гликогена в печени или блокирования мобилизации глюкозы из гликогена глюкагоном концентрация сахара в крови снижается – возникает гипогликемия. Нарушения жирового обмена при патологии печени характеризуются снижением способности гепатоцитов превращать атерогенную форму холестерина (свободный холестерин) в менее атерогенный холестерин и образовывать фосфолипиды, обладающие антиатерогенным действием. Такое соотношение липидов в плазме (дислипидемия) способствует отложению холестерина в стенках сосудов и развитию атеросклероза. Нарушения белкового обмена проявляются снижением синтеза гепатоцитами альбуминов, что ведет к уменьшению концентрации белков плазмы, снижению онкотического давления крови и развитию отеков. Нарушение синтеза прокоагулянтов (фибриногена, протромбина, факторов V, VII, IХ-XIII, а также ингибиторов активаторов свертывания и фибринолиза) приводит к развитию коагулопатий, характеризующихся склонностью к кровоточивости. Нарушению свертывания крови способствует уменьшение образование желчи и обусловленная этим задержка всасывания в кишечнике витамина K. В результате нарушения процессов дезаминирования аминокислот и синтеза мочевины происходит снижение в крови содержания мочевины и увеличение токсических субстратов (аммиака). При повреждении гепатоцитов наблюдается уменьшение продукции холинэстеразы и других ферментов, а также увеличение концентрации в крови внутриклеточных печеночных ферментов - аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ). Расстройство обмена витаминов обусловлено нарушением их всасывания (А,D,E,K) из кишечника вследствие дефицита желчи, а также уменьшением способности гепатоцитов превращать провитамины в активные формы (например, каротин в витамин A) и торможением процессов образования коферментов из витаминов (например, из пантотеновой кислоты - ацетил коэнзим A, из витамина B1 - кокарбоксилазы пирувата). С этим связано появление эндогенного (печеночного) гиповитаминоза одного из постоянных спутников печеночной недостаточности. Нарушение антитоксической ("барьерной") функции печени вызывется снижением способности гепатоцитов обезвреживать токсические соединения, образующиеся в кишечнике (фенола, индола, скатола, биогенных аминов, аммиака), а также метаболиты (низкомолекулярных жирных кислот, серосодержащих аминокислот и других соединений) и экзогенные яды (грибов, микробов, паразитов, ядохимикаты). Нарушения метаболизма гормонов. При хронических болезнях печени метаболизм эстрогенов и тестостерона часто нарушается. У мужчин с циррозом печени (особенно алкогольным) интенсивность превращений тестостерона и андростендиона в печени уменьшается, в результате чего стероидные соединения в периферических тканях превращаются в эстрадиол и эстрон. Клинически у мужчин это проявляется гинекомастией, атрофией яичек и половой дисфункцией. Нарушение процессов биотрансформации в гепатоцитах приводит к образованию токсических метаболитов и иммуногенных белков. Токсические метаболиты обезвреживаются путем их вступления в реакцию с глютатионом. При глютатионовой недостаточности, вызванной действием алкоголя или лекарств, происходит увеличение концентрации электрофильных токсических метаболитов и образование комплексов белок-ксенобиотик, которые являются мишенью для клеток иммунной системы и печеночных повреждений. Снижение активности микросомальных ферментов приводит к замедлению инактивации и элиминации противовоспалительных и противосудорожных средств, транквилизаторов, кардиотропных препаратов, а также антибиотиков. Например, в результате нарушения метаболизма парацетамола образуется сильнодействующий свободный радикал (N-ацетилимидохинон), который может необратимо инактивировать многие ферменты и другие белки. Дата добавления: 2015-12-16 | Просмотры: 559 | Нарушение авторских прав |