|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
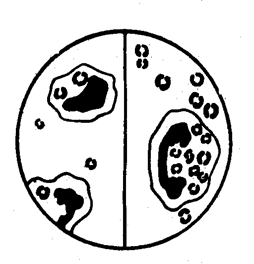
МЕХАНИЗМЫ НЕСПЕЦИФИЧЕСКОЙ РЕЗИСТЕНТНОСТИАнтиинфекционная резистентность организмов вырабатывалась в процессе длительной эволюции и является свойством всей популяции вида однотипно реагировать на внедрение микроорганизмов, используя для их подавления естественно-физиологические факторы антиинфекционной защиты широкого спектра действия. Тканевые факторы. Среди тканевых факторов антиинфекционной защиты главную роль играют ареактивность клеток, кожа, слизистые оболочки, лимфатические узлы как иммунологические барьеры, фагоциты и нормальные киллеры. Видовая ареактивность клеток к патогенным микробам и токсинам обусловлена генотипом, который детерминирует образование на поверхности клеток соответствующих рецепторов. При их отсутствии адсорбция и проникновение инфекционного агента или яда в клетку будут невозможны. Генотипическая ареактивность может быть связана также с дефицитом необходимых для микроба веществ или, например, избирательной специфичностью действия микробных ферментов. Клеточная ареактивность является очень стабильным видовым признаком, но может изменяться под действием различных факторов окружающей среды. Так, Л. Пастер показал наличие ареактивности кур к сибирязвенной инфекции, но при погружении их лапок в ледяную воду и резком охлаждении организма зараженные птицы заболевают. В другом классическом опыте И. И. Мечникова была отмечена природная нечувствительность лягушек, черепах, ящериц к столбнячному токсину. Развитие столбняка у пойкилотермных животных достигалось помещением их в термостат и повышением температуры тела. Кожные покровы и слизистые оболочки обеспечивают невосприимчивость как механические барьеры и вследствие выделения антимикробных веществ широкого диапазона действия (ферментов, кислот, специфических ингибиторов). Мощным естественным барьером являются лимфатические узлы. Проникшие в них патогенные бактерии вызывают воспалительный процесс, сопровождающийся освобождением из тканей биологически активных веществ, под влиянием которых происходит активация лейкоцитов, скапливающихся вокруг патогенных микробов и препятствующих их распространению в кровоток, подлежащие ткани и внутренние органы. Наряду с этим в очаге воспаления активируется фагоцитарная реакция. Значение фагоцитоза как фактора неспецифической резистентности организма впервые оценил И. И. Мечников. Клетки, способные осуществлять поглощение и переваривание микробов, он назвал фагоцитами. Среди фагоцитов И. И. Мечников различал микрофаги и макрофаги. К микрофагам были отнесены гранулярные лейкоциты (нейтрофилы, эозинофилы, базофилы), а к макрофагам — моноциты крови, мигрирующие и фиксированные фагоциты тканей (гистиоциты). Фагоцитарная реакция осуществляется поэтапно. При завершенном фагоцитозе, заканчивающемся разрушением микро6а, различают четыре стадии: 1) приближение фагоцита к микробу (положительный хемотаксис); 2) прилипание фагоцита к микробу; 3) впячивание наружной мембраны фагоцита с последующим образованием фагосомы и ее слияние с лизосомой; 4) инактивация и ферментативное расщепление микроба в фаголизосоме, проявляющиеся набуханием, фрагментацией и лизисом с полной деградацией до аминокислот и низкомолекулярных соединений. Некоторые виды микроорганизмов; особенно вирусы, проявляют большую устойчивость к лизосомным ферментам или даже размножаются внутри фагоцитов (рис. 2). Такой незавершенный вид фагоцитоза чаще наблюдается в нейтрофилах и заканчивается их гибелью или выталкиванием микробов .. Рис. 2. Незавершенный фагоцитоз
В разрушении микробов, проникших в клетки, активное участие принимают нормальные кцллеры (англ. killer — убийца). Это большие лимфоциты с относительно рыхлым почковидным крупным ядром и обильной цитоплазмой, в которой содержится большое количество цитотоксических веществ. На их внешней мембране имеются специфические рецепторы, благодаря которым нормальные киллеры узнают инфицироанные вирусом или опухолеродные клетки. Связываясь с ними, нормальные киллеры активируются и выбрасывают содержимое своих гранул, которое разрушает их. Гуморальные факторы. Гуморальные факторы иммунитета, обеспечивающие неспецифическую резистентность организма, очень многочисленны. Большинство из них обладает антимикробной активностью. Концентрация их в крови и лимфе здоровых людей небольшая, но при инфицировании может резко возрастать. Обладают широким спектром действия. Природа гуморальных факторов многообразна, но, как правило, они являются полипептидами. Механизм антимикробного действия многосторонний. Вырабатываются разнообразными клетками, главным о6разом Т-лимфоцитами и макрофагами. Среди гуморальных факторов антиинфекционной защиты основное значение придают комплементу, пропердину, лизоциму, нормальным антителам, интерферонам I типа. Комплемент. Структурно сформированного комплемента (лат. complementum — дополнение) как гуморального фактора иммунитета в организме здоровых людей и животных нет. В их крови циркулируют различные фракции комлемента, обозначаемые символами С1, С2, СЗ...С9, В и др. Находясь в дискретном (разобщенном) состоянии, они являются инертными белками — предшественниками комплемента. Сборка (активация) фракций комплемента в единое целое происходит при внедрении в организм болезнетворных микробов. Сформировавшись, комплемент способен лизировать клетки (бактерии, эритроциты) или чаще просто элиминировать генетически чужеродную метку, повышая бактерицидную активность сыворотки крови. О содержании в ней комплемента судят по его гемолитической активности в отношении эритроцитов барана, обработанных сывороткой кролика, содержащей антитела гемолизины. Титр комплемента выражают в минимальном количестве сыворотки, которое в нормальных условиях лизирует 100 % или 50 % оптимально сенсибилизированных гемолизинами эритроцитов. Содержание комплемента в сыворотках сильно колеблется в зависимости от вида и возраста животных, сезона и даже времени суток. Наиболее постоянный и высокий его титр регистрируется у морских свинок, поэтому именно их сыворотка используется как комплемент для постановки реакции связывания комплемента. У здоровых людей уровень комплемента варьирует незначительно, но у больных может резко повышаться или снижаться. Система комплемента очень лабильна. Его инактивация происходит в течение 2—4 дней даже при надежном хранении сывороток (5°С). Быстро разрушается комплемент при УФ-облучении, действии солнечного света, протеаз, слабых растворов кислот и щелочей. Исчезает комплементарная активность сывороток после их прогревания при температуре 56°С в течение 29-30 мин. Пропердин. Защитный белок, состоящий из пяти компонентов. Три из них специфические, а два остальных являются фракциями комплемента. Совместно действуя с комплементом, этот защитный белок тоже разрушает бактерии, усиливает фагоцитарную реакцию и воспалительный процесс. . Лизоцим. Фермент с молекулярной массой около 15000, нарушающий синтез оболочек бактерий. При частичной утрате оболочек бактерии превращаются в сферобоасты, а при полной в протопласты.. Те и другие быстро погибают или лизируются. Основным источником лизоцимов в крови являются макрофаги. Нормалъные антитела. В сыворотке крови новорожденных могут содержаться антнтитела к различным видам микроорганизмов. По структуре они ничем не отличаются от иммунных, т. е. прио6ретенных в процессе инфекции. Идентичны с ними и по механизму взаимодействия с микробами, т.е. реагируют по закону строгой специфичности. Нормальные антитела экспрессируются на поверхностных мембранах незрелых В-лимфоцитов в виде рецепторов. Будучи цитофильными, в крови новорожденных они обнаруживаются в очень низких титрах, как правило, в цельной сыворотке. Интерфероны (ИНФ) I типа. Это низкомолекулярные белки, содержащие небольшое количество углеводов (англ. interfere — препятствую размножению). Различают две серологические группы ИНФ I типа — a и b. a-ИНФ — это семейство 20 полипептидов с молекулярной массой около 18 кД. b-ИНФ —гликопротеин с молекулярной массрй 20 кД. Отличаясь по структуре, они обладают одинаковым механизмом действия. В норме a-ИНФ продуцируется мононуклеарными фагоцитами, а b-ИНФ — фи6робластами. Под воздействием инфекционного начала секретируются многими клетками и в месте входных ворот инфекции концентрация ИНФ I типа в считанные часы многократно возрастает. Его защитное действие в отношении вирусов сводится к ингибированию репликации РНКили ДНК. Связавшийся со здоровыми клетками ИНФ I типа защищает их от проникновения вирусов. Факторы саморегуляции. В основе антиинфекционного иммунитета лежит также способность организма к саморегуляции. Эта форма иммунитета проявляется обычным повышением температуры тела, губительно сказывающихся на жизнедеятельности многих бактерий и особенно вирусов в результате непосредственного влияния или изменения окислительно-восстановительного потенциала и рН пораженных тканей. Большое значение в обеспечении естественного иммунитета имеет выведение микробов и токсинов с мокротой, испражнениями, мочой и другими секретами и экскретами при усилении выделительных функций различных органов и систем. Эти и другие, еще не учтенные факторы и механизмы общефизиологического характера находятся под регулирующим влиянием нейрогуморальных и гормональных функций организма.
По специфичности антигены 6актерий подразделяют на видовые, типовые и гетерогенные. Видовые и особенно типовые отличаются высокой специфичностью. В ответ на их введение в организме животных вырабатываются только такие антитела, которые реагируют с антигенами определенного вида или разновидности микроба. Гетерогенные антигены — это межвидовые антигены, на введение которых вырабатываются групповые антитела, вступающие в реакцию взаимодействия с несколькими видами бактерий. Аитигены животных. Клетки, взвеси органов и тканей, кровь и сыворотка животных и человека, введенные в организм другого вида (особи, индивидуума), обладают свойствами иммуногенов. Установление этого факта в начале века привлекло внимание врачей к частным вопросам осложнений (анафилаксий), возникающих после введения больным чужеродной иммунной сыворотки или перелитой крови здорового человека. Большой интерес к антигенам животных появился в середине века, когда в 1944 г. П. Медавар доказал иммунологическую природу отторжения трансплантатов нормальных тканей. Многочисленные виды антигенов животного происхождения условно можно разделить на экзогенные, вводимые извне, и эндогенные — изоантигены (греч. ixox — одинаковый), определяющие индивидуальную специфичность, и аутоантигены (греч. autox — свой), имеющиеся или о6разующиеся в организме. Экзогенные антигены, такие, как, например, чужеродные белки лечебной (иммунной) сыворотки, вызывают образование антител и активируют клеточные факторы иммунитета независимо от вида и иммуногенности донора. Природа и антигенные свойства эндогенных антигенов различны. Изоантигены — это собственные специфические белки, углеводы и соединения различных клеток, органов и тканей. Обычно они не антигенны для организма, в котором синтезируются. Эта естественная толерантность (терпимость) к изоантигенам объясняется тем, что в эмбриональном периоде развития плода происходит элиминация (разрушение) всех клонов лимфоидных клеток, способных реагировать с ними. Среди аутоантигенов различают нормальные (обычные, естественные) и патологические. Нормальные аутоантигены — это комплексные белки отдельных органов и тканей человека, отделенные от кровотока и иммунокомпетентных клеток гематоэнцефалическим, гематотестикулярным и другими барьерами. К числу таких забарьерных органов относят мозг, семенники, хрусталик глаза, паращитовидные железы. Аутоантигены, забарьерных органов способны распознаваться иммунной системой собственного организма как экзогенные чужеродные белки, но так как в норме они не поступают в кровь, то иммунные лимфоциты и не реагируют с ними. Иммунные реакции с нормальными аутоантигенами чаще всего происходят при травматических повреждениях забарьерных органов или изменении проницаемости барьеров. Патологические аутоантигены — тоже сложные белки. Возникают в организме при целом ряде инфекционных и соматических заболеваний В результате появляются аутоантитела к собственным клеткам, что приводит к развитию аутоиммунных болезней (тиреоидит, ревматоидны артриты и др.). Антигены, которые распознаются тимоцитами, называются Т-зависимыми, не распознааощиеся ими — Т-независимыми. Первых намного больше других. Т-зависимые антигены индуцируют разнообразные иммунные процессы, а Т-независимые – только антителообразование.
Характеристика Т-лимфоцитов. Зрелые Т-лимфоциты по форме напоминают малые лимфоциты крови (см. рис. 1). Ядро у них подковоообразное, плотное и интенсивно окрашенное, цитоплазма в виде узкого ободка. Диаметр 6,0—6,5 мкм. В сканирующем микроскопе на гладкой поверхности Т-лимфоцитов определяется сравнительно небольшое количество коротких отростков, представляющих собой белковые рецепторы. Субпопуляции Т-лимфоцитов. По функциональным свойствам популяция Т-лимфоцитов разнородаа. В зависимости от реакций, которые они вызывают, различают Т-киллеры (клетки-убийцы), Т-хелперы (помошники) и Т-супрессоры (регуляторы). Т-киллеры чаще называются цитотоксическими лимфоцитами, так как они способны разрушать клетки-мишени, в частностй инфицированные вирусами и бактериями, а также злокачественно перерожденные. Повреждение клеток-мишеней Т-киллерами происходит при прямом контакте с ними под действием выделяемого ими лимфотоксина: Т-киллеры являются долгоживущими клетками, очень чувствит6льны к радиации, устойчивы к циклофосфамиду Т-хелперы выполняют посредническую сигнальную функцию, передавая информацию об антигенах. В гуморальном иммунном ответе они реагируют с несущей частью тимусзависимого антигена, индуцируя превращение В-лимфоцитов в плазмоциты. В присутствии хелперов синтез антител увеличивается на один-два порядка. Индуцируют также образование эффекторных Т-лимфоцитов. Т-хелперы — долгоживущие лимфоциты, чувствительны к циклофосфамиду. Т-супрессоры являются регуляторами антителообразования и других иммунных процессов, участвуют в формировании иммунологической толерантности. Кроме перечисленных субпопуляций, в состав Т-лимфоцитов входят антигенреактивные клетки, активирующие несенсибилизированные Т-лимфоциты и усиливающие фагоцитоз. По длительности жизни в популяции Т-лимфоцитов различают две субпопуляции: 1) короткоживущую (несколько дней) оседлую Т1-субпопуляцию, обнаруживаемую преимущественно в тимусе и селезенке, и 2) долгоживущую (месяцы и годы), интенсивно циркулирующую в организме Т2-субпопуляцию. Долгоживущих Т-лимфоцитов в грудном протоке 90 %, в лимфатических узлах — 70 %, в селезенке— 25 %. В-лимфоципгы. В-клетки (см. рис. 1), так же как и Т-клетки, происходят из стволовых клеток. Созревают они у животных и человека поэтапно — первоначально в костном мозге, а затем в селезенке. Предшественники В-лимфоцитов (В-клетки) появляются на 16-й день внутриутробного развития плода. К моменту рождения, когда происходит их полное созревание, на цитоплазматической мембране В-клеток находятся три иммуноглобулина M, G, D или M, A, D, которые выполняют функцию рецепторов. Так как большинство антигенов тимусзависимые, то для трансформации зрелых В-лимфоцитов в антителопродуцирующие обычно недостаточно одного антигенного стимула. При попадании таких антигенов В- лимфоциты дифференцируются в плазмоциты с помощью Т-хелперов при участии макрофагов. Пул В-лимфоцитов в организме животных тоже очень большой. Больше всего их в групповых лимфатических фолликулах, костном крови и селезенке (40—60 %), в лимфатических узлах и грудном лимфатическом протоке (25 %). Практически нет В-лимфоцитов только в тимусе. Независимо от природы и силы антигена, вызвавшего трансформацию В-лимфоцитов, образовавшиеся плазмоциты продуцируют такие антитела, которые по специфичности аналогичны рецепторным иммуноглобулинам М. Характеристика В-лимфоцитов. Зрелые В-лимфоциты имеют большие размеры. Их диаметр около 8,5 мкм. Ядро красится менее интенсивно, а ободок цитоплазмы шире, чем у Т-лимфоцитов. В сканирующем микроскопе поверхность В-лимфоцитов покрыта длинными густыми отростками или, правильнее говоря, огромным количеством антигенраспознающих рецепторов. По структуре рецепторы В-лимфоцитов представляют собой связанные с мембраной мономеры IgM. Обычно для дифференциации и идентификации В- и Т-лимфоцитов используют тёст розеткообразования с эритроцитами барана. При этом Т-лимфоциты в 85 % случаев, присоединяя 3—5 эритроцитов, образуют розетки, а у В-лимфоцитов таких свойств нет. Макрофаги как антигенпрезентирующие клетки. Макрофаги — основной тип клеток моноцитарной системы лимфоцитов. Они представляют собой крупные (10—20 мкм), гетерогенные по функциональной активности долгоживущие клетки с хорошо развитой цитоплазмой и лизосомальным аппаратом (см. рис. 1). На их поверхности имеются специфические рецепторы к В- и Т-лимфоцитам, Fc-фрагменту иммуноглобулина, С3-фракции комплемента, гистамину. Различают подвижные и фиксированные макрофаги. Те и другие дифференцируются из стволовой кроветворной клетки. Значение макрофагов состоит в том, что они накапливают и подвергают переработке проникающие в организм тимусзависимые антигены и презентируют (представляют) их для распознавания Т-клеткам. При определенных условиях они проявляют цитотоксическое действие на опухолевые клетки. Секретируют интерферон, лизоцим, различные фракции комплемента, факторы, дифференцирующие стволовые клетки в гранулоциты, стимулирующие размножение и созревание Т-лимфоцитов. Таким образом, основными клеточными элементами, обеспечивающими приобретенный иммунитет, являются В-лимфоциты, Т-лимфоциты и макрофаги. При гуморальном типе иммунного ответа эта система иммунокомпетентных клеток функционирует как единое целое в лимфатических узлах, селезенке и многих других вторичных органах иммунитета. Дата добавления: 2015-02-06 | Просмотры: 2028 | Нарушение авторских прав |