 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Повышение температуры кипения и понижение температуры кристаллизации раствора. Эбуллиоскопия и криоскопияКипение представляет собой фазовый переход, при котором происходит превращение жидкости в пар, причем пузырьки пара образуются во всем объеме жидкости. Температурой кипения жидкости называют ту температуру, при которой давление насыщенного пара над данной жидкостью равно внешнему. При этой температуре и соответствующем ей давлении насыщенного пара устанавливается равновесие между жидкой и газообразной фазами (скорость испарения равна скорости конденсации), и обе эти фазы могут сосуществовать в течение длительного времени. Если жидкость – индивидуальное вещество и внешнее давление не меняется, то кипение ее в открытом сосуде происходит при постоянной температуре до тех пор, пока полностью не исчезнет жидкая фаза. Температура, при которой данная жидкость кипит в условиях давления 101325 Па, называют нормальной температурой кипения. Замерзание (затвердевание) представляет собой фазовый переход, при котором происходит превращение жидкости в твердое вещество, частицы которого (кристаллы) образуются во всем объеме жидкости. Температурой замерзания (кристаллизации) жидкости называют ту температуру, при которой давление насыщенного пара над жидкостью равно давлению насыщенного пара над выпадающими из нее кристаллами твердой фазы. При этой температуре и соответствующем ей давлении насыщенного пара устанавливается равновесие между жидкой и твердой фазами (скорость кристаллизации равна скорости плавления) и обе эти фазы могут сосуществовать в течение длительного времени. Если жидкость – индивидуальное вещество и внешнее давление остается постоянным, то при ее охлаждении температура будет оставаться постоянной, соответствующей температуре замерзания, до тех пор, пока не произойдет полное затвердевание. Для того, чтобы сместить равновесие в сторону кристаллизации надо понизить температуру, т.к. кристаллизация – это экзотермический процесс. Если растворить в жидкости какое-то вещество, концентрация ее уменьшится и в системе жидкость – твердая фаза усилится процесс плавления. Отсюда вытекает зависимость (II закон Рауля): Повышение температуры кипения, а также понижение температуры кристаллизации разбавленных растворов прямо пропорционально моляльности раствора и не зависит от природы вещества:
где:
Дата добавления: 2015-02-06 | Просмотры: 797 | Нарушение авторских прав |
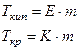
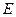 и К – эбуллиоскопическая и криоскопическая константы (зависят от природы растворителя, не зависят от природы вещества и концентрации)
и К – эбуллиоскопическая и криоскопическая константы (зависят от природы растворителя, не зависят от природы вещества и концентрации)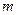 - моляльность раствора.
- моляльность раствора.