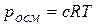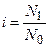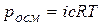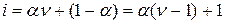|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Осмос и осмотическое давлениеПроцесс самопроизвольного перехода (диффузии) растворителя через проницаемую перегородку из той части системы, где концентрация растворенного вещества ниже, в другую, где она выше, называется осмосом. Количественно осмос характеризуется осмотическим давлением, т.е. давлением, которое нужно приложить к раствору, чтобы прекратить осмос. Осмотическое давление является мерой стремления растворенного вещества (вследствие теплового движения его молекул) перейти в процессе диффузии из раствора в чистый растворитель и равномерно распределиться по всему объему растворителя. Отрицательное изменение энергии Гиббса системы в процессе осмоса происходит главным образом за счет соответствующего изменения энтропийного фактора. Осмотическое давление растет с увеличением концентрации раствора и температуры, т.е. следует примерно тому же закону, что и зависимость давления газа от тех же факторов. Вант-Гофф (1887) установил закон, согласно которому осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора. Это значит, что осмотическое давление идеального раствора можно вычислить по уравнению Менделеева – Клапейрона рV= nRТ, где р == роем, V – объем, занимаемый раствором; n – число молей растворенного вещества. Имея в виду, что n/V = с – молярная концентрация раствора, получаем уравнение, являющееся математическим выражением осмотического закона Вант-Гоффа:
Растворы, имеющие одинаковое осмотическое давление, называют изотоническими. Если некоторый раствор А имеет большее осмотическое давление, чем раствор В, то в этом случае говорят, что А гипертоничен по отношению к раствору В или что раствор В гипотоничен по отношению к раствору А. Для растворов электролитов в уравнение для расчета осмотического давления необходимо ввести дополнительный поправочный коэффициент i, называемый изотоническим коэффициентом Вант-Гоффа, который равен отношению числа отдельных частиц (нормальных молекул, ионов или более простых дочерних молекул) N1 к общему числу молекул растворенного вещества N0) в объеме раствора:
Если из общего числа молекул растворенного вещества a – часть их первоначального количества распалась на n дочерних частиц, а остальная часть молекул (1 – a) остается в неизменном виде, то изотонический коэффициент Вант-Гоффа будет равен:
Для бинарного электролита, распадающегося на 2 иона (n = 2), например для NаС1, i == 1 + a; для тринарного электролита (n = 3), например для ВаСl2, i = 1 + 2a и т.д. Причем во всех случаях a – это степень диссоциации растворенного вещества, выраженная в долях единицы. Дата добавления: 2015-02-06 | Просмотры: 825 | Нарушение авторских прав |