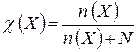|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Способы выражения концентрации растворов. Концентрация является важной характеристикой раствораКонцентрация является важной характеристикой раствора. Концентрация определяет относительное содержание компонентов в растворе. Массовая доля равна отношению массы растворённого вещества к массе раствора:
Молярная концентрация – это количество вещества, содержащееся в одном литре раствора (моль/л):
Молярная концентрация эквивалента (нормальная концентрация) – это число молей эквивалентов вещества, содержащихся в одном литре раствора (моль/л):
где
V(р-ра) – объём раствора (л). Эквивалент – это реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода, а в окислительно-восстановительной эквивалентна одному электрону. Фактор эквивалентности Фактор эквивалентности рассчитывают на основе стехиометрии данной реакции из равенства:
Молярной массой эквивалента вещества Х называют величину, измеряемую произведением фактора эквивалентности на молярную массу вещества Х:
где Молярная масса эквивалента вещества – это масса одного моль эквивалентов. В разных реакциях одно и тоже вещество может иметь разные эквиваленты. Моляльная концентрация – это количество вещества, содержащееся в одном килограмме растворителя (моль/кг):
Молярная доля равна отношению количества растворённого вещества к общему количеству веществ в растворе:
Как правило, вещество обладает определённой растворимостью в данном растворителе. Под растворимостью понимают концентрацию вещества в насыщенном растворе. Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором. Насыщенный раствор может как угодно долго находиться в равновесии с избытком растворяемого вещества (ΔGр−ния = 0), и его концентрация имеет максимально возможное в данных условиях значение. Дата добавления: 2015-02-06 | Просмотры: 1103 | Нарушение авторских прав |



 ,
, - количество вещества эквивалента (моль);
- количество вещества эквивалента (моль); - фактор эквивалентности;
- фактор эквивалентности; – число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
– число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции. где z – основность кислоты или кислотность основания данной кислотно-основной реакции, а также число электронов, присоединяемых или теряемых частицей в данной окислительно-восстановительной реакции.
где z – основность кислоты или кислотность основания данной кислотно-основной реакции, а также число электронов, присоединяемых или теряемых частицей в данной окислительно-восстановительной реакции.
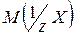 - молярная масса эквивалента.
- молярная масса эквивалента.