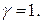|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Ионная сила раствораСильные электролиты в растворе практически полностью диссоциируют на ионы, т.е. истинное значение Наблюдаемые отклонения в свойствах растворов сильных электролитов связаны с сильным электростатическим взаимодействием ионов в растворе. Каждый ион окружён «ионной атмосферой» из ионов противоположного знака, которая влияет на его подвижность и вызывает отклонение свойств от ожидаемых величин. Для характеристики растворов сильных электролитов вместо их истинной концентрации используют активность (
где с – истинная концентрация. Коэффициенты активности определяется экспериментально и приводится в таблицах. Для разбавленных растворов электролитов коэффициент активности (
где I – ионная сила раствора, которая определяется по формуле:
где b (X) – моляльные концентрации ионов; z – заряды ионов. Для предельно разбавленных растворов, в которых практически отсутствует взаимодействие между ионами, Дата добавления: 2015-02-06 | Просмотры: 724 | Нарушение авторских прав |
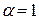 . Однако величина степени диссоциации, определяемая по физическим свойствам этих растворов (электропроводность, температура замерзания и т.д.) всегда меньше единицы. Кроме того, к растворам сильных электролитов неприменим закон действия масс в его обычной форме.
. Однако величина степени диссоциации, определяемая по физическим свойствам этих растворов (электропроводность, температура замерзания и т.д.) всегда меньше единицы. Кроме того, к растворам сильных электролитов неприменим закон действия масс в его обычной форме.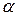 ), т.е. условную эффективную концентрацию в соответствии с которой они проявляют себя в химических и физических процессах:
), т.е. условную эффективную концентрацию в соответствии с которой они проявляют себя в химических и физических процессах: ,
, – коэффициент активности;
– коэффициент активности; ,
, ,
,