|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВК галогенопроизводным углеводородов относят соединения, у которых один или несколько атомов водорода замешены на атомы галогенов. Существуют галогенопроизводные алифатических, ароматических и ненасыщенных углеводородов.
Галогеналканы способны вступать в реакции нуклеофильного замещения. Атом галогена, имея большую электроотрицательность, чем атом углерода, смешает на себя электронную плотность связи С-Hal. В результате атом галогена приобретает частичный отрицательный заряд (δ-), а атом углерода — частичный положительный заряд (δ+). Галогеналканы вступают в реакции с нуклеофильными реагентами, и при этом происходит замещение галогена на нуклеофил. В этих реакциях в результате гетеролитического разрыва связи С-Hal происходит замещение галогена на другие атомы или группы.
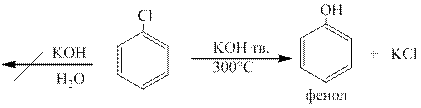
Соединения, в которых галоген непосредственно связан с бензольным ядром, характеризуются низкой реакционной способностью связи С-Наl. Это обусловлено сопряжением неподеленной пары электронов атома галогена с π-электронной системой бензольного ядра. Связь C-Hal имеющая характер двоесвязанности – прочная и близка по энергии аналогичной связи в галоидных винилах.
Для определения галогена в галогенопроизводных существует проба Бельштейна. Она заключается в окрашивании пламени в зеленый цвет при сжигании органического галогенида на медной проволоке. Лабораторная работа №3. Галогенопроизводные.
Дата добавления: 2014-12-12 | Просмотры: 2923 | Нарушение авторских прав |