|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
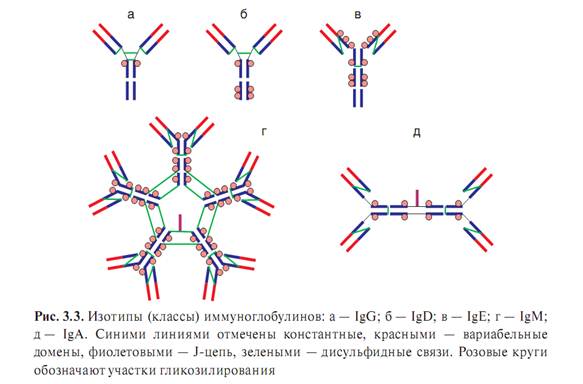
Структурно-функциональные особенности иммуноглобулинов различных классовВ зависимости от особенностей молекулярного строения тяжелой цепи (т. е. наличия изотопических, или групповых антигенных детерминант) различают 5 классов, или изотипов Ig. Молекулы, содержащие тяжелую цепь: 1. а-типа, относят к изотипу А (сокращенно IgA); 2. IgD обладает δ-цепью, 3. IgE— ε-цепью, 4. IgG— γ-цепью 5. IgM — μ-цепью. Соответственно особенностям строения подтипов тяжелых цепей различают и подклассы Ig. В структуре молекул Ig разных классов прослеживается общая закономерность — все они построены из одних и тех же элементов, которые были описаны. Однако для каждого изотипа характерны свои особенности. В частности, IgD, IgE и IgG имеют мономерное строение, IgM — практически всегда является пентамером, а молекула IgA может быть моно-, ди- и тримером. Иммуноглобулин класса G. Изотип G составляет основную массу Ig сыворотки крови. На его долю приходится 70—80 % всех сывороточных Ig, при этом 50 % содержится в тканевой жидкости. Среднее содержание IgG в сыворотке крови здорового взрослого человека 12 г/л. Этот уровень достигается к 7—10-летнему возрасту. Период полураспада IgG — 21 день. IgG — мономер, имеет 2 антигенсвязывающих центра (может одновременно связать 2 молекулы антигена, следовательно, его валентность равна 2), молекулярную массу около 160 кДа и константу седиментации 7S. Различают подтипы Gl, G2, G3 и G4. Синтезируется зрелыми В-лимфоцитами (Ву) и плазматическими клетками. Хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе. Обладает высокой аффинностью. IgGl и IgG3 связывают к омплемент, причем G3 активнее, чем Gl. IgG4, подобно IgE, обладает цитофильностью (тропностью, или сродством, к тучным клеткам и базофилам) и участвует в развитии аллергической реакции I типа. В иммунодиагностических реакциях IgG может проявлять себя как неполное антитело. Легко проходит через плацентарный барьер и обеспечивает гуморальный иммунитет новорожденного в первые 3—4 месяца жизни. Способен также выделяться в секрет слизистых, в том числе в молоко путем диффузии. IgG обеспечивает: 1. нейтрализацию, 2. опсонизацию 3. маркирование антигена, 4. осуществляет запуск комплемент-опосредованного цитолиза 5. антителозависимой клеточно-опосредованной цитотоксич-ности. 6. Иммуноглобулин класса М. Наиболее крупная молекула из всех Ig. Это пентамер, который имеет 10 антигенсвязывающих центров, т. е. его валентность равна 10. Молекулярная масса его около 900 кДа, константа седиментации 19S. Различают подтипы Ml и М2..Тяжелые цепи молекулы IgM в отличие от других изотипов построены из 5 доменов. Период полураспада IgM — 5 дней. На его долю приходится около 5—10 % всех сывороточных Ig. Среднее содержание IgM в сыворотке крови здорового взрослого человека составляет около 1 г/л. Этот уровень у человека достигается уже к 2—4-летнему возрасту. IgM филогенетически — наиболее древний иммуноглобулин. Синтезируется предшественниками и зрелыми В-лимфоцитами (Вц). Образуется в начале первичного иммунного ответа, также первым начинает синтезироваться в организме новорожденного — определяется уже на 20-й неделе внутриутробного развития. Обладает высокой авидностью, наиболее эффективный активатор комплемента по классическому пути. Участвует в формировании сывороточного и секреторного гуморального иммунитета. Являясь полимерной молекулой, содержащей J-цепь, может образовывать секреторную форму и выделяться в секрет слизистых, в том числе в молоко Большая часть нормальных антител и I изоагглютининов относится к IgM. Не проходит через плаценту. Обнаружениеспецифических антител изотипа М в сыворотке крови новорожденного указывает на бывшую внутриутробную инфекцию или дефект плаценты. IgM обеспечивает: 1. нейтрализацию, 2. опсонизацию маркирование антигена, 3. осуществляет запуск комплемент-опосредованного цитолиза 4. антителозависимой клеточно-опосредованной цитотоксичности. Иммуноглобулин класса А. Существует в сывороточной и секреторной формах. Около 60 % I всех IgA содержится в секретах слизистых. Сывороточный IgA: На его долю приходится около 10—15 % всех сывороточных Ig. В сыворотке крови здорового взрослого человека содержится около 2,5 г/л IgA, максимум достигается к 10-летнему возрасту. Период полураспада IgA — 6 дней. IgA — мономер, имеет 2 антигенсвязывающих центра (т. е. 2-валентный), молекулярную массу около 170 кДа и константу седиментации 7S. Различают подтипы А1 и А2. Синтезируется зрелыми В-лимфоцитами (Ва) и плазматическими клетками. Хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе. Обладает высокой аффинностью. Может быть неполным антителом. Не связывает комплемент. Не проходит через плацентарный барьер. IgA обеспечивает: 1. нейтрализацию, 2. опсонизацию 3. маркирование антигена, 4. осуществляет запуск антителозависимой клеточно-опос-редованной цитотоксичности. Секреторный IgA: В отличие от сывороточного, секреторный IgA (slgA) существует в полимерной форме в виде ди- или тримера (4- или 6-валентный) и содержит J- и S-nenтиды. Молекулярная масса 350 кДа и выше, константа седиментации 13S и выше. Синтезируется Ва-лимфоцитами и их потомками — плазматическими клетками соответствующей специализации только в пределах слизистых и выделяется в их секреты. Объем продукции может достигать 5 г в сутки. Пул slgA считается самым многочисленным в организме — его количество превышает суммарное содержание IgM и IgG. В сыворотке крови slgA не обнаруживается. Формирование молекулы slgA происходит при прохождении через эпителиальную клетку, где он присоединяется к секреторному компоненту. На базальной и латеральной поверхности эпителиальная клетка несет рецептор к J-цепи полимерной молекулы Ig (JR). Образующийся после взаимодействия этого рецептора с полимерной молекулой IgA комплекс эндоцитиру-ется клеткой в виде везикулы. Затем везикула переносится к апикальной поверхности эпите-лиоцита, где JR подвергается ферментативному расщеплению. В итоге IgA высвобождается в слизистый секрет просвета органа уже в секреторной форме — оставшийся прикрепленным к молекуле Ig фрагмент JR является S-цепью. Секреторная форма IgA — основной фактор специфического гуморального местного иммунитета слизистых оболочек желудочно-кишечного тракта, мочеполовой системы и респираторного тракта. Благодаря S-цепи он устойчив к действию протеаз. slgA не активирует комплемент, но эффективно связывается с антигенами и нейтрализует их. Он препятствует адгезии микробов на эпителиальных клетках и генерализации инфекции в пределах слизистых. Иммуноглобулин класса Е. Называют также реагином. Содержание в сыворотке крови крайне невысоко — примерно 0,00025 г/л. Обнаружение требует применения специальных высокочувствительных методов диагностики. Молекулярная масса — около 190 кДа, константа седиментации — примерно 8S, мономер. На его долю приходится около 0,002 % всех циркулирующих Ig. Этот уровень достигается к 10—15 годам жизни. Синтезируется зрелыми В-лимфоцитами (Ве) и плазматическими клетками преимущественно в лимфоидной ткани бронхолегочного дерева и ЖКТ. Не связывает комплемент. Не проходит через плацентарный барьер. Обладает выраженной цитофильностыо — тропностыо к тучным клеткам и базофилам. Участвует в развитии гиперчувствительности немедленного типа — реакция I типа. Иммуноглобулин класса D. Сведений об Ig данного изотипа не так много. Практически полностью содержится в сыворотке крови в концентрации около 0,03 г/л (около 0,2 % от общего числа циркулирующих Ig). IgD имеет молекулярную массу 160 кДа и константу седиментации 7S, мономер. Не связывает комплемент. Не проходит через плацентарный барьер. Является рецептором предшественников В-лимфоцитов. Рецепторные иммуноглобулины. Рецепторные, или мембраные Ig, локализуются на цитоплазматической мембране В-лимфоцитов. Выполняют функции антигенспецифических рецепторов. Рецепторные Ig имеют те же изотип и специфичность, что и синтезируемые в межклеточную среду антитела. Структурное отличие от секретируемых антител заключается в особом, дополнительном М-пептиде, благодаря которому молекула рецепторного Ig фиксируется в цитоплазматической мембране иммунокомпетентной клетки. Нормальные антитела. В сыворотке крови человека всегда определяется базальный уровень иммуноглобулинов, которые получили название нормальных, или естественных, антител. К нормальным антителам относят изогемагглютинины — антитела различной аффинности и специфичности направленные против эритроцитарных антигенов групп крови (система АВО), а также против бактерий кишечной группы, кокков и некоторых вирусов. Эти антитела постоянно образуются в организме без явной антигенной стимуляции. С одной стороны, они отражают готовность макроорганизма к иммунному реагированию, а с другой — могут свидетельствовать об отдаленном контакте с антигеном. Моноклональные антитела. Каждый В-лимфоцит и его потомки, образовавшиеся в результате пролиферации (т. е. клон), способны синтезировать антитела с паратопом строго определенной специфичности. Такие антитела получили название моноклональных. В природных условиях макроорганизма получить моноклональные антитела практически невозможно. Дело в том, что на одну и ту же антигенную детерминанту одновременно реагируют до 100 различных клонов В-лимфоцитов, незначительно различающихся антигенной специфичностью рецепторов и, естественно, аффинностью. Поэтому в результате иммунизации даже монодетерминантным антигеном мы всегда получаем поликлональные антитела. Принципиально получение моноклональных антител выполнимо, если провести предварительную селекцию антителопродуцирую-щих клеток и их клонирование (т. е. выделение отдельных клонов в чистые культуры). Однако задача осложняется тем, что В-лимфоциты, как и другие эукариотические клетки, имеют ограниченную продолжительность жизни и число возможных митотических делений. Проблема получения моноклональных антител была успешно решена Д. Келлером и Ц. Мильштейном (1975). Авторы получили гибридные клетки путем слияния иммунных В-лимфоцитов с миеломной (опухолевой) клеткой. Полученные гибриды обладали специфическими свойствами антителопро-дуцента и «бессмертием» раковотрансфор-мированной клетки. Такой вид клеток получил название гибридом. Гибридома хорошо размножается в искусственных питательных средах и в организме животных и в неограниченном количестве вырабатывает антитела. В результате дальнейшей селекции были отобраны отдельные клоны гибридных клеток, обладавшие наивысшей продуктивностью и наибольшей аффинностью специфических антител. Гибридомные моноклональные антитела нашли широкое применение при создании диагностических и лечебных иммунобиологических препаратов. Дата добавления: 2014-12-12 | Просмотры: 1756 | Нарушение авторских прав |