|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ФАКТОРЫ И МЕХАНИЗМЫ НЕСПЕЦИФИЧЕСКОЙ ПРОТИВОИНФЕКЦИОННОИ ЗАЩИТЫ
К врожденным факторам неспецифической противоинфекционной защиты организма относятся: кожные и слизистые покровы, лимфатические узлы, лизоцим и другие ферменты полости рта и желудочно-кишечного тракта, нормальная микрофлора, интерферон, натуральные киллеры (NK) и фагоцитирующие клетки (гранулоциты и макрофаги). К факторам неспецифической защиты также относится система комплемента, представляющая собой комплекс растворимых сывороточных белков, способных по принципу каскада приходить в активное состояние и способствовать уничтожению вторгшегося паразита.
КОЖА И СЛИЗИСТЫЕ ОБОЛОЧКИ
Простейший способ избежать инфицирования — это предотвратить проникновение возбудителя в организм. Главной линией “обороны” служит кожа, которая, оставаясь неповрежденной, непроницаема для большинства инфекционных агентов. Кроме того, вырабатываемые потовыми и сальными железами молочная и жирные кислоты обладают бактерицидным действием, поэтому различные микроорганизмы, не входящие в число постоянных обитателей кожных покровов, быстро исчезают с ее поверхности. Слизь, выделяемая стенками внутренних органов, действует как защитный барьер, препятствующий прикреплению бактерий к эпителиальным клеткам. За счет движения ресничек эпителия микробы вместе со слизью удаляются из организма. Аналогичным вымывающим действием обладают слезы, моча и слюна. Во многих секретах содержатся бактерицидные компоненты, такие как кис/юта в желудочном соке, спермин и цинк в сперме, лактопероксидаза в молоке, лизоцим в слезах, носовых выделениях и слюне.
ЛИЗОЦИМ
Лизоцим является одним из наиболее древних факторов противомикробной защиты. Он расщепляет мураминовую кислоту в составе оболочки чувствительных грамположительных микроорганизмов и в отдельных случаях может даже вызвать бактериолиз. Он синтезируется гранулоцитами, моноцитами и тканевыми макрофагами, может накапливаться в секреторных гранулах и лизосомах фагоцитов. При лизисе грамотрицательных бактерий лизоцим действует совместно с системой комплемента. В связи с этим он является важным фактором сывороточной бактерицидности, одновременно он присутствует также во всех жидкостях организма. Определение уровня его концентрации дает возможность оценить активность фагоцитарной системы. Снижение лизоцима наблюдается и при обострении хронических воспалительных заболеваний
НОРМАЛЬНАЯ МИКРОФЛОРА
Нормальная микрофлора способствует созреванию иммунной системы и поддержанию ее в состоянии высокой функциональной активности, что показано при исследовании гнотобионтов – организмов, развивающихся в стерильных условиях. Выступая в качестве антагонистов, представители нормальной микрофлоры препятствуют адгезии, внедрению и размножению патогенных микроорганизмов. В то же время представители нормальной микрофлоры могут вызывать заболевания в случаях проникновения в большом количестве из одних биотопов в другие и при иммунодефицитах (дисбактериозы).
ФАГОЦИТИРУЮЩИЕ КЛЕТКИ ОРГАНИЗМА
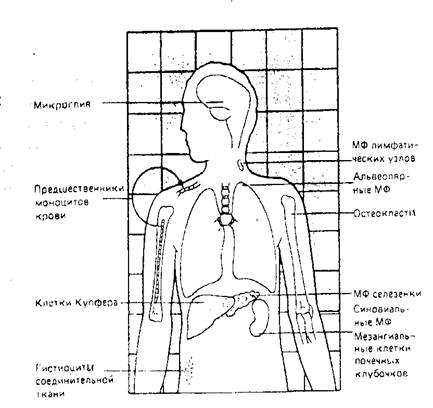
Учение о фагоцитарной системе создано еще И. И. Мечниковым (1896). Под фагоцитозом понимают активное поглощение клетками твердого материала. У одноклеточных этот процесс служил в основном для питания. У многих многоклеточных организмов, включая человека, фагоцитоз служит, прежде всего, фундаментальным механизмом противоинфекционной защиты. Фагоциты представляют собой клетки с особо выраженной способностью поглощать микроорганизмы и другие внедрившиеся в организм чужеродные вещества. Морфологически и функционально различают моноцитарные (макрофаги) и гранулоцитарные (микрофаги) компоненты фагоцитарной системы. Макрофаги и микрофаги имеют общее миелоидное происхождение от полипотентной стволовой клетки костного мозга. Для микрофагов характерно большое количество гранул в цитоплазме. По особенностям окрашивания различают базофильные, эозинофильные и нейтрофильные гранулоциты (лейкоциты). Наиболее многочисленны среди лейкоцитов полиморфно-ядерные нейтрофилы. Ежедневно из костного мозга в кровь выходит 10 названных лейкоцитов, а при острых инфекциях это количество может возрастать в 10 - 70 раз, при этом в крови появляются и не зрелые формы (сдвиг формулы крови влево). Активность нейтрофилов тесно связана с гранулами, содержимое которых представлено ферментами и другими биологически активными веществами: бактерицидные ферменты, нейтральные протеиназы, кислотные гидролазы и прочие вещества (лактоферрин, витамин В12-связывающий белок). С помощью этих вышеназванных ферментов и белков микрофаги осуществляют свою фагоцитирующую функцию. Определенной фагоцитарной активностью обладают и эозинофильные лейкоциты, на клеточных мембранах которых имеются рецепторы для Fc-фрагмента комплемента IqG и белка СЗв-комплемента. Эти клетки фагоцитируют комплексы антиген — IqE — антитело, синтезируют пероксидазу, гистаминазу и другие ферменты, взаимодействуют с тучными клетками. Эозинофилы участвуют в защите организма от аллергенного воздействия в качестве антителозависимых фагоцитов. Велика роль эозинофилов и в локализации паразитарных заболеваний. Макрофаги различных тканей организма (соединительной, печени, легких и др.) вместе с моноцитами крови и их костномозговыми предшественниками (промоноциты и монобласты) объединены в особую систему мононуклеарных фагоцитов (СМФ). Концентрация моноцитов в крови относительно невелика по сравнению с гранулоцитами (1–6% и 60 – 70% соответственно), однако продолжительность жизни значительно выше. В крови моноциты циркулируют до трех суток, а затем мигрируют в прилегающие ткани, где их количество в десятки раз больше, чем в крови. Здесь происходит окончательное созревание моноцитов либо в мобильные гистиоциты (тканевые макрофаги), либо в высокодифференцированные тканеспецифические макрофаги (альвеолярные макрофаги легких, купферовские клетки печени).
Рис.1. Мононуклеарная фагоцитарная система (первоначально включающая эндотелиальные и полиморфнондерные клетки под названием "ретикуло-эндотелиальная система", или РЭС), Предшественники промоноцитов в костном мозге развиваются в циркулирующие моноциты крови, которые со временем распределяются по всему организму в виде зрелых макрофагов (МФ), как показано на рисунке. Другие основные фагоцитирующие клетки – полиморфноядерные нейтрофилы — главным образом остаются в крови, за исключением случаев их локализации в очагах острого воспаления
Морфологическая гетерогенность клеток соответствует функциональному разнообразию мононуклеарной системы. В отличие от полиморфноядерных нейтрофилов, которые обеспечивают основную защиту от пиогенных (гноеродных) бактерий, функция макрофагов в основном связана борьбой с теми бактериями, вирусами и простейшими, которые способны существовать внутри клеток хозяина. У клеток Лангерганса кожи, дендритных клеток селезенки имеется способность перерабатывать и представлять антиген клеткам иммунной системы. В этот момент он может быть узнан соответствующими Т-лимфоцитами. Макрофаги синтезируют и секретируют во внеклеточную среду большое количество различных белков и ферментов: нейтральные протеазы, кислые гидролазы, эндогенный пироген, факторы комплемента, интерлейкин и др. Макрофаги способны к передвижению, поглощению объектов фагоцитоза посредством опсонинов и мембранных рецепторов, обезвреживанию его в лизосомах с помощью ферментов. Все фагоцитирующие клетки характеризуются общностью основных функций, сходством структур и метаболических процессов. Различают четыре последовательно протекающие стадии фагоцитоза: 1. Хемотаксис целенаправленное передвижение фагоцитов в направлении градиента хемоаттрактантов благодаря наличию на мембране фагоцита специфических рецепторов. В качестве хемоаттрактантов могут выступать бактериальные компоненты, продукты некроза тканей организма, активированные фракции системы комплемента — С5а, СЗа, лимфокины. 2. Адгезия — прикрепление фагоцита к мишени, может быть опосредован и не опосредован рецепторами. 3. Эндоцитоз — захватывание, которое может происходить без участия рецепторов, например, при поглощении частичек угля и при участии рецепторов, как в случае поглощения многих бактерий, грибов рода Candida и др. Маннозофруктозные рецепторы фагоцитов узнают при этом углеводные компоненты поверхностных структур микроорганизмов. Наиболее эффективным является фагоцитоз, опосредованный рецепторами для Fc-фрагмента иммуноглобулинов (см. ниже) и для фракции СЗ-комплемента. Эндоцитоз идет по принципу застежки "молния''. 4. Внутриклеточное переваривание происходит в фаголизосомах в результате слияния с первичными лизосомами. Уничтожение микроорганизма происходит в результате "окислительного взрыва" — выброса биологически активных продуктов восстановления кислорода, таких как перекись водорода, супероксидант молекулярного кислорода и гидроксильных радикалов, а также за счет кислороднезависимых механизмов, связанных с высвобождением лизоцима и гидролитических ферментов. Многие вирулентные бактерии часто не погибают и могут длительное время персистировать внутри фагоцитов. Некоторые (токсоплазмы, микобактерии туберкулеза) могут препятствовать слиянию фагосом с лизосомами; другие (гонококки, стафилококки, стрептококки гр. А) обладают устойчивостью к действию лизосомных ферментов; третьи после эндоцитоза покидают фагосому и избегают действия ферментов (риккетсии). В этих случаях фагоцитоз остается незавершенным. Макрофаги при поглощении антигена вырабатывают монокины — вещества, оказывающие регулирующее действие на пролиферацию, дифференциацию и функции фагоцитов, лимфоцитов, фибробластов и других клеток, например, интерлейкин-1, который стимулирует Т-лимфоциты и одновременно оказывает пирогенный эффект. Одновременно макрофаги секретируют лизоцим, компоненты комплемента, интерфероны, кислородные радикалы, благодаря которым могут убивать бактерии без фагоцитоза, а также оказывать цитотоксическое действие на раковые и аллотрансплантированные клетки. Общая функция фагоцитов заключается в представлении на своей наружной мембране фрагментов (антигенных эпитопов) захваченных микроорганизмов. В таком виде возбудители специфически распознаются Т-лимфоцитами. Натуральные киллеры — большие зернистые лимфоциты, которые специализированы для внеклеточного уничтожения. Объектами их нападения являются опухолевые клетки, а также клетки, зараженные некоторыми вирусами или паразитами. Полагают, что они узнают определенные структуры из ненормальных высокомолекулярных гликопротеинов, экспрессируемых на мембране инфицированной или измененной клетки. Предварительный контакт с антигеном не требуется. Главная роль в уничтожении принадлежит секретируемым белкам – перфорину и цитолизину, которые образуют трансмембранную пору на мембране атакуемой клетки, что приводит к ее лизису. Активность натуральных киллеров стимулируют интерфероны.
ИНТЕРФЕРОНЫ
Интерферон является низкомолекулярным белком, обладающим противовирусными свойствами. Впервые открыт в 1957 г. А. Айзексом и Д. Линденманном, которые обнаружили, что клетки, инфицированные вирусом гриппа, начинают вырабатывать в окружающую среду особый белок, препятствущий размножению в них вирусов. Причем животное, зараженное одним вирусом, устойчиво к заражению другим неродственным вирусом. Интерферон рассматривается как один из важнейших факторов защиты организма от первичной вирусной инфекции, кроме того, он обладает еще рядом биологических свойств: способностью ингибировать клеточную пролиферацию и рост опухолевых клеток, угнетать образование антител. Действие интерферона основано на блокаде трансляции мРНК и активации латентной эндонуклеазы, приводящей к деградации мРНК как вируса, так и хозяина. Интерфероны подразделяют на три класса: a, b и g. Интерферон a (лейкоцитарный) обладает выраженной противовирусной активностью, g-Интерферон — главным образом противоопухолевой.
СИСТЕМА КОМПЛЕМЕНТА
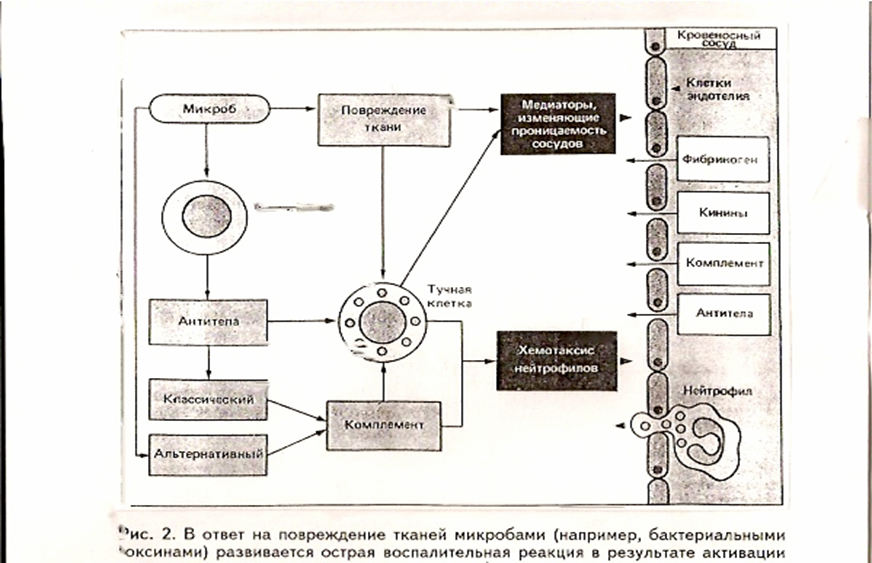
Первые данные о существовании системы, дополняющей иммунологическую реакцию антиген — антитело, были получены в конце XIX в. Бухнером, Ж. Борде и др. Было установлено, что в сыворотке крови всех позвоночных имеется термолабильный фактор, который вызывает лизис мембран паразитов в присутствии специфических антител. Это вещество получило название комплемента (лат. comple — дополнение). В отсутствие комплемента (прогревание при t° 56°) специфические антитела способны вызывать агглютинацию чужеродных клеток, в том числе и бактериальных, однако их гибель не происходит. Добавление же свежей сыворотки, не содержащей антител, но содержащей комплемент, сопровождается лизусом клеток. В последующем были установлены и другие биологические функции комплемента, в частности, активация фагоцитоза, освобождение биологически активных аминов из гранул тучных клеток (гистамин, серотонин, брадикинин), повышение проницаемости клеточных мембран и снижение сосудистого тонуса, положительный хемотаксис, иммунное прилипание (рис. 2).
Рис. 2. В ответ на повреждение тканей микробами (например, бактериальными токсинами) развивается острая воспалительная реакция в результате активации комплемента по альтернативному пути либо с помощью антителозависимого запуска классического пути активации комплемента или дегрануляции тучных клеток (для этого существуют специальные антитела).
В настоящее время известно, что комплемент представляет собой систему сывороточных белков, состоящую из 11 компонентов и 3 ингибиторов. Компоненты, входящие в состав системы комплемента, обозначаются буквой С с порядковыми номерами от 1 до 9. Активация системы комплемента может осуществляться иммуноглобулинами класса М и G, которые входят в состав иммунного комплекса или же без участия иммуноглобулинов, но при участии пропердиновой системы (лат. perder — разрушать). Исходя из этого, существует два пути активации системы комплемента. Первый носит название классического, или антителозависимого, а второй – альтернативного, или пропердинового. ПРОПЕРДИН
Пропердин — белок с молекулярным весом 220 000, обнаруженный в сыворотке крови Пиллемером с сотр. в 1954 — 1956 гг. Свою активность пропердин проявляет только в присутствии в сыворотке крови ионов Мд+2 и компонентов комплемента. Комплекс пропердин-коминт Мд2+ получил название системы пропердина. Система пропердина состоит из самого пропердина и трех дополнительных сывороточных белков (Н, В, Д), которые принимают участие в расщеплении СЗ-компонента комплемента. Особенность альтернативного пути активации комплемента состоит в том, что инициация может происходить без участия комплекса антиген — антитело за счет полисахаридов и липополисахаридов бактериального происхождения. Спонтанное расщепление компонента СЗ при связывании его фрагмента СЗв на бактерии в присутствии пропердинового комплекса приводит к образованию компонента СЗвВв, обладающего высокой СЗ-конвертазной активностью. Последующий каскад превращений терминальных белков С5 – С9 приводит к образованию трубчатообразного мембраноатакующего комплекса (МАК), который нарушает целостность мембраны клетки мишени и приводит к ее лизису. Одновременно низкомолекулярные фрагменты СЗв и С5а. названные анафилатоксинами, стимулируют выброс тучными клетками гистамина, гепарина и других медиаторов, вызывающих расширение капилляров, эксудацию белков плазмы, а также хемотоксическое привлечение полиморфноядерных клеток к СЗв-нагруженной бактерии, что приводит к ее уничтожению. Дата добавления: 2014-12-12 | Просмотры: 861 | Нарушение авторских прав |