|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ОРГАНЫ ИММУННОЙ СИСТЕМЫ
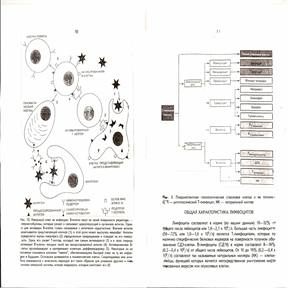
Понятие "иммунная система" означает единство разных органов и клеток, связанных общностью происхождения, функциональным взаимодействием и общими механизмами регуляции. Лимфоциты, которые являются основными клетками иммунной системы, как и другие клетки крови, развиваются из стволовых клеток в костном мозге. Одна из популяций — В-клетки — здесь же завершает свое развитие, а лимфоциты другого класса — Т-клетки — претерпевают дальнейшую дифференцировку в тимусе (вилочковой железе). Дифференцировка Т-клеток проходит в два этапа: сначала в корковом слое они активно размножаются, затем в мозговом под действием тимических гормонов и факторов микроокружения превращаются в зрелые Т-лимфоциты различных субпопуляций (рис. 3). Костный мозг и тимус являются центральными органами иммунной системы. К периферическим лимфоидным органам относятся многочисленные скопления лимфоидной ткани, располагающиеся под слизистыми оболочками желудочно-кишечного, дыхательного и мочеполового трактов, лимфатические узлы и селезенка. Наиболее эффективно иммунный ответ происходит в периферических лимфоидных органах. Лимфатические узлы фильтруют и осуществляют контроль за лимфой, текущей от тканей организма, а селезенка осуществляет контроль за цитологическим составом крови. Т- и В-области в этих органах отделены. Лимфоидная ткань (миндалины, пейеровы бляшки, апендикс) ответственна за синтез протективных антител класса 1дА. Взаимодействие лимфоцитов с антигенами, что необходимо для возникновения иммунного ответа, происходит в лимфоузлах. В этом обязательно участвуют макрофаги и другие презентирующие клетки.
Рис. 3. Плюрипотентная гомопоэтическая стволовая клетка и ее потомки: ЦТП – цитотоксический Т-лимфоцит, NK – натуральный киллер
ОБЩАЯ ХАРАКТЕРИСТИКА ЛИМФОЦИТОВ
Лимфоциты составляют в норме (по нашим данным) 18—32% от общего числа лейкоцитов или 1,6—2,1 х 109/л. Большая часть лимфоцитов (56—72% или 1,0—1,6 х 109/л) является Т-лимфоцитами, которые по наличию специфических белковых маркеров на поверхности получили обозначение СДЗ-клетки. В-лимфоциты (СД19) в норме составляют 8 - 16% (0,2 0,4 х 10'/л) от общего числа лейкоцитов. От 10 до 19% (0,2—0,4 х 109/л) составляют так называемые натуральные киллеры (NK) — клетки-убийцы, функцией которых является непосредственное уничтожение инфицированных вирусом или опухолевых клеток. В лимфоциты — это клетки, которые производят антитела. Согласно клонально-селективной теории, предложенной 40 лет назад Ф. Бернетом, каждый В-лимфоцит, завершив созревание в костном мозге, запрограммирован на синтез антител определенной специфичности, т. е. узнающих один специфический антиген. Антитела, синтезированные в В-лимфоците, остаются связанными с его клеточной мембраной, где они располагаются на поверхности в качестве молекул-рецепторов (на поверхности каждой В-клетки экспрессируется около 10" молекул антител). Связывание антитела с антигеном на мембране является для клетки символом к пролиферации. Поскольку лимфоцит запрограммирован на синтез антител только одной специфичности, иммуноглобулины, синтезированные В-клеткой, будут идентичны своему оригиналу. Сенсибилизированные лимфоциты проходят несколько стадии пролиферации и формируют большой клон. Таким образом, антиген сам отбирает для себя антитела. В этом и состоит отбор (селекция) клонов. Обычно на одиночную инфекцию отвечает сразу много клонов. Антигенные маркеры, узнаваемые антигенами, представляют собой сравнительно небольшие молекулярные структуры. Даже один вирус или бактерия несет на себе много антигенных маркеров. Размножение каждого такого клона приводит к образованию двух типов клеток. Некоторые из клеток остаются циркулировать в организме, являясь клетками иммунологической памяти: когда в организм попадет тот же антиген, они обеспечивают быстрый и более сильный ответ (рис. 4).
Рис. 4. Первичный и вторичны ответ. Кролику вводили столбнячный анатоксин в два приема. Ответ при повторном контакте с антигеном наступает быстрее и протекает с большей интенсивностью.
Клетки памяти ответственны за иммунитет, который развивается после многократной инфекции в результате вакцинации. Другие клетки отобранных клонов претерпевают окончательную дифференцировку: они вырастают до больших размеров, прекращают размножение и начинают активно секрегировать антитела. Такие В-лимфоциты называются плазматическими клетками, они живут только несколько дней, но успевают произвести большое количество специфических к данному антигену антител, относящихся к разным классам: IgA, IgM, IgG и др. Приобретенный иммунитет специфичен: возникшая иммунологическая память к одному виду микроорганизмов не обеспечивает защиту от другого вида. Молекулы антител сами не могут разрушить чужеродный организм. Они лишь "отмечают" его, чтобы врага смогли узнать другие защитные системы, которые и уничтожат его. Одна из них — это система комплемента. Активация системы комплемента в этом случае отличается от описанного ранее, и сам путь получил название "классического". Инициация по этому пути происходит в тот момент, когда антитело, соединенное с микробом, связывает и активирует первый компонент каскада Cl-эстеразу, под действием чего формируется энзиматический активный комплекс (С4в 2в), называемый СЗ-конвертазой. Образующиеся СЗа и СЗв, действуя аналогично, как в альтернативном пути, формируют мембраноатакующий комплекс (МАК) и вызывают острую воспалительную реакцию. Кроме того, комплексы антиген — антитело привлекают макрофагов, которые поглащают и переваривают чужеродные частицы. Нагруженная несколькими антителами бактерия очень прочно соединяется с фагоцитом. Подсчитано, что 3 близко расположенных антитела притягивают бактерию к макрофагу в 1000 раз сильнее, чем одно антитело. Что из себя представляет антитело и как оно узнает антиген? Антитела — это белки плазмы крови, которые по своему химическому составу относятся к гликопротеидам с молекулярным весом от 150 000 до 900 000. Антитела — самые разнообразные из всех известных белков и способны образовывать комплементарные пары с любым антигеном, являющимся "чужим" для данного организма. Исследование структуры иммуноглобулинов стало возможным благодаря экспериментам, проведенным английским иммунологом Р. Портером и американским биохимиком Дж. Эдельманом в 1959 г. Р. Портер обработал антитела, в частности IgG, папаином и получил три фрагмента молекулы иммуноглобулина, причем два из них оказались идентичными и обладали способностью соединяться с антигенами. Поэтому их назвали Fab-фрагментами (фрагмент антигенсвязывающий). Третий фрагмент мог кристаллизироваться и в связи с этим его обозначили как Fc – фрагмент (англ. Crystalline fragment – фрагмент кристаллизирующийся), рис. 5.
Рис. 5. Вариабельность аминокислот в молекуле антитела. Термины «V-область» и «С-область» используют для обозначения вариабельных и константных областей соответственно. «VL» и «CL» - обозначения этих областей легкой цепи, а «VH» и «CH» - тяжелой. Как уже отмечалось, в состав каждой молекулы антитела входят идентичные пары легких и тяжелых цепей.
Молекула иммуноглобулина имеет две пары легких (англ. light — легкий) и две пары тяжелых (англ. hean — тяжелый) цепей, соответственно и Н-цепи. Димер пары: легкая и тяжелая цепь является основной структурной единицей всех иммуноглобулинов. Существует пять подклассов тяжелых цепей, обозначаемых буквами m, g, a, e, d и соответствующих пяти классам иммуноглобулинов М, G, А, Е, D, а также два класса легких цепей l и х. Тяжелые и легкие цепи за счет аминокислотной последовательности состоят из вариабельной и константной частей- Константный участок состоит из нескольких гомологичных участков, называемых доменами (франц. domeina — область). Во всех вариабельных областях есть еще и гипервариабсльные участки с высокой степенью изменчивости аминокислотного состава. В сыворотке здорового индивидуума содержится не менее 108 различных Ig. Основная функция иммуноглобулина состоят в том, что он участвует в образовании иммунного комплекса, что обеспечивается наличием активных центров в Fab- фрагментах. Кроме того, он участвует в активации системы комплемента, может оседать на клетках, имеющих рецептор к Fc-фрагменту, и тем самым усиливает фагоцитоз, а также может участвовать в клеточной цитотоксичности, которая зависит от антител. У человека определено пять типов известных цепей и соответственно пять классов Ig. IgG — наиболее распространенный иммуноглобулин, в сыворотке крови его около /5% от всего количества иммуног-лобулинов, что составляет от 6,9 до 22 г/л. Иммуноглобулины класса G после внедрения антигена появляются к 14 дню. IgG проникает через сосудистую стенку, поэтому его можно обнаружить в межтканевом пространстве, где находится до 50% от имеющихся в организме IgG, a также проникает через плаценту, чем обеспечивает иммунитет плода и новорожденных в первые месяцы после рождения. IgM в сыворотке крови представлен в виде пентамерной формы. Пять структурных молекул IgM расположены радиально, причем Fc-фрагменты направлены в центр круга, а Fab-фрагменты наружу. Антитела этого класса иммуноглобулинов вырабатываются на 2 – 3 день от момента иммунизации, причем на тимуснезависимые антигены вырабатывается только IgM, он находится только в сосудистом русле, не проникает через плаценту, является сильным активатором системы комплемента. Количество IgM в сыворотке крови матери составляет 0,48 — 2 г/л, а наличие его у плода указывает на внутриутробное инфицирование. IgA составляет лишь 10 — 15% всех иммуноглобулинов сыворотки, однако они преобладают в экстраваскулярных секретах (слюне, слезах, пищевых соках, секретах слизистой носа, женском молоке),где они находятся в виде секреторного IgA (SIgA). Наличие в большом количестве SIgA в женском молоке, особенно в молозиве, обеспечивает защиту желудочно-кишечного тракта и слизистой ротовой полости новорожденного от различных антигенов и, прежде всего, от возбудителей инфекционных заболеваний. Концентрация IgA в сыворотке составляет 0,7 — 0,5 г/л. IgE содержится в сыворотке крови в небольшом количестве. Его особенность состоит в том, что он способен фиксироваться на базофи-лах и тучных клетках, что объясняется наличием на них рецепторов к Fc-фрагментам IgE. В связи с этим IgE называют цитофильным имму-ноглобулином. IgE накапливается в организме при поступлении аллергена. Он соединяется с этим аллергеном в иммунный комплекс (IgE + Ад), который разрушает тучные клетки и базофилы, при этом высвобождаются биологически активные вещества, которые играют ведущую роль в развитии аллергических реакций. IgE имеет особое значение при паразитных инвазиях. По-видимому, основная функция IgE – защита внешних слизистых оболочек организма путем локальной индукции острой воспалительной реакции против инфекционных агентов, прорвавших "линию обороны", образованную IgA. IgD обнаруживается в сыворотке в очень небольших количествах и его роль как сывороточного иммуноглобулина не совсем ясна. Как рецепторный, IgD находится на В-лимфоцитах, причем он появляется на мембране относительно зрелых клеток, поэтому его наличие может служить свидетельством зрелости В-лимфоцитов. Возможно, взаимодействие lgD-рецепторов осуществляет контроль за активацией и супрессией лимфоцитов. Генетические основы колоссального разнообразия антител до сих пор до конца не ясны. Наиболее популярной является модель У. Дрейера и Ф. Бернет (1965), которая предполагает, что для каждого из входящих в состав антител полипептидов не требуется отдельный ген. Огромное разнообразие белков появляется в результате комбинирования всего нескольких сотен генных сегментов, кодирующих независимо друг от друга V, I и С-участки легких цепей и аналогичные участки тяжелых цепей и, наконец, мутации пролиферирующих В-клеток (рис. 6 и 7). Т-лимфоцитам принадлежит решающее значение в иммунном ответе. В отличие от В-лимфоцитов, их дифференцировка требует дозревания (обучения) в тимусе, но презентация антигена, как и для В-лимфоцита, происходит в лимфоузлах. Обычно различают 4 субпопуляции Т-лимфоцитов, отличающихся друг от друга по своим функциям: Т-хелперы, Т-супрессоры, Т-индукторы и Т-киллеры. Т-киллеры оказывают непосредственное действие на антиген, остальные выполняют регуляторную функцию. Каждая субпопуляция Т-лимфоцитов клонирована. Антигензависимая дифференцировка начинается с момента распознавания антигена и заканчивается образованием лимфоцитов, способных оказывать специфическое действие как по отношению к антигену так и к другим иммунокомпетентным клеткам, вступившим во взаимодействие с антигеном (т. е. вступает в кооперацию). Причем хел-перные, супрессорные и цитотоксические лимфоциты распознают антиген по-разному. Для хелперной и супрессорной субпопуляции существуют свои индукторы. Под влиянием интерлейкинов, медиаторов индукторных клеток Т-лимфоциты, вступившие в контакт с антигеном, пролиферируют и дифференцируют в эффекторные клетки и клетки иммунологнческой памяти. В процессе антигензависимой дифференци-ровки Т-хелперы начинают выделять медиаторы, стимулируя к пролиферации Т-киллеры, В-лимфоциты. Т-киллеры (цитотоксичные лимфоциты), несущие CD8 – маркеры. Основная функция этих клеток — выявлять мутантные, опухолевые клетки или клетки организма. зараженные вирусами. Кроме того, Т-киллерам принадлежит ведущая роль в отторжении трансплантанта, а также при ряде аутоим-мунных процессов. В отличие от натуральных киллеров (NK) эти клетки отличаются очень широкой специфичностью, поскольку клонально экс-прессируют многочисленные поверхностные рецепторы, сходные с таковыми у В-лимфоцитов. Т-киллеры, обнаружив собственные измененные клетки или клетки трансплантанта, претерпевают этап антигензависимой дифференцировки и превращаются в истинные киллеры, т. е. в Т-лимфоциты, способные оказать специфическое цитотоксическое действие.
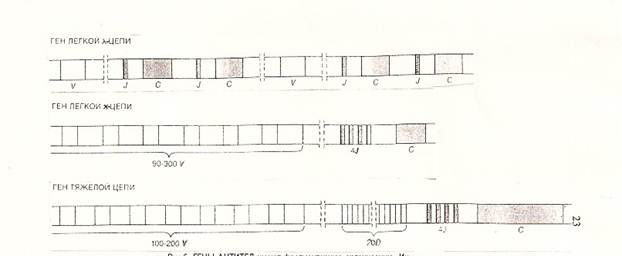
Рис. 6. ГЕНЫ АНТИТЕЛ имеют фрагментарную организацию. Их сегменты находятся в геноме на расстоянии (иногда значительном) друг от друга. В антителах млекопитающих легкие цепи бывают двух типов. У мыши для легких цепей типа ƛ имеются два V – сегмента, которые кодируют большую часть вариабельного домена, и четыре С – сегмента. Перед началом каждого С – сегмента находится короткий фрагмент ДНК, называемый J – сегментом; он может соединиться с V – сегментом. Каждый V – сегмент V – сегмента может соединиться с любой парой J – С. Для легких цепей типа χ существует несколько сотен V – сегментов, четыре J – сегмента и один С – сегмент. Гены тяжелых цепей организованы также, но еще более раздроблены: помимо сегментов V и J есть еще около 20 D – сегментов. Эти три набора сегментов (для легких цепей ƛ, для легких цепей χ и для тяжелых цепей) расположены на трех разных хромосомах. Гены рецепторов Т-клеток организованы подобно генам тяжелых цепей антител.
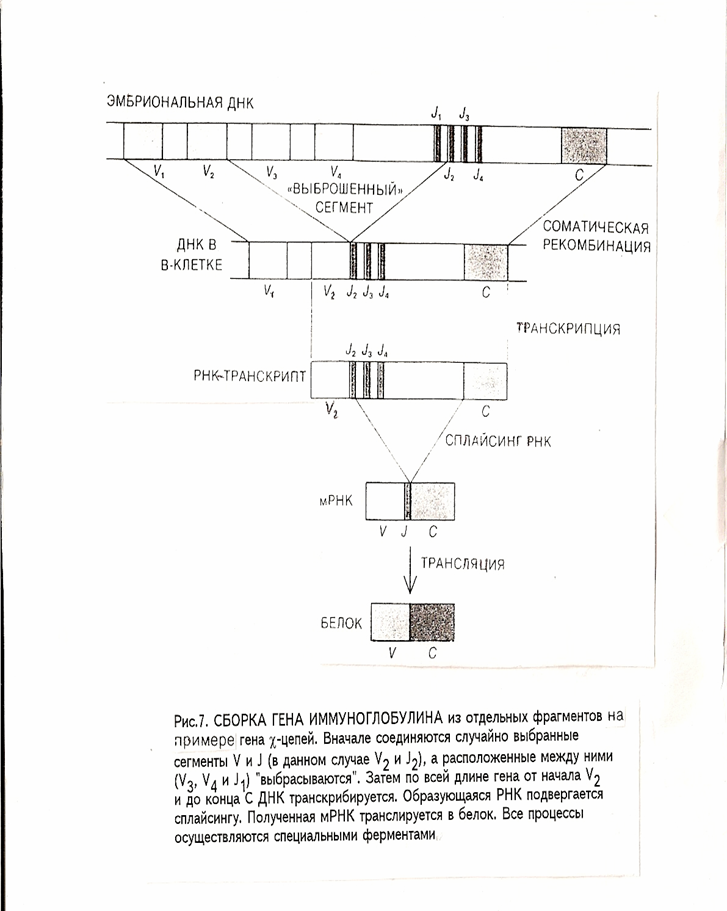
Рис. 7. СБОРКА ГЕНА ИММУНОГЛОБУЛИНА из отдельных фрагментов на примере гена χ-цепей. Вначале соединяются случайно выбранные сегменты V и J (в данном случае V2 и J2), а расположенные между ними (V3, V4 и J1) «выбрасываются». Затем по всей длине гена от начала V2 и до конца С ДНК транскрибируется. Образующаяся РНК подвергается сплайсингу. Полученная мРНК транслируется в белок. Все процессы осуществляются специальными ферментами.
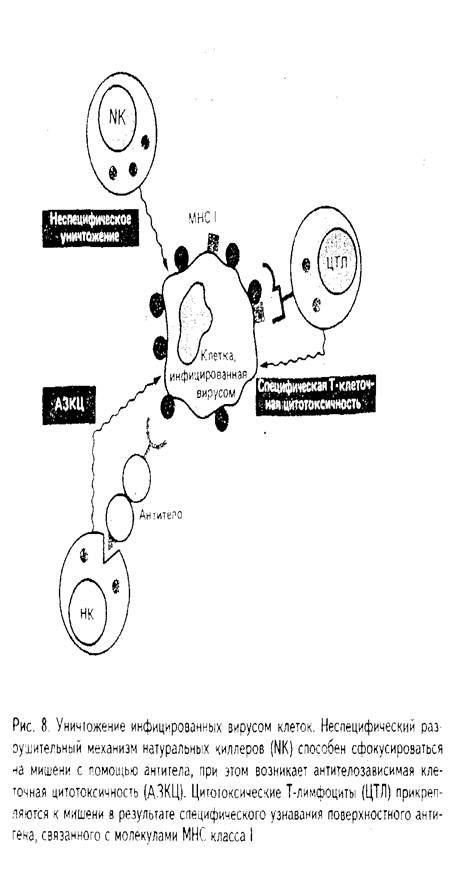
Реализация цитолиза осуществляется за счет специфического белка киллерных клеток — перфорина (просверливать). Т-киллер способен узнавать антиген только в комплексе с клеточным маркером — молекулами основного комплекса гистосовместимости (МНС) класса 1, присутствующими на всех клетках (рис. 8).
Рис. 8. Уничтожение инфицированных вирусом клеток. Неспецифический разрушительный механизм натуральных киллеров (NK) способен сфокусироваться на мишени с помощью антитела, при этом возникает антителозависимая клеточная цитотоксичность (АЗКЦ). Цитотоксические Т-лимфоциты (ЦТЛ) прикрепляются к мишени в результате специфического узнавания поверхностного антигена, связанного с молекулами МНС класса I. Т-хелперы. На большинство природных антигенов иммунный ответ без участия Т-лимфоцитов не осуществляется. Для этого необходима межклеточная кооперация, на начальных этапах которой происходит чрезвычайно важный для индуцирования иммунного ответа процесс распознавания антигена. Т-хелперы, узнав антиген, стимулируют основные компоненты иммунной системы, т. е. В-клетки и другие Т-клетки, специфичные к данному антигену. В отличие от В-лимфоцитов, которые могут узнавать свободный антиген, Т-хелперы распознают антиген только на мембране фагоцита, причем обязательно в комплексе с МНС класса 2. Это позволяет говорить о генетическом контроле иммунного ответа продуктами генов МНС-снстемы. Распознавание антигена Т-хелпером является центральным процессом как в гуморальном иммунном ответе, так и в усилении клеточной формы иммунного ответа. Т-индукторы. Особую группу клеток составляют Т-индукторы, которые играют важную роль в антигензависимой дифференцировке хелперных и супрессорных клеток и не оказывают эффекта на В-лим-фоциты. Различают индукторы Т-хелперов (иТх) и индукторы Т-супрессоров (иТс). И те и другие свою функцию реализуют специфическими медиаторами. Распознавание антигена происходит без участия продуктов МНС-системы. Таким образом, Т-индукторы могут связываться с антигеном непереработанными антигенпредставляющими клетками.
ВИДЫ И ФОРМЫ ИММУНИТЕТА
Специфические факторы защиты, объединенные понятием "приобретенный иммунитет", зависят, преждевсего, от иммунной системы организма и ее способности к полноценному ответу на данный конкретный антиген. В зависимости от источника специфической устойчивости выделяют: естественный (видовой) иммунитет, при котором наблюдается невосприимчивость одного вида животных или человека к микроорганизмам, вызывающим заболевания у других видов (например, чума собак для человека), и приобретенный, формирующийся в процессе индивидуального развития организма после контакта с возбудителем. Иммунитет, приобретенный в результате перенесенного инфекционного заболевания, называется постинфекционным, а после введения в организм вакцины поствакцинальным. Приобретенный иммунитет может быть активным и пассивным. Активный иммунитет формируется после перенесения того или иного инфекционного заболевания или искусственного введения в организм ослабленного возбудителя или его фрагмента в составе вакцины. В результате этого формируются специфические антитела, способные связываться с микроорганизмами или их токсинами. Пассивный иммунитет возникает после введения в организм готовых антител, которые выработались у другого организма после его болезни или вакцинации. Например, сыворотка крови животных, иммунизированных токсином бактерий дифтерии, предупреждает заболевание у человека. Разновидностью пассивного иммунитета является плацентарный иммунитет, связанный с получением плодом готовых антител через кровь от матери. Наиболее устойчивым из перечисленных является врожденный иммунитет, наименее устойчивым — пассивный, он сохраняется в среднем 15 – 20 дней, пока из организма не будут выведены чужеродные антитела. В зависимости от объекта, на который направлены антитела, выделяют антимикробный и антитоксический иммунитет. В первом случае он направлен против различных микроорганизмов, во втором - против вырабатываемых ими токсинов (например, столбняка и ботулизма). Рассмотренные виды иммунитета можно представить схематически (рис. 9 и 10).
Рис. 9. Две триады, объединяющие врожденный и приобретенный иммунитеты.
Рис. 10. Упрощенная схема взаимодействия между механизмами врожденного и приобретенного иммунитетов.
МЕЖКЛЕТОЧНАЯ КООПЕРАЦИЯ ПРИ РАЗЛИЧНЫХ ФОРМАХ ИММУННОГО ОТВЕТА
Принято различать четыре типа иммунного ответа: гуморальный ответ, клеточный ответ, иммунологическая память, иммунологическая толерантность. Гуморальный ответ представляет собой выработку специфических антител (иммуноглобулинов), которые выполняют эффекторные функции: узнавание, адгезия и запускание фагоцитоза, активация комплемента. Клеточный иммунный ответ представляет собой образование большого количества антигенспецифических активных Т-лимфоцитов, выполняющих свои функции или непосредственно, или посредством выделяемых медиаторов — лимфокинов. Иммунологическая память — это способность организма отвечать на второй контакт с антигеном (возбудителем) более интенсивно, чем при первой встрече. Иммунологическая толерантность, явление, обратное иммунному ответу, когда иммунная система не реагирует на антигены собственного организма. Во всех случаях иммунный ответ является результатом взаимодействия различных типов клеток иммунной системы: макрофагов. Т- и В-лимфоцитов. Можно выделить два пути взаимодействия между клетками. Первый заключается в непосредственном действии антигенов на комплементарные рецепторы соответствующих В- и Т-лимфоцитов при прямом узнавании антигена, встроенного в мембрану макрофагами, Т-хелперами (напомним, в комплексе с МНС класса II), что будет являться пусковым сигналом для пролиферации и дифференцировки каждого типа клона. Другой путь опосредован специфическими растворимыми биополимерами, получившими название цитокинов. В этом случае активированные макрофаги вырабатывают монокин интерлейкин-1 (ИЛ-1), который стимулирует Т-хелперы, а те, в свою очередь, вырабатывают различные лимфокины: интерлейкин-2, 3 и др., которые стимулируют другие Т- и В-лимфоциты (рис. 11). Рассмотрим механизмы таких клеточных взаимодействий более подробно (рис. 12 и 13).
Рис. 11. Межклеточная кооперация при различных формах иммунного ответа.
Рис. 12. Иммунный ответ на инфекцию. В-клетки несут на своей поверхности рецепторы – иммуноглобулины, которые узнают и связывают циркулирующий в организме антиген. Однако для активации В-клеток только связывания с антигеном недостаточно. Вначале антиген захватывается представляющей клеткой (1); в этой роли может выступать макрофаг. Антиген подвергается внутри макрофага (2) определенным превращениям и попадает на его поверхность. Здесь его узнает Т-хелпер, который тем самым активируется (8) и в свою очередь активирует В-клетки, несущие такой же процессированный антиген (4). Активированные В-клетки пролиферируют и претерпевают конечную дифференцировку (5). Некоторые из их потомков становятся клетками «памяти», обеспечивающими быстрый ответ на ту же инфекцию в будущем. Остальные развиваются в плазматические клетки. Секретируемые ими антитела связываются с антигеном, маркируя его таким образом для узнавания другими компонентами иммунной системы, включая макрофаги, которые уничтожат его (6).
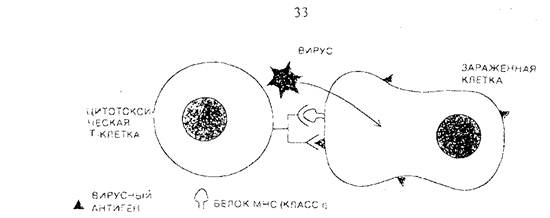
Рис. 13. Иммунный ответ на вирусную инфекцию. Когда вирус попадает в клетку, вирусные белки остаются на клеточной мембране. Цитотоксические Т-клетки специфически распознают такие чужеродные молекулы, если они находятся рядом с белками МНС класса I, определяющими иммунологическую индивидуальность клетки-хозяина. Цитотоксическая Т-клетка убивает зараженную клетку Гуморальный иммунный ответ представляет собой выработку антител (иммуноглобулинов) плазматическими клетками, образовавшимися в процессе дифференцировки из В-лимфоцитов. Антитела выполняю роль специфического адаптера для связывания с теми микроорганизмами, которые не запускают альтернативный путь активации комплемента либо предотвращают активацию фагоцитирующих клеток. В-клетки способны отвечать на три различных типа антигенов: — тимуснезависимые антигены типа 1, например, бактериальный липополисахарид высокой концентрации, способны к поликлональной (т. е. неспецифической) активации значительной части В-лимфоцитов, — некоторые линейные антигены, например, полисахарид пневмококков, способны длительно персистировать на поверхности специализированных макрофагов и стимулировать В-клетки; оба типа тимус-независимых антигенов продуцируют только 1дМ и не образуют клеток памяти; — большинство антигенов, связавшись с соответствующими рецепторами В-клетки, не способно самостоятельно вызвать ее активации и нуждается в помощи Т-хелперов в качестве носителя: данный тип антигенов получил название тимусзависимого. Таким образом, начальный этап гуморального ответа состоит в распознавании антигенных эпитопов Т-хелперами или непосредственно В-лимфоцитами на мембране макрофагов. Это распознавание обязательно происходит с участием главного комплекса гистосовместимости (МНС) класса II. В свою очередь, В-лимфоциты представляют антиген, который связывается с их иммуноглобулиновыми рецепторами, и эксдрессируют его на своей поверхности в комплексе с МНС класса II. Однако для полноценного гуморального ответа В-клетки должны получить второй неспецифический сигнал активации, который поступает через клеточные медиаторы: ИЛ-1 (монокин) макрофагов, BSF-1 м другие, продуцируемые Т-хелперами. Таким образом, специфический гуморальный ответ — синтез специфических антител — развивается при участи трех типов клеток: антнгенпредставляющих макрофагов, Т-хелперов и В-лимфоцитов, причем последние должны получить два сигнала. В противном случае реализуются иные формы гуморального ответа: 1. При получении В-лимфоцитом антигенной информации в отсутствии соответствующих Т-хелперов формируется иммунологическая толерантность. 2. При получении только медиаторного сигнала (цитокины) начинается синтез неспецифических иммуноглобулинов. 3. При распознавании эпитопов микроорганизма на мембране макрофага без участия Т-хелперов синтезируется только IgM. Клеточный иммунный ответ обеспечивает защиту от внутриклеточных паразитов, клеток мутантов собственного организма или транс-плантанта. Напомним, что некоторые микроорганизмы способны жить внутри клеток-хозяев, в частности, в макрофагах. К таким, так называемым факультативным внутриклеточным паразитам, относятся мико-бактерии, лейшмании, возбудители проказы. Облигатные внутриклеточные паразиты, такие как вирусы, всегда размножаются внутри инфицированных клеток. И для тех и для других это обеспечивает защиту и неуязвимость для гуморальных антител и макрофагов. Как выход из подобной ситуации, возникла совершенно самостоятельная система приобретенного иммунитета, основанного на функционировании отдельной субпогуляции лимфоцитов, а именно Т-лимфоцитов. Как и В-лимфоциты, каждая Т-клетка имеет специфический рецептор, распознающий антиген. Образование комплекса между Т-клеточным рецептором и антигеном вызывает активацию покоящегося Т-лимфоцита и клональную экспансию, приводящую к образованию эффекторных клеток и клеток памяти, функционирование которых лежит в основе специфического приобретенного иммунитета. Но поскольку Т-лимфоциты должны взаимодействовать с содержащими паразитов клетками, они узнают антиген только в том случае, если он экспрессирован на поверхности клетки. Соответственно их собственные поверхностные рецепторы в отличие от молекул антител поверхностных маркеров В-лимфоцитов, узнают антиген только в комплексе с поверхностным маркером главного комплекса гистосовместимости (МНС). Для разных субпопуляций Т-лимфоцитов это происходит по-разному. Т-хелперы узнают антиген в комплексе с МНС класса II на мембране макрофага, который его частично переработал и презентировал на своей поверхности. Хотя внутриклеточные паразиты способны выжить внутри макрофагов, разрушая механизмы уничтожения, присущие этим клеткам, они не могут помешать макрофагам переработать небольшие фрагменты антигенов (возможно принадлежащие спонтанно погибшим микроорганизмам) и экспрессировать их на свою поверхность. Пусковым сигналом к активации Т-хелпера оказывается тройное взаимодействие между антигеном, гликопротеидом МНС и рецептором СД-4 Т-лимфоцита. Одновременно на Т-хелпер действует высокая локальная концентрация ИЛ-1, продуцируемого фагоцитирующим макрофагом. Активированный Т-хелпер не только начинает пролиферировать, но и продуцирует разнообразные растворимые лимфокины, в том числе у-интерферон и другие вещества, которые активируют макрофаги, запуская поврежденные ранее бактерицидные механизмы, и в результате вызывают гибель внутриклеточных микроорганизмов. Клеточная реакция иммунного воспаления включает также выделения Т-хелперами ряда факторов, привлекающих и удерживающих в очаге инфицирования макрофагов. Т-киллеры, называемые также цитотоксическими лимфоцитами, распознают антиген в комплексе с МНС 1, имеющимися на всех клетках конкретного организма. Активация данного типа лимфоцитов происходит под влиянием ИЛ-2, вырабатываемого активированным Т-хелпером. Т-киллер также продуцирует у-интерферон, обладающий, кроме действия на макрофаги, способностью ограничивать проникновение вируса в соседние клетки. Различия в механизме узнавания объясняются различиями в биологии внутриклеточных паразитов: Т-киллеры атакуют клетки, инфицированные вирусами, Т-эффекторы (так называют Т-хелперы, обеспечивающие гиперчувствительность замедленного типа) — клетки, инфицированные простейшими и бактериями. Обнаружение Т-киллером экспрессии вирусного антигена на мембране любой клетки характерно для скрытой фазы инфекции, когда клеточный аппарат перестраивается для репликации вируса. Уничтожение клетки в этой фазе инфекции предотвращает репликацию вируса. Иная ситуация с внутриклеточными бактериями и простейшими. Лизис клетки-носителя макрофага приведет не к гибели возбудителя, а лишь к его высвобождению без инактивации. Поэтому единственный выход —- повысить элиминирующую активность самих макрофагов. Это достигается воздействием на них веществ, называемых факторами, активирующими макрофаги (ФАМ), одним из которых является g-интерферон. Эти особенности объясняют также участие именно Т-киллеров в противоопухолевой защите. Активированные Т-клетки секретируют интерлейкин-2, стимулирующий деление клеток, обладающих рецепторами к ИЛ-2: В-лимфоцитов и Т-киллеров, секретируют лимфокин BSF-1, активирующий В-клетки, фактор роста В-клеток (BCCrF=ll) и другие лимфокины. По мере созревания клеток эффект лимфокииов, стимулирующих пролиферацию, ослабевает. Необходимость саморегуляции как механизма поддержания гомеостаза предполагает существование в противоположность Т-клеткам, усиливающим иммунный ответ других субпопуляций, клеток, деятельность' которых заключалась в том, чтобы эти процессы не выходили из-под контроля. Оказалось, что такую функцию выполняютклетки – супрессоры, некоторые цитокины и медиаторы. Индукторы супрессорных клеток активируются при контакте с антигеном, презентированным клетками, которые несут антигенные детерминанты (-) продуктов МНС класса II. Показано, что в супрессии принимают участие антигенспецифические, идиотипспецифические и неспецифические клетки-супрессоры. Первые подавляют иммунный ответ только на антиген, который используется для иммунизации. Они несут антигенраспознающие рецепторы и секретируют антигенспецифический супрессивный фактор, “мишенью” для которого могут служить Т-хелперы или В-клетки. Неспецифические супрессоры секретируют фактор белковой природы, подавляющий иммунный ответ на любой неродственный антиген. Клетки - супрессоры могут подавлять как клеточный, так и гуморальный ответы. С активностью клеток-супрессоров связан феномен поддержания иммунологической толерантности. Иммунологическая толерантность подразумевает избирательное отсутствие ответа на специфический антиген и объясняет отсутствие иммуноактивности на собственные компоненты организма. Как показали исследования [ф. Бернет, 1964], потенциальные антигены, взаимодействуя с иммунологически незрелыми лимфоидными клетками в пре-натальный период, делают невозможным специфический иммунный ответ на них в будущем, когда иммунная система станет зрелой. Предполагается, что в пренатальном периоде происходит своеобразное "самоубийство" -- самоустранение аутореактивных Т-клеток. Это явление получило название клональной делеции. Индуцированная толерантность всегда оказывается временной, причем Т-клетки становятся толерантными гораздо легче, чем В-клетки, но последние без необходимой поддержки не в состоянии генерировать иммунный ответ. Различия в первичном и вторичном ответах характеризуют иммунологическую память. Как гуморальный, так и клеточный иммунный ответ имеют определенную динамику и при повторном попадании антигена развиваются значительно быстрее и имеют качественные особенности. В первичном иммунном ответе гуморального типа [синтез антител) выделяют несколько этапов. Первый этап — латентная фаза — длится до 4-х суток с момента внедрения антигена- В этот период происходит фагоцитоз антигена, его переработка и представление структурных компонентов Т- и В-лимфоцитам, кооперативные взаимодействия, антигенза-висимая дифференцировка Т-лимфоцитов. На этом этапе в сыворотке крови практически не обнаруживаются специфические антитела, так как В-лимфоциты еще не превратились в антителопродуцирующие клетки. Установлено [Архипов Г. С., Аткенов С. Б., 1990], что на этом этапе может обнаруживаться незначительное количество противосальмонел-лезных антител, однако их обнаружить удается только в иммунных комплексах (антитела определяются после добавления специальных веществ, способствующих распаду иммунных комплексов). Второй этап синтеза антител — это логарифмическое' удвоение их титра. На этом этапе образовавшиеся плазматические клетки осуществляют синтез специфических антител, причем их титр удваивается каждые 24 часа по мере включения клеток клона в иммунный ответ. В большинстве случаев на 10—14 сутки титр антител достигает максимума. Наступает третий этап — стабилизация синтеза антител. Этот период характеризуется динамическим равновесием между продукцией иммуноглобулинов и их элиминацией в виде иммунных комплексов (антиген — антитело). По мере элиминации антигена наступает четвертый этап — снижение титра антител, но не до нулевого уровня. Следует отметить, что в первичном иммунном ответе в основном синтезируются антитела, относящиеся к YgМ. Лишь в конце первичного иммунного ответа происходит переключение на синтез IgG. Важной особенностью первичного иммунного ответа является образование Т- и В-лимфоцитов памяти, которые могут сохраняться в организме от нескольких дней до десятилетий и обусловливать иммунологическую память. Иммунологическая память — это способность к ускоренному и более сильному иммунному ответу при повторном контакте иммунной системы с данным антигеном. При вторичном иммунном ответе латентный период и период логарифмического удвоения титра антител сокращается примерно вдвое. Причем в основном синтезируется IgG, максимальный уровень которого значительно превышает максимальный уровень антител при первичном иммунном ответе (см. рис. 4).
Дата добавления: 2014-12-12 | Просмотры: 1225 | Нарушение авторских прав |