|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
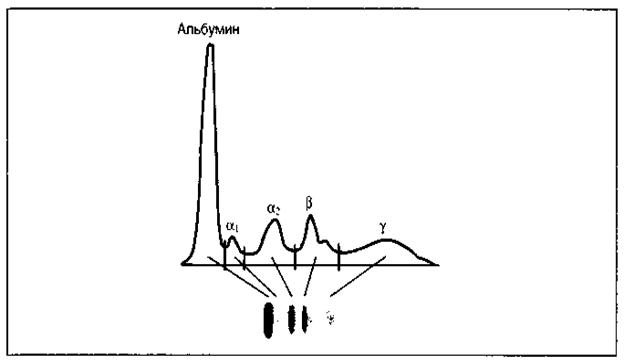
АНТИТЕЛАПри электрофорезе сыворотки крови белки разделяются на две фракции: альбумины и глобулины, в свою очередь последние - на альфа, бета и гамма фракции. Совокупность сывороточных белков, обладающих преимущественно гамма - электрофоретической подвижностью и проявляющих активность антител, называется иммуноглобулинами. Содержание глобулинов в сыворотке крови составляет в среднем 35-45 %, гамма-фракции – 12-18%. Антитела – это иммуноглобулины, способные специфически соединяться с антигеном. Кроме антител к иммуноглобулинам относят: иммуноглобулиновые рецепторы лимфоцитов, молекулы ГКГС 1 и 2 классов, адгезивные белки, а также белки, сходные с антителами по химической структуре и антигенной специфичности - миеломные белки, белки Бенс - Джонса и субъединицы Ig.
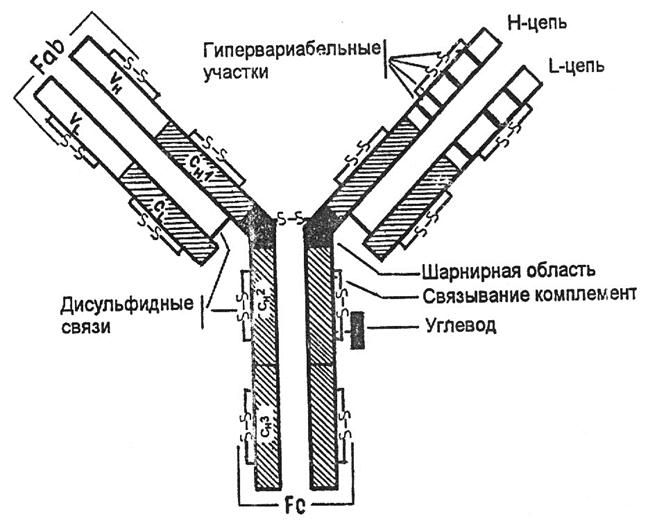
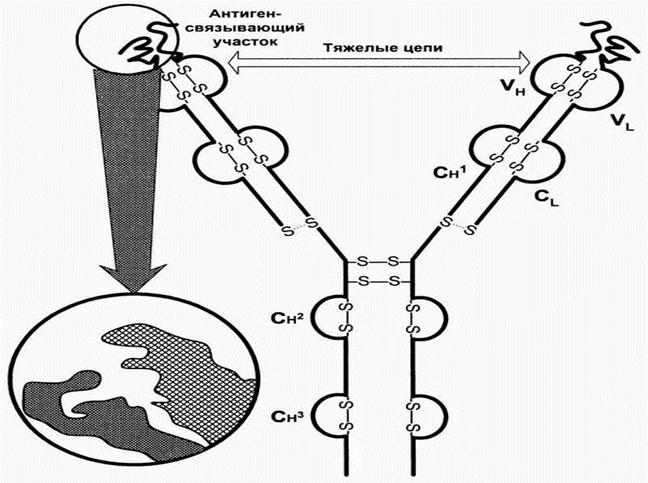
Рис. 8. Зональный электрофорез нормальной сыворотки. На электрофореграмме и денситограмме нормальной сыворотки видны пять основных полос, которые соответствуют альбумину, α1, α2, β- и γ – глобулинам Биологические функции антител - направлены на элиминацию чужеродного антигена из организма. Антитела: Ø распознают и связывают антиген; Ø представляют его мф и лф; Ø оказывают цитотоксическое действие в отношении чужеродных клеток Ø опсонирующее влияние; Ø активирует систему комплемента. Для понимания биологического действия антител необходимо различать следующие понятия: · специфичность антител - способность Ig реагировать только с оп-ределенными антигеном. · валентность - это количество антидетерминант (паратопов) в молекуле антитела; как правило они бивалентны, хотя существуют 5- и 10-валентные антитела. · аффинность - прочность связи между детерминантами антигена и антидерминантами антитела (эпитопа и паратопа). · авидность характеризует прочность связи антигена с антителом в реакции антиген-антитело (определяется аффинностью и валентностью антигена). Общий план строения иммуноглобулинов: На примере иммуноглобулина G можно видеть, что молекула Ig содержит 2 тяжелые и 2 легкие цепи, которые соединены дисульфидными связями. Каждая цепь содержит вариабельную и константную область, составляющие Fab (антигенсвязывающий фрагмент) и Fc - константный фрагмент. Гомологичные структурные участки легких и тяжелых цепей иммуноглобулинов, образуемые дисульфидными связями, называются доменами. Домены имеют одинаковые последовательности аминокислот. Каждый домен включает приблизительно 100-110 аминокислотных остатков. Различают домены константных участков: Сl, СН1, СН2, СН3. Сl, СН1 домены – обеспечивают нековалентное связывание легких и тяжелых цепей и аллоантигенные различия антител. СН2 – место присоединения углеводов и связывания комплемента. СН3 – участок взаимодействует с Fc –рецептором на поверхности клеток, принимающих участие в иммунных реакциях. При взаимодействии вариабельных Vl и Vh -доменов формируется антигенсвязывающий участок ат (активный центр). Изменения последовательности аминокислотных остатков этих доменов от белка к белку определяют меняющуюся специфичность антител. Между СН1 и СН2 доменами находится шарнирная область, обеспечивающая подвижность Fab-фрагмента. Рис. 9. Строение иммуноглобулина G
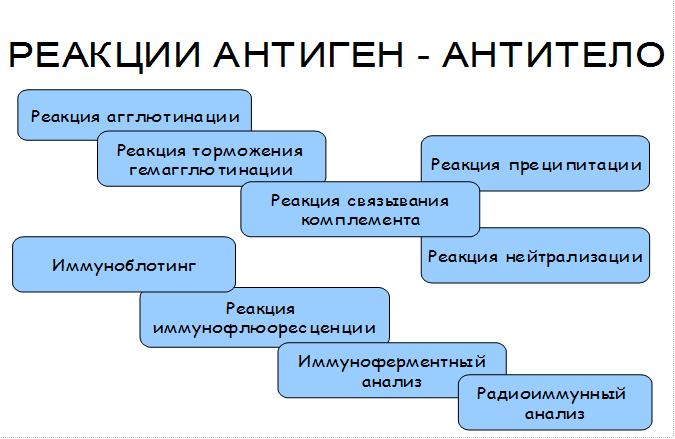
В основе реакции антиген – антитело лежит взаимодействие между эпитопами антигена и паратопами антитела, основанное на их пространственном соответствии (комплементарности). Эти связи обусловлены следующими типами межмолекулярных сил: · Электростатическими (ионными, полярными) · Водородными · Гидрофобными · Силами Ван – дер – Вальса
Рис. 10. Гетерогенность иммуноглобулинов. Принадлежность иммуноглобулина к тому или иному классу или подклассу зависит от характерных особенностей строения тяжелых цепей (количества и последовательности аминокислотных остатков, молекулярной массы, количества доменов и др.). Тяжелые цепи бывают 5 типов (α, γ, δ, ε, µ). Легкие – только двух разновидностей – каппа и лямбда. Тяжелые цепи независимо от принадлежности к тому или иному классу или подклассу образуют комплекс либо с каппа, либо с лямбда типом. В зависимости от строения константных областей тяжелых цепей (Fc) иммуноглобулины разделены на 5 классов (IgA, IgM, IgG, IgD, IgE). Дата добавления: 2014-12-12 | Просмотры: 1891 | Нарушение авторских прав |