|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ФВ: капс. 100, 300 и 400 мгБензодиазепины. Клоназепам (Clonazepam, Antelepsin). Диазепам (Diazepam, Relanium, Seduxen, Valium). Бензодиазепины – достаточно большая и интенсивно развивающаяся группа лекарственных средств. В терапии эпилепсии определенную роль играют только 6 представителей этой группы – диазепам, клоназепам, лоразепам, нитразепам, клоразепат и клобазам. Ниже мы рассмотрим только диазепам и клоназепам, которые применяются как противосудорожные средства в отечественной медицине. МД: Бензодиазепины обладают двойным механизмом противосудорожного действия: · Бензодиазепины связываются с бензодиазепиновыми участками аллостерического центра ГАМКА-рецептор хлоридного ионофорного комплекса и увеличивают сродство ГАМКА рецептора к эндогенному медиатору ГАМК. В итоге, даже ничтожно малые количества ГАМК способны активировать ГАМКА-рецептор и вызвать открытие хлоридного канала. При этом в отличие от барбитуратов, бензодиазепины увеличивают частоту открытия канала на ГАМК, а не его длительность. Ток ионов хлора через каналы внутрь нейронов коры головного мозга приводит к гиперполяризации мембраны и угнетению активности эпилептогенного очага. Ток ионов хлора через каналы внутрь интернейронов спинного мозга приводит к гиперполяризации их мембраны и угнетению полисинаптических мышечных рефлексов, что вызывает дополнительную миорелаксацию. · В больших дозах бензодиазепины способны пролонгировать инактивированное состояние натриевых каналов. ФК: И диазепам, и клоназепам достаточно хорошо и полно абсорбируются из ЖКТ. При лечении эпилепсии используют пероральное применение клоназепама (т.к. он обладает длительным действием) и внутривенное введение диазепама (т.к. он обладает непродолжительным действием). Внутримышечное введение бензодиазепинов применять не рекомендуется, т.к. в мышечной ткани они образуют плохорастворимое депо, из которого всасываются плохо и с непостоянной скоростью. Метаболизм диазепама и клоназепама происходит в печени, при этом происходит восстановление нитрогруппы до аминогруппы с потерей фармакологической активности этих средств. ФЭ: 1. Противоэпилептический эффект. Каждый из бензодиазепинов имеет свой профиль противосудорожной активности. Диазепам эффективен при лечении grand mal и купировании эпилептического статуса, тогда как клоназепам наиболее эффективен при абсансах и миоклонус эпилепсии. 2. Седативный (успокаивающий) эффект – проявляется подавлением реакции на постоянные раздражители, снижением уровня спонтанной активности и мышления. 3. Транквилизирующий эффект (атарактический эффект) – устранение чувства тревоги, страха, беспокойства. 4. Снотворный эффект – в отличие от фенобарбитала бензодиазепины минимально изменяют структуру сна, они облегчают засыпание и удлиняют время сна. 5. Миорелаксирующий эффект – бенхзодиазепины снижают мышечный тонус за счет подавления полисинаптических рефлексов спинного мозга. РД: Прием клоназепама начинают с минимальных доз (ввиду сильного седативного эффекта), постепенно повышая их до 0,1-0,2 мг/кг/сут в 1-2 приема. Диазепам назначают по 0,2-0,5 мг/кг внутривенно для купирования эпилептического статуса, инъекции повторяют по мере необходимости (максимально допустимая доза 100 мг/сут). У детей иногда применяют ректальное введение диазепама. НЭ: 1. Сонливость, летаргия, антероградная амнезия (нарушения памяти на текущие события), головокружение. Эти симптомы особенно выражены вначале терапии бензодиазепинами. 2. Мышечная слабость, атаксия (нарушение походки и поддержания положения тела). Данные эффекты чаще возникают у пожилых лиц. 3. К противосудорожному эффекту бензодиазепинов с течением времени развивается толерантность. 4. Развитие лекарственной зависимости по бензодиазепиновому типу, с абстинентным синдромом при прекращении приема (нарушения поведения, немотивированная агрессивность, неспособность к концентрации внимания, необъяснимый страх, тревога, анорексия или повышения аппетита, повышение тонуса мышц, бессонница). 5. У пожилых лиц и подлных пациентов возможно возникновение синдрома «ночных апноэ» (остановок дыхания на 20-30 сек с всхрапыванием). ФВ: Клоназепам табл. 0,25 и 1 мг. Диазепам ампулы 0,5% раствора по 2 мл, табл. по 2, 5, 10 мг, капс. по 15 мг
МД: Показано, что ламотриджин тормозит выделение из пресинаптических окончаний возбуждающих аминокислот – аспарагиновой и глютаминовой. В итоге, не активируются NMDA и AMPA рецепторы постсинаптической мембраны, сопряженные с Ca2+ и Na+-каналами соответственно. Нарушение тока ионов натрия и кальция в клетку приводит к нарушению генерации кратковременных и длительных возбуждающих потенциалов действия, снижению активности нейрона. Недавно было показано, что подобно фенитоину ламотриджин способен пролонгировать инактивированное состояние натриевых каналов. ФК: Ламотриджин хорошо всасывается после перорального введения, период его полуэлиминации около 24 часов, что позволяет применять средство 1 раз в день. ФЭ: Ламотриджин оказывает противосудорожное действие при парциальных припадках, а также абсансах и миоклонус эпилепсии. РД: Применяют внутрь по 100-300 мг/сут максимально до 700 мг/сут. НЭ: головокружение, головная боль, диплопия, тошнота, сыпь. ФЭ: табл. по 25, 50 и 100 мг, табл. жевательные по 5, 25 и 100 мг Таблица 3. Выбор средств для лечения основных форм эпилепсии.
По Л.Р. Зенкову, 2000
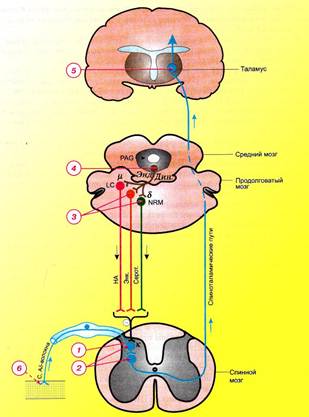
ОПИОИДНЫЕ (НАРКОТИЧЕСКИЕ) АНАЛЬГЕТИКИ Не «тоскливое состояние», а смерть медленная овладевает морфинистом, лишь только вы на час или два лишите его морфия. Воздух не сытный, его глотать нельзя… в теле нет клеточки, которая бы не жаждала… Чего? Этого нельзя ни определить, ни объяснить. Словом человека нет. Он выключен. Движется, тоскует, страдает труп. Он ничего не хочет, ни о чем не мыслит, кроме морфия. Морфия! Смерть от жажды – райская, блаженная смерть по сравнению с жаждой морфия. Так заживо погребенный, вероятно, ловит последние ничтожные пузырьки воздуха в гробу и раздирает кожу на груди ногтями. Так еретик на костре стонет и шевилится, когда первые языки пламени лижут его ноги… М.А. Булгаков. «Записки молодого врача. Морфий» Боль – неприятное сенсорное и эмоциональное состояние, обусловленное действительным или возможным повреждающим воздействием на ткани. Боль включает в себя целый комплекс ощущений от простого дискомфорта до страдания, беспокойства, депрессии и отчаяния с мучительным желанием наступления облегчения или смерти. Анальгезия (греч. an – отрицание, algos - боль) – состояние организма, сопровождающееся утратой болевой при сохранении остальных видов чувствительности. Анальгетиками называют лекарственные средства, которые избирательно ослабляют болевую чувствительность. Опиоидными анальгетиками называют лекарственные средства, которые оказывают центральное, дозозависимое, обратимое анальгетическое действие без выключения сознания. Они избирательно подавляют боль, повышают ее переносимость, уменьшают эмоциональную окраску и вегетативное сопровождение боли. К опиоидным анальгетикам относят опиаты и собственно опиоиды. Опиатами – называют анальгетики на основе природных алкалоидов мака снотворного и их полусинтетические производные. Опиоидами – называют синтетические соединения, имитирующие действие морфина. Пути проведения боли, антиноцицептивная система. Ноцицептивная система – сосвокупность нейронов ЦНС, которая служит для восприятия, проведения и оценки боли. Восприятие болевых ощущений проводят особые нервные окончания – ноцицепторы. Эти рецепторы воспринимают действие т.н. алгогенных веществ – ацетилхолина, простагландина Е, лейкотриенов, брадикинина, гистамина, ионов калия и водорода, которые образуются при повреждении ткани или выделяются из нее при действии чрезмерных раздражителей. Проведение болевых ощущений происходит по 2 путям: · Неоспиноталамический путь – представлен нейронами задних рогов спинного мозга и вентробазальных ядер таламуса, которые передают импульс в постцентральную извилину коры головного мозга. Этот путь воспринимает эпикритическую боль («светлая», эмоционально неокрашенная боль, имеет четкую локализацию и отвечает на вопрос «где болит»?); · Палеоспиноталамический путь – многонейронный путь, представлен нейронами задних рогов спинного мозга, ядрами ретикулярной фармации продолговатого и среднего мозга, гипоталамуса, неспецифическими ядрами таламуса, лимбической системы, которые передают импульсы в кору лобной и теменной извилин. Этот путь воспринимает пропатическую боль («темную», эмоционально окрашенную, плохо локализованную боль, отвечает на вопрос «как болит»?) В качестве медиаторов в синапсах этой системы выступают пептиды – субстанция Р, нейрокинин А, холецистокинин, соматостатин, нейротензин и глутаминовая кислота. Антиноцицептивная система – совокупность нейронов ЦНС, которая нарушает восприятие боли, проведение болевых импульсов и формирование ответной реакции на боль. Основные нейроны этой системы лежат в околоводопроводном сером веществе среднего мозга, они передают тормозящие импульсы в лимбическую системы (устраняют эмоциональный компонент боли) и на ядра ретикулярной фармации продолговатого мозга (большое ядро шва, голубое пятно), где лежат адренергические, серотонинергические и энкефалинергические нейроны. Эти нейроны нарушают передачу импульсов в нейронах ноцицептивной системы. Основными медиаторами в нейронах антиноцицептивной системы являются опиоидные пептиды.
Схема 1. Ноцицептивная и антиноцицептивная система. Нейроны неоспиноталамического пути ноцицептивной системы показаны синим цветом. PAG – околоводопроводное серое вещество; NRM – большое ядро шва; LC – синее пятно. НА – норадреналин, Серот. - серотонин, Энк. – энкефалины, Энд. – эндорфины, Дин – динорфины. Цифрами на схеме показаны участки приложения действия опиоидных анальгетиков на соответствующие рецепторы: 1, 2 – угнетение нейронов задних рогов спинного мозга, 3, 4 – стимуляция антиноцицептивных нейронов ретикулярной фармации ствола мозга, 5 – торможение нейронов таламических ядер, 6 – снижение чувствительности ноцицепторов. Опиоидные пептиды и их рецепторы. Медиаторами антиноцицептивной системы являются 3 семейства пептидов: · Эндорфины - b-эндорфин; · Энкефалины – лей- и мет-энкефалин; · Динорфины – динорфин А и В.
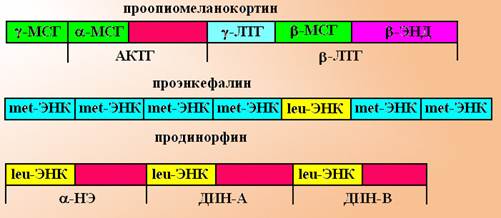
Схема 2. Молекулы-предшественницы опиоидных пептидов. МСГ – меланоцитстимулирующий гормон, ЛТГ – липотропный гормон, ЭНД – эндорфин, ЭНК-энкефалин, НЭ - неоэндорфин, ДИН – динорфин. Опиоидные пептиды образуются из 3 молекул предшественниц: 1) проопиомеланокортина – дает начало g-меланоцитстимулирующему гормону, АКТГ и b-липотропному гормону, который в последующем расщепляется до b-эндорфина; 2) проэнкефалину – распадается на несколько копий мет-энкефалина и 1 копию лей-энкефалина; 3) продинорфин – распадается на 3 молекулы - a-неоэндорфин, динорфин А и В, каждая из которых содержит по одной копии лей-энкефалина. Опиоидные пептиды взаимодействуют с особыми опиоидными рецепторами и активируют их. Различают следующие типы опиоидных рецепторов (таблица 1.): Таблица 1. Характеристика опиоидных рецепторов. Дата добавления: 2015-01-12 | Просмотры: 1013 | Нарушение авторских прав |
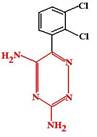 Ламотриджин (Lamotrigine, Lamictal). Производное фенилтриазина. Был создан случайно, на основе ложного представления о том, что противосудорожная активность фенитоина обусловлена его антагонизмом к фолиевой кислоте.
Ламотриджин (Lamotrigine, Lamictal). Производное фенилтриазина. Был создан случайно, на основе ложного представления о том, что противосудорожная активность фенитоина обусловлена его антагонизмом к фолиевой кислоте.