 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Классификация опиоидных анальгетиков
Морфина гидрохлорид (Morphini hydrochloridum, MST continus). Хлористоводородная соль природного алкалоида, содержащегося в опии (до 10%), которая представляет собой застывший на воздухе млечный сок, вытекающий из надрезов головок сонного мака (Papaver somniferum).
Активация опиоидных рецепторов на мембране нейронов ноцицептивной системы приводит к повышению активности аденилатциклазы и образованию в клетке цАМФ. Под действием цАМФ-зависимых протеинкиназ происходит инактивация кальциевых каналов и открытие калиевых каналов. Нарушение поступления ионов кальция через пресинаптическую мембрану снижает выделение медиаторов и затрудняет передачу импульсов в синапсах ноцицептивной системы. Нарушение поступления ионов кальция через постсинаптическую мембрану, в сочетании с выходом ионов калия приводит к гиперполяризации мембраны и снижению возбудимости нейронов (затруднению восприятия импульсов). ФЭ: Различают центральные и периферические эффекты морфина. Центральные эффекты: 1. Анальгетический эффект. Морфин значительно ослабляет чувство боли (и даже может устранить ее совсем), изменяет субъективную оценку (восприятие) боли. В итоге, человек лучше переносит боль, они становится менее дискомфортной для него. Анальгетический эффект морфина связывают с его влиянием на процесс передачи импульсов на спинальном (задние рога спинного мозга) и супраспинальном уровнях (торможение ядер таламуса и активация антиноцицептивных ядер ретикулярной фармации ствола мозга), а также со снижением активности периферических ноцицепторов. Анальгетический эффект морфина сохраняется 4-5 часов. 2. Седативный эффект. Морфин оказывает общеуспокаивающее действие, снижает активность психических процессов, двигательную активность. Седативный эффект морфина постепенно переходит в чуткий, поверхностный, богатый яркими приятными сновидениями сон. 3. Эйфория. Данный эффект возникает только в том случае, если морфин поступает в организм с высокой скоростью (например, вводится внутривенно) и исходное состояние человека близко к комфортному (т.к. у пациентов с сильным болевым синдромом реализуется главным образом анальгетический эффект, без выраженной эйфории). Эйфория характеризуется иллюзорным восприятием окружающей действительности – звуки, образы, цвета становятся яркими, подвижными, усталость, грусть, тоска, печаль, скорбь и страх исчезают, сменяясь безоблачным настроением, чувством уверенности в своих силах. Возникает койнестопатия (исчезновение ощущения своего тела, «невесомость»), мория (патологически повышенное настроение со склонностью к дурашливости, неуместным шуткам). Внизу живота, в области промежности и половых органов возникают ощущения близкие к оргазму. 4. Противокашлевой эффект – связан с угнетением кашлевого центра под влиянием морфина. 5. Миоз (сужение зрачка). Возникает за счет стимуляции ядра глазодвигательного нерва и увеличения тем самым парасимпатических влияний на глаз. Зрачок под влиянием морфина может достигать размера булавочной головки. 6. Эндокринологические эффекты. Морфин усиливает секрецию пролактина, СТГ и АДГ, понижает выделение кортико- и гонадолиберинов (что вызывает снижение содержания в крови уровней АКТГ, ФСГ, ЛГ, кортизола, эстрогенов и прогестерона, тестостерона). 7. В высоких дозах морфин тормозит термоустановочный центр гипоталамуса и несколько снижает температуру тела. 8. Влияние на рвотный центр. Морфин, связываясь с опиоидными рецепторами рвотного центра вызывает его торможение, но в то же время, морфин способен активировать дофаминовые D2-рецепторы триггерной зоны рвотного центра, которые оказывают на него стимулирующее действие. Поскольку триггерная зона лежит кнаружи от ГЭБ, то она активируется раньше, чем начнется торможение рвотного центра, поэтому при первом введении морфина (у 20-40% пациентов) может возникать тошнота и рвота, которая сменяется быстрым угнетением рвотного рефлекса. 9. Морфин повышает тонус мышц и усиливает рефлексы, которые замыкаются на уровне спинного мозга. Это связано с выключением тормозящих влияний на спинной мозг ретикулярной фармации головного мозга. Периферические эффекты морфина: 1. Влияние на сердечно-сосудистую систему. Морфин стимулирует ядра блуждающего нерва (ПСНС), что приводит к возникновению брадикардии. Морфин вызывает расширение сосудов малого круга кровообращения, поэтому при его применении снижается преднагрузка на миокард и давление в сосудах легких. Морфин вызывает дилятацию внутричерепных сосудов и приводит к некоторому повышению внутричерепного давления, поэтому его не рекомендуется применять для обезболивания у лиц с ЧМТ. 2. Влияние на дыхательную систему. Морфин вызывает выброс гистамина из тучных клеток, что совместно с повышением тонуса блуждающего нерва может спровоцировать развитие бронхоспазма. 3. Влияние на ЖКТ. Применение морфина вызывает обстипационный эффект (запор). Этот эффект морфина связывают с несколькими механизмами. Стимуляция морфином m-рецепторов кишечника и желудка приводит к угнетению выделения ацетилхолина, PgE2 и нейропептида Y в сплетениях метасимпатической нервной системы кишечника. Эти медиаторы необходимы для обеспечения моторики, их недостаток приводит к повышению тонуса гладких мышц и сфинктеров ЖКТ и сегментации кишечника с исчезновением пропульсивных движений. Кроме того, морфин приводит к снижению секреции кишечного сока и увеличению абсорбции воды из каловых масс. 4. За счет стимуляции ядер блуждающего нерва и прямого действия на гладкие мышцы, морфин повышает тонус моче- и желчевыводящих путей, что может спровоцировать колику у чувствительных лиц. ФК: Морфин достаточно хорошо всасывается при пероральном введении. Однако, его биодоступность при данном способе введения составляет всего 25%, т.к. подавляющая часть морфина разрушается при первом прохождении через печень до морфин-3-глюкуронида, поэтому в медицинской практике чаще используют парентеральное введение морфина. После введения морфин быстро распределяется в органы и ткани, хорошо проникает через ГЭБ. Основной метаболизм морфина протекает в печени, при этом часть морфина метаболизируется до морфин-6-глукуронида, который является фармакологически активным и по анальгетической активности несколько превосходит морфин. Основной путь элиминации морфина – выделение с желчью. Морфин подвергается энтеро-гепатической циркуляции: после поступления с током крови в печень, часть морфина выделяется с желчью в 12-перстную кишку, где она вновь всасывается и с током крови вновь поступает в печень, после чего процесс повторяется. Показания к применению. · Острые боли при травмах, ожогах и в послеоперационном периоде – в виде непродолжительного курса, чаще применяют подкожное введение 1% раствора по 0,5-1 мл каждые 6 часов. · Боль при неопластических процессах – длительные курсы, вначале рекомендуют пероральный или сублингвальный прием морфина с последующим переходом на парентеральное введение. · Купирование боли при инфаркте миокарда. · Лечение кардиального отека легких. Морфин позволяет успокоить пациента, а также понизить давление в сосудах малого круга и разгрузить левые отделы сердца. Категорически противопоказано применение морфина в следующих ситуациях: · Обезболивание у лиц с ЧМТ. Морфин повышает внутричерепное давление, кроме того, он оказывает седативное действие и вызывает миоз, не позволяя оценить реакцию зрачка на свет. Уровень сознания и реакция зрачка на свет – основные показатели для оценки тяжести состояния пациента с ЧМТ. На фоне применения морфина их адекватная оценка невозможна. · Обезболивание у пациентов с почечной и печеночной (желчной) коликой. Морфин повышает тонус желче- и мочевыводящих путей, что может парадоксально усилить колику. Кроме того, заброс желчи при закрытом сфинктере Одди в протоки поджелудочной железы приводит к активации панкреатических ферментов в ткани железы и развитию панкреонекроза. Нецелесообразно назначать морфин для обезболивания родов, т.к. он вызывает снижение тонуса матки и способствует тем самым удлинению родов. Кроме того, проникая через плаценту морфин приводит к угнетению дыхания у новорожденного ребенка. НЭ: 1. Угнетение дыхательного центра. Морфин снижает чувствительность дыхательного центра к изменению уровня СО2 и рН крови (основным стимуляторам дыхания в норме) и поддержание дыхания происходит за счет работы периферических рецепторов каротидных клубочков, возникает дыхание Чейна-Стокса. Вначале дыхание становится редким и глубоким, по мере выведения СО2 дыхание еще более урежается и становится поверхностным, а затем прекращается совсем. Во время паузы происходит накопление СО2 и развитие ацидоза, которые активируют рецепторы каротидных клубочков и дыхание возобновляется постепенно нарастая по глубине. Затем процесс повторяется. При увеличении дозы морфина возможен полный паралич дыхательного центра. 2. При длительном применении морфина возникает толерантность и лекарственная зависимость к морфину. · Толерантность – постепенное ослабление фармакологических эффектов морфина при повторном введении в одной и той же дозе. Для получения прежнего эффекта требуется вводить все большие и большие дозы морфина. Толерантность носит перекрестный характер, т.е. при использовании одного опиоидного анальгетика она развивается ко всем средствам из этой группы. Толерантность никогда не развивается к миотическому, обстипационному эффектам и способности морфина повышать тонус скелетных мышщ. · Лекарственная зависимость. Морфин вызывает быстрое формирование психической и физической зависимости. Психическая зависимость – непреодолимое, неконтролируемое (компульсивное) стремление к повторным введениям морфина связано с его способностью вызывать эйфорию. При длительном применении морфин вызывает глубокую перестройку нейроэндокринных функций и по механизму отрицательной связи тормозит синтез собственных эндогенных опиопептидов. Это приводит к формированию физической зависимости, при которой прекращение регулярного введения в организм морфина вызывает болезненное состояние – синдром лишения или абстинентный синдром. Абстинентный синдром проявляется развитием эффектов обратных тем, которые наблюдаются при введении морфина. У человека возникают тревога, бессонница, сильные мышечные и суставные боли, ринорея, лакримация (слезотечение), мидриаз, тошнота и рвота, резкие колебания АД, гипертермия с ознобом, дыхание становится учащенным и неритмичным. Для ликвидации этого состояния человек готов пойти на любое преступление, чтобы достать опиоидный анальгетик. Абстинентный синдром возникает через 6-10 часов после выполнения последней инъекции и достигает максимума ко 2 суткам, после чего ослабевает к 5-7 дню. Несмотря на кажущуюся тяжесть абстинентного синдрома он редко заканчивается летальным исходом (в отличие от барбитурового абстинентного синдрома). Острое отравление морфином. Возникает при введении в вену свыше 30 мг морфина (лица с наркотической зависимостью могут переносить инъекции 200-500 мг морфина без каких-либо последствий). Возникает эйфория переходящая в ступор и кому, полная анальгезия, гипотермия, гипотензия. Зрачки резко сужены, наблюдается задержка мочи и запор, дыхание по типу Чейна-Стокса. Смерть наступает от паралича дыхательного центра и острой дыхательной недостаточности. Патогномоничными симптомами морфиновой комы является сочетание миоза, дыхания Чейна-Стокса при сохраненных и даже усиленных сухожильных рефлексах. Меры помощи при остром отравлении морфином: · ИВЛ с положительным давлением на вдохе. Наиболее критическими являются первые 10-12 часов в течение которых необходимо обеспечить непрерывную ИВЛ. · Повторные промывания желудка через зонд взвесью активированного угля и 0,05% раствором KMnO4. Данное мероприятие следует проводить даже в случае парентерального введения морфина, поскольку морфин подвергаясь энтерогепатической циркуляции выделяется через слизистую оболочку ЖКТ, где он может быть окислен перманганатом или связан активированным углем. · Ведение антидотов – антагонистов опиоидных рецепторов (налоксона). ФВ: раствор 1% амп. 1 мл; таблетки (МСТ континус) продленного действия по 10, 30, 100 и 200 мг; саше с гранулами по 10, 30, 100 и 200 мг; суппозитории ректальные по 10, 30, 100 и 200 мг. Тримепиридин (Trimeperidini, Promedolum). По активности уступает морфину. Является агонистом m- и в меньшей степени k- и d-рецепторов.
ФЭ: Анальгетический эффект тримепиридина продолжается 2-3 часа. В отличие от морфина тримепиридин обладает слабым спазмолитическим действием, поэтому он либо не изменяет тонус гладких мышц (ЖКТ, желчевыводящие пути), либо его понижает (мочевыводящие пути). Данный эффект позволяет использовать трмепиридин при желчной и почечной колике. Тримепиридин повышает тонус матки и способствует раскрытию ее шейки, поэтому он не препятствует нормальной родовой деятельности и может быть использован для обезболивания родов. Тримепиридин практически не изменяет диаметр зрачков, не вызывает выделения гистамина из тучных клеток. Применение: используется в основном по тем же показаниям, что и морфин. Может применяться для купирования боли при почечной и желчной колике, для обезболивания родов. ФВ: таблетки по 0,025; раствор 1 и 2% амп. по 1 мл. Фентанил (Phentanyl citrate, Sentonyl). По механизму действия аналогичен морфину, но по анальгетической активности превосходит его в 80-100 раз.
ФЭ: Анальгетический эффект фентанила наступает буквально «на конце иглы» (в первую минуту), но является непродолжительным и заканчивается через 30-40 мин. Полагают, что такое непродолжительное действие фентанила обусловлено не процессами его метаболизма, а перераспределением из ЦНС в жировые депо внутренних органов и подкожную клетчатку. В отличие от морфина фентанил значительно усиливает спинальные рефлексы и тонус мышц. В высоких дозах он может вызвать ригидность дыхательных мышц, что на фоне угнетения дыхательного центра приводит к развитию острой дыхательной недостаточности. В связи с таким действием фентанил не рекомендуют применять при кардиальном отеке легких и у пациентов с бронхиальной астмой, поскольку у них такое нарушение дыхания может оказаться критическим. Фентанил применяют в медицинской практике по следующим показаниям: · Для проведения нейролептанальгезии – вида общего обезболивания. При котором у пациента создают анальгезию, антероградную амнезию при сохраненном сознании. Для выполнения нейролептанальгезии фентанил вводят совместно с нейролептиком ультракороткого действия – дроперидолом в соотношении 1:50 (0,05 мг фентанила совместно с 2,5 мг дроперидола). · Для проведения атаранальгезии – вид общего обезболивания при котором добиваются создания анальгезии, миорелаксации при сохранении сознания. Для ее создания фентанил вводят совместно с транквилизаторами бензодиазепинового ряда – диазепамом или флунитразепамом. · Для обезболивания у пациентов с неопластическими процессами. Чаще всего применяют в виде трансдермальной системы, которую наклеивают на область позвоночника. ФВ: раствор 0,005% амп по 2 и 5 мл; трансдермальная система Дюрогезик 25; 50; 75 и 100 мкг/час. Пиритрамид (Piritramide, Dipidolor). Превосходи морфин по анальгетической активности в 2 раза. Является чистым агонистом m-рецепторов.
Пиритрамид не вызывает никаких изменений системной гемодинамики как в большом, так и в малом кругу кровообращения, поэтому его используют при выполнении оперативных вмешательств у пациентов с пороками или другой патологией сердца. ФВ: раствор 7,5% амп. по 2 мл. Метадон (Metadone, Dolofine). Применяется с 1946 г. Впервые был синтезирован немецкими фармацевтами во время второй мировой войны. По активности и действию на опиодиные рецепторы практически идентичен морфину. Существует в форме 2 изомеров, при этом левовращающий изомер в 50 раз активнее правовращающего.
ФЭ: Поскольку период полуэлиминации метадона достаточно продолжителен, толерантность и физическая зависимость к нему формируются достаточно медленно, абстинентный синдром менее интенсивный, но более продолжительный, чем при приеме морфина или героина. Это свойство метадона лежит в основе его применения при лечении героиновой наркотической зависимости. Первоначально пациента переводят на прием метадона в дозе 50-100 мг/сут до выработки толерантности (при этом возникает перекрестная толерантность к героину, которая не позволяет развиваться эйфории при его введении и мотивация к повторным инъекциям героина исчезает). В последующем дозу метадона постепенно снижают, при этом пациент испытывает продолжительный, но мягкий абстинентный синдром. Иногда метадон применяют для лечения хронического болевого синдрома у лиц с неопластическими процессами. ФВ: таблетки по 5 и 10 мг; таблетки растворимые по 40 мг; 1, 2 и 10% раствор во флак. по 60 мл для приема внутрь.
ФК: Пентазоцин хорошо всасывается после приема внутрь, но вследствие пресистемной элиминации его биодоступность не превышает 20%, поэтому предпочитают его парентеральное введение. Следует помнить, что при длительном подкожном или внутримышечном введении, вследствие раздражающего действия пентазоцина на ткани, может развиться их фиброз. ФЭ: 1. Анальгетический эффект. Анальгезия, вызванная пентазоцином реализуется преимущественно на спинальном уровне (где локализуются k-рецепторы) – он нарушает проведение болевых импульсов в задних рогах спинного мозга. В связи с отсутствием супраспинального компонента анальгезии пентазоцин не изменяет эмоциональное восприятие боли, а только уменьшает ее и повышает переносимость болевых ощущений. По силе анальгетического действия пентазоцин на 70-80% уступает морфину. Длительность пентазоциновой анальгезии составляет 2-3 часа. 2. Влияние на психику. Пентазоцин вызывает дисфорическое состояние, которое характеризуется беспокойством, депрессией, неприятными страшными мыслями, дезориентацией, ночными кошмарами и галлюцинациями. Несмотря на такое, в целом негативное, влияние на психику, пентазоцин способен вызвать пристрастие и лекарственную зависимость, хотя его наркогенный потенциал значительно ниже, чем у полных агонистов. Пентазоциновая зависимость характеризуется преобладанием психологического компонента над физическим и имеет черты как морфиновой, так и налорфиновой наркотической зависимости. 3. Пентазоцин способен стимулировать a- и b-адренорецепторы миокарда и сосудов, что приводит к развитию тахикардии, повышению АД, увеличению давления в полостях сердца и сосудах малого круга кровообращения, увеличивает работу сердца и его потребность в кислороде. В связи с вышесказанным, применять пентазоцин при обезболивании у лиц с инфарктом миокарда или клапанными пороками сердца нерационально, но он с успехом может применяться при анальгезии у лиц с кровопотерей или гиповолемией. 4. При введении пентазоцина пациенту, который принимает полные агонисты m-рецепторов возникает ослабление анальгетического и других эффектов полных агонистов (за исключением угнетения дыхания), а у пациентов с наркотической зависимостью вытеснение агониста из связи с m-рецепторами может вызывать абстинентный синдром. Это связано с тем, что, вытеснив полный агонист из рецептора, пентазоцин не способен активировать этот рецептор в полную силу. 5. По сравнению с морфином пентазоцин в меньшей степени угнетает дыхательный центр и оказывает меньшее стимулирующее влияние на мышцы ЖКТ, желче- и мочевыводящих путей, поэтому он может применяться для купирования почечной и желчной колик. ФВ: таблетки по 50 мг; 3% раствор в амп. по 1 мл. Буторфанол (Butorphanol, Moradol). МД: является сильным агонистом k- и s-рецепторов, слабым агонистом d-рецепторов и парциальным агонистом m-рецепторов. По активности в 5 раз превосходит морфин.
В отличие от пентазоцина и других опиоидных анальгетиков препарат абсолютно не влияют на тонус гладких мышц внутренних органов и может быть использован при лечении почечной и желчной колик. Буторфанол подобно тримепиридину повышает тонус матки, оказывает умеренно выраженное угнетающее действие на дыхательный центр плода, поэтому может быть использован для обезболивания родов. Особенностью буторфанола является седативное действие разной степени выраженности, которое проявляется примерно у 40% пациентов. При этом глубина седативного эффекта не зависит от дозы, а обусловлена индивидуальной реакцией на препарат. ФВ: 0,2% раствор в амп. по 1 мл; 1% назальный спрей флак. по 5 и 10 мл.
ФЭ: Анальгетический эффект бупренорфина сохраняется 6-8 часов. Лекарство в меньшей степени, чем морфин влияет на ЖКТ, не вызывает спазма желчевыводящих путей и может быть использован для устранения боли при желчной колике. Бупренорфин слабее влияет на продвижение химуса по кишечнику и реже вызывает запор. Наркогенный потенциал бупренорфина низкий, абстиненция протекает менее тягостно, чем при морфиновой зависимости. ФВ: таблетки сублингвальные 0,0002; 0,03% раствор в амп. по 1 и 2 мл. Налорфин (Nalorphine hydrochloride, Anarcon, Norfin). Явился прообразом средств из группы полных антагонистов, т.к. его антагонистический эффект преобладает над агонистическим. МД: Налорфин является крайне слабым агонистом s- и k-рецепторов и антагонистом m-рецепторов. ФК: Налорфин практически полностью метаболизируется при первом прохождении через печень, поэтому применяется исключительно парэнтерально.
В отличие от морфина, налорфин вызывает не эйфорию, а дисфорическое состояние, которое сопровождается нервозностью, упадком сил, сноподобными фантастическими иллюзиями и галлюцинациями. При регулярном применении налорфина возможно развитие толерантности и лекарственной зависимости (преимущественно физического типа). Налорфин практически не вызывает психологической зависимости, поэтому у лиц, страдающих наркотической зависимостью налорфинового типа нет компульсивного (непреодолимого) стремления к повторным введениям этого лекарства с целью воссоздания особого состояния психики (как это бывает у лиц с морфиновой зависимостью). При возникновении физической зависимости к налорфину, прекращение его введения вызывает весьма своеобразный синдром отмены, который характеризуется ощущениями напоминающими действие электрошока, обморочными состояниями, при этом у пациента нет страстного желания повторно ввести себе налорфин, а его поведение не направлено на поиск дозы налорфина любой ценой. Антагонистический эффект налорфина проявляется только в том случае, если опиодиные рецепторы предварительно связаны полным агонистом (например, морфином). В данной ситуации налорфин устраняет угнетение дыхания, анальгезию и некоторые другие эффекты морфина, но практически не влияет на его седативное действие. Чем более выражено угнетение дыхания под влиянием полного агониста, тем более ярким является антагонистическое действие налорфина. У лиц с наркотической зависимостью опиоидного типа введение налорфина приводит к вытеснению агониста из связи с рецепторами и развитию абстинентного синдрома. Показания к применению и режимы дозирования. До введения в медицинскую практику полных антагонистов налорфин применяли с целью оказания неотложной помощи при острой передозировке опиоидных анальгетиков (для устранения угнетения дыхания). Налорфин вводили внутривенно или внутримышечно по 3-5 мг в виде повторных инъекций до восстановления нормального характера дыхания. Максимальная доза не должна была превышать 12-20 мг (т.к. в этом случае был высок риск развития угнетения дыхания под влиянием самого налорфина). ФВ: раствор 0,5% в ампулах по 1 мл и 0,05% в ампулах по 0,5 мл.
ФК: Эффект возникает только при парэнтеральном примении, т.к. при введении внутрь подвергается полной пресистемной элиминации в печени с образованием неактивных глюкуронидов. ФЭ: Налоксон устраняет практически все эффекты опиоидных анальгетиков – анальгезию, угнетение дыхания, миоз и ряд других. На фоне введения налоксона у лиц с наркотической зависимостью к опиоидам возникает абстинентный синдром, который связан с вытеснением анальгетиков из связи с рецепторами. При введении налоксона обычному человеку состояния гиперальгезии (как этого можно было бы ожидать) не возникает. Однако, было показано, что введение налоксона обычным добровольцам снижало их толерантность к боли, ухудшало ее перносимость. Было также показано, что введение налоксона позволяет устранить эффект плацебо и аккупунктуры (это доказывает, что в реализации их эффекта большую роль играют опиопептиды). Применение: Налоксон применяют как антидот при остром отравлении опиоидными анальгетиками. Для этого внутривенно повторно вводят 0,4-0,8 мг лекарства каждые 2-3 минуты до восстановления нормального дыхания (максимальная доза 10 мг). Поскольку эффект налоксона сохраняется не более 1-2 часов, по истечении этого срока инъекцию повторяют в той же дозе. Критическими являются первые 10-12 часов интоксикации, поэтому может потребоваться до 12 повторных введений налоксона. При лечении передозировки пентазоцина и бупренорфина одномоментно вводят 4-10 мг налоксона. При этом следует помнить, что дисфорический и психозомиметический эффекты этих анальгетиков (которые обусловлены s-рецепторами) налоксон не устраняет. В детской практике (для восстановления дыхания у новорожденных детей, матери которых получали опиоидные анальгетики) налоксон вводят по 10 мкг/кг веса ребенка в вену пуповины. ФВ: раствор 0,04% в ампулах по 1 мл и 0,004% в ампулах по 2 мл. Налтрексон (Naltrexone) Является длительно действующим антагонистом опиоидных рецепторов (за исключением s-рецепторов). По силе блокирующего действия примерно в 2 раза превосходит налоксон.
ФЭ: В целом идентичен налоксону. Применение: Налтрексон предложен для проведения «поддерживающей терапии» у лиц, страдающих наркотической зависимостью опиоидного типа. Введение налтрексона таким пациентам блокирует все эффекты опиоидных анальгетиков, в том числе и их способность вызывать эйфорию, поэтому инъекция морфина или героина у таких пациентов не вызывает никаких изменений со стороны психики и мотив для повторных инъекций наркотических средств исчезает. Для проведения такой терапии налтрексон вводят в дозе 50-100 мг через день. НЭ: бессонница, тошнота, колики, суставные боли. ФВ: таблетки по 50 мг. Таблица 2. Спектр активности ЛС в отношении различных типов опиоидных рецепторов.
По Goodman & Gilman’s, 2002; Бороян Р.Г., 2000; Харкевич Д.А., 2002; Венгеровский А.И., 1998
ВИТАМИНЫ И ВИТАМИНОПОДОБНЫЕ СРЕДСТВА. СРЕДСТВА, ВЛИЯЮЩИЕ НА ПРОЦЕССЫ ТКАНЕВОГО ДЫХАНИЯ. БИОГЕННЫЕ СТИМУЛЯТОРЫ Приоритетом общественного здравоохранения во всех странах должно стать обеспечение доступа к хорошему питанию. Поощрение траты индивидуальных и государственных средств на ненужные препараты витаминов не способствует удовлетворению потребностей общества в здравоохранении. Скорее оно укрепляет ошибочное представление о том, что существует волшебная таблетка, при помощи которой все эти потребности будут удовлетворены. Эндрю Четли Проблемные лекарства Витамины – низкомолекулярные органические вещества разнообразного строения, которые являются незаменимыми компонентами рационального питания, обеспечивают нормальное протекание физиологических и биохимических процессов, но сами при этом не используются для пластических и энергетических нужд. Как правило, посредниками в реализации эффектов витаминов выступают ферменты (исключение составляют семейства витаминов A и D, которые выполняют в организме гормональную функцию). Классификация лекарственных средств, с активностью витаминов: I. Лекарственные средства, с активностью жирорастворимых витаминов: 1. Средства, с активностью витамина А (ретиноиды): A. Природные ретиноиды: ретинола ацетат, ретиноевая кислота; B. Синтетические ретиноиды: изотретиноин, этретинат. 2. Средства, с активностью витамина D: эргокальциферол, холекальциферол, кальцитриол. 3. Средства, с активностью витамина Е: токоферола ацетат. 4. Средства, с активностью витамина К: фитоменадион, викасол. II. Лекарственные средства, с активностью водорастворимых витаминов: 1. Средства, с активностью витаминов группы В: тиамина хлорид, рибофлавин, кальция пантотенат, кислота фолиевая, кислота никотиновая, никотинамид, пиридоксина гидрохлорид, цианокобаламин; 2. Средства, с активностью других водорастворимых витаминов: кислота аскорбиновая, рутин. III. Витаминоподобные средства: кальция пангамат, кислота липоевая, холина хлорид, карнитина хлорид. IV. Поливитаминные средства:[7] 1. Витаминные комплексы; 2. Собственно поливитаминные препараты; 3. Поливитаминные препараты с микроэлементами и биологически активными добавками. Жирорастворимыми называют витамины, которые способны растворяться в липидах мембран клеток и накапливаться в организме при введении в больших количествах, вызывая при этом интоксикацию. Водорастворимыми называют витамины, которые не способны растворяться в липидах мембран клеток и не могут накапливаться в организме. Даже при введении в больших дозах избыток витамина выводится из организма с мочой или калом. Витаминоподобные средства – вещества, которые подобно витаминам поступают в организм и действуют в микроколичествах, однако, в отличие от витаминов они могут синтезироваться в организме человека при условии, что в пище содержится достаточное количество их предшественников. Витамеры – изомеры витаминов способные к взаимной трансформации друг в друга и выполняющие одинаковые биологические функции. Примерами витамеров являются ретинол и ретиналь – представляющие собой витамеры витамина А (спиртовую и альдегидную форму соответственно). Дата добавления: 2015-01-12 | Просмотры: 1032 | Нарушение авторских прав |
 МД: Морфин связывается с m- и k-рецепторами опиоидных пептидов и стимулирует их. В итоге повышается активность антиноцицептивной системы и усиливаются ее тормозящие влияния на функции ноцицептивной системы.
МД: Морфин связывается с m- и k-рецепторами опиоидных пептидов и стимулирует их. В итоге повышается активность антиноцицептивной системы и усиливаются ее тормозящие влияния на функции ноцицептивной системы. ФК: Хорошо всасывается из ЖКТ, но как и морфин подвергается пресистемному метаболизму (биодоступность 40-60%), поэтому применяется главным образом парентерально. Метаболизируется в печени, при этом N-деметилированный метаболит тримепиридина оказывает на ЦНС возбуждающее действие, вызывает галлюцинации, тремор, судороги.
ФК: Хорошо всасывается из ЖКТ, но как и морфин подвергается пресистемному метаболизму (биодоступность 40-60%), поэтому применяется главным образом парентерально. Метаболизируется в печени, при этом N-деметилированный метаболит тримепиридина оказывает на ЦНС возбуждающее действие, вызывает галлюцинации, тремор, судороги.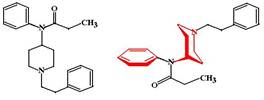 ФК: Фентанил чрезвычайно высокодипофилен и хорошо всасывается не только из ЖКТ, но даже при чрезкожном введении. Несмотря на это пероральное введение фентанила не используют в виду выраженного пресистемного метаболизма, чаще всего пользуются внутривенным введением фентанила.
ФК: Фентанил чрезвычайно высокодипофилен и хорошо всасывается не только из ЖКТ, но даже при чрезкожном введении. Несмотря на это пероральное введение фентанила не используют в виду выраженного пресистемного метаболизма, чаще всего пользуются внутривенным введением фентанила. ФЭ: В отличие от всех других опиоидных анальгетиков пиритрамид расширяет коронарные сосуды, поэтому чаще всего его предпочитают для обезболивания у пациентов с инфарктом миокарда.
ФЭ: В отличие от всех других опиоидных анальгетиков пиритрамид расширяет коронарные сосуды, поэтому чаще всего его предпочитают для обезболивания у пациентов с инфарктом миокарда. ФК: Метадон хорошо всасывается после перорального введения, но практически не подвергается пресистемному метаболизму (его биодоступность около 90%). Период полуэлиминации метадона достаточно большой (14 ч), а при регулярном применении возрастает до 22 часов за счет депонирования лекарства в жировой ткани.
ФК: Метадон хорошо всасывается после перорального введения, но практически не подвергается пресистемному метаболизму (его биодоступность около 90%). Период полуэлиминации метадона достаточно большой (14 ч), а при регулярном применении возрастает до 22 часов за счет депонирования лекарства в жировой ткани.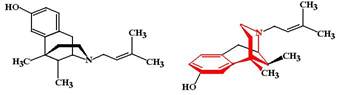 Пентазоцин (Pentazocine, Fortral). МД: Пентазоцин является полным агонистом s и k-рецепторов и парциальным агонистом m-рецепторов. Фармакологической активностью обладает только левовращающий изомер. Большинство фармакологических эффектов пентазоцина обусловлено активацией k-рецепторов. Влияние пентазоцина на m-рецепторы зависит от их исходного состояния. В том случае, если m-рецепторы свободны пентазоцин связывается с ними и активность рецепторов повышается. Если рецепторы уже оккупированы полным агонистом (эндорфин или опиоидный анальгетик) пентазоцин вытесняет агонист из связи с рецептором и воспроизводит «эффект блокады», поскольку способность его активировать рецепторы меньшая, чем у полных агонистов.
Пентазоцин (Pentazocine, Fortral). МД: Пентазоцин является полным агонистом s и k-рецепторов и парциальным агонистом m-рецепторов. Фармакологической активностью обладает только левовращающий изомер. Большинство фармакологических эффектов пентазоцина обусловлено активацией k-рецепторов. Влияние пентазоцина на m-рецепторы зависит от их исходного состояния. В том случае, если m-рецепторы свободны пентазоцин связывается с ними и активность рецепторов повышается. Если рецепторы уже оккупированы полным агонистом (эндорфин или опиоидный анальгетик) пентазоцин вытесняет агонист из связи с рецептором и воспроизводит «эффект блокады», поскольку способность его активировать рецепторы меньшая, чем у полных агонистов. ФЭ: В целом по своим эффектам буторфанол напоминает пентазоцин, но в отличе от последнего значительно реже вызывает дисфорию. Подобно пентазоцину буторфанол оказывает стимулирующее действие на гемодинамику сердца и должен с осторожностью применяться при инфаркте миокарда и отеке легких.
ФЭ: В целом по своим эффектам буторфанол напоминает пентазоцин, но в отличе от последнего значительно реже вызывает дисфорию. Подобно пентазоцину буторфанол оказывает стимулирующее действие на гемодинамику сердца и должен с осторожностью применяться при инфаркте миокарда и отеке легких. Бупренорфина гидрохлорид (Buprenophine hydrochloride, Buprenex, Temgesic). МД: является слабым агонистом d-рецепторов, парциальным агонистом m-рецепторов и антагонистом k-рецепторов. Отличительной особенностью бупренорфина является высокое сродство к опиоидным рецепторам и способность образовывать с ними прочную связь. Диссоциация бупренорфина из связи с рецептором протекает крайне медленно и его эффект поэтому чрезвычайно трудно устранить введением антагонистов опиоидных рецепторов (налоксона).
Бупренорфина гидрохлорид (Buprenophine hydrochloride, Buprenex, Temgesic). МД: является слабым агонистом d-рецепторов, парциальным агонистом m-рецепторов и антагонистом k-рецепторов. Отличительной особенностью бупренорфина является высокое сродство к опиоидным рецепторам и способность образовывать с ними прочную связь. Диссоциация бупренорфина из связи с рецептором протекает крайне медленно и его эффект поэтому чрезвычайно трудно устранить введением антагонистов опиоидных рецепторов (налоксона).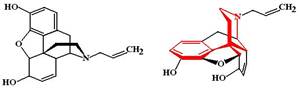 ФЭ: Агонистический эффект налорфина проявляется только в отсутствие полных агонистов (т.е. в тех случаях, когда опиоидные рецепторы свободны). Налорфин вызывает анальгетический эффект, который составляет 60-70% эффекта морфина, но при этом даже повышение дозы налорфина не приводит к нарастанию анальгезии (как это имеет место в случае с морфином). Налорфин вызывает миоз, седативный эффект, гипотермию. В дозах более 20 мг может вызвать угнетение дыхания. Для налорфина не характерен снотворный эффект.
ФЭ: Агонистический эффект налорфина проявляется только в отсутствие полных агонистов (т.е. в тех случаях, когда опиоидные рецепторы свободны). Налорфин вызывает анальгетический эффект, который составляет 60-70% эффекта морфина, но при этом даже повышение дозы налорфина не приводит к нарастанию анальгезии (как это имеет место в случае с морфином). Налорфин вызывает миоз, седативный эффект, гипотермию. В дозах более 20 мг может вызвать угнетение дыхания. Для налорфина не характерен снотворный эффект.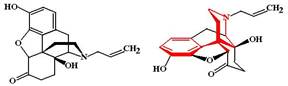 Налоксон (Naloxone, Narcanti) МД: является антагонистом m-, d- и k-рецепторов, но в отношении m-рецепторов его блокирующее действие выражено в 10 раз сильнее, чем в отношении других популяций рецепторов. По данным отдельных авторов способен стимулировать s-рецепторы. Заблокированные налоксоном рецепторы нечувствительны к стимулирующему действию опиоидных анальгетиков и эндогенных опиопептидов.
Налоксон (Naloxone, Narcanti) МД: является антагонистом m-, d- и k-рецепторов, но в отношении m-рецепторов его блокирующее действие выражено в 10 раз сильнее, чем в отношении других популяций рецепторов. По данным отдельных авторов способен стимулировать s-рецепторы. Заблокированные налоксоном рецепторы нечувствительны к стимулирующему действию опиоидных анальгетиков и эндогенных опиопептидов. ФК: После однократного применения эффект сохраняется около 24-48 часов. В отличие от налоксона не подвергается пресистемному метаболизму и поэтому может применяться внутрь.
ФК: После однократного применения эффект сохраняется около 24-48 часов. В отличие от налоксона не подвергается пресистемному метаболизму и поэтому может применяться внутрь.