|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ВИТАМИНОПОДОБНЫЕ СРЕДСТВА
ФЭ: 1. Обеспечивает синтез креатинфосфата в мышцах. 2. Способствует утилизации лактата в печени и подавляет гликогенолиз, сохраняя тем самым пул гликогена печени и мышц. Применение. В настоящее время нет научно обоснованных показаний для применения пангамовой кислоты. Эмпирически ее назначают спортсменам в период интенсивных физических нагрузок во время предсоревновательной подготовки по 100 мг 3-4 раза в день. В руководстве «Drug Evaluations» (American Medical Association, 1986 г.) указано, что «Токсические вещества, известные как витамин В15 (пангамовая кислота) и витамин В17 (летриль), не являются ни питательными веществами, ни витаминами. Летриль содержит 6% цианида; он был причиной хронического отравления цианидом и смертельных исходов. Пангамовая кислота или пангамат может оказывать мутагенное действие. Ни одно из этих веществ не обладает подтвержденной питательной или какой-либо иной ценностью». НЭ: При использовании пангамата кальция возможно повышение артериального давления. Доказано мутагенное влияние пангамата на половые клетки. ФВ: таблетки по 50 мг в оболочке. Липоевая кислота (Lipoic acid, Alfa-Lipoic acid, Thioctic acid, Thiogamma, Thioctacid, Espa-lipon) Липоевая кислота способна синтезироваться в организме человека, поэтому она не является классическим витамином.
ФК: После приема внутрь хорошо всасывается, но биодоступность составляет около 30%. Это связано с тем, что практически 70% всосавшейся кислоты поступает в печень и подвергается метаболизму в гепатоцитах. Благодаря столь интенсивному метаболизму в печени принимать менее 100 мг кислоты бессмысленно – ее поступление в организм будет минимальным. Выведение липоевой кислоты осуществляется почками, после окисления и конъюгации в печени. Период полуэлиминации составляет 10-40 мин. ФЭ: 1. Липоевая кислота входит в состав декарбоксилазного комплекса a-кетокислот и обеспечивает образование из них ацил-КоА. Наиболее важным является декарбоксилирование пировиноградной кислоты до ацетил-КоА – реакция, которая обеспечивает функционирование в клетке цикла трикарбоновых кислот и процессы синтеза липидов. 2. Липоевая кислота стимулирует внутриклеточную утилизацию глюкозы в ЦТК инсулиннезависимым путем. 3. Липоевая кислота обеспечивает транспорт в митохондрии гепатоцитов ацильных остатков жирных кислот для последующего окисления и предупреждает их накопление в клетке (жировую дистрофию). Т.о. липоевая кислота оказывает гепатопротекторное действие. Применение и режим дозирования. Липоевую кислоту применяют для лечения диабетических нейропатий. У больных сахарным диабетом недостаток инсулина приводит к тому, что клетки не способны получать энергию гликолитическим путем. Компенсаторно организм переходит на липолитический путь – за счет липолиза выделяются свободные жирные кислоты, которые подвергаются b-окислению, усиливается продукция кетоновых тел. Накопление кетоновых тел в волокнах нервной системы и их неполное окисление приводит к тому, что возникает избыток a-кетокислот в нейроне и нарушается синтез цереброзидов – эссенциальных липидов миелиновых облочек. Введение липоевой кислоты активирует работу декарбоксилазного комплекса и уровень токсичных a-кетокислот понижается. Восстанавливается синтез миелиновых оболочек и нейропатия уменьшается. Для лечения нейропатии требуется введение больших (супрафизиологических) доз липоевой кислоты. В первые 2-4 недели липоевую кислоту вводят внутривенно капельно в дозе 300-600 мг/сут (скорость инфузии не более 50 мг/мин, флакон должен быть защищен от действия света). Затем переходят на поддерживающую терапию внутрь по 300-600 мг/сут в 1-2 приема. В последнее время применение липоевой кислоты в тех же дозах рекомендуют для лечения жировой дистрофии печени. НЭ: Липоевая кислота относительно малотоксична, но ее применение может сопровождаться следующими нежелательными эффектами: · Диспепсические проявления – изжога, неприятный вкус во рту, язвенное поражение слизистой оболочки желудка. · При парентеральном введении возможно возникновение аллергических реакций в месте введения, вплоть до системных реакций (анафилактического шока). · Липоевая кислота потенцирует действие гипогликемизирующих средств, поэтому в первые недели лечения у пациента следует проверять уровень гликемии, во избежания развития гипогликемической комы. · Крайне редко при внутривенном введении липоевой кислоты возможно развитие нейротоксических реакций – судорог, диплопии. ФВ: таблетки по 25, 200 и 600 мг в оболочке; раствор 0,5% в ампулах по 2 мл, 2,5% в ампулах по 12 и 24 мл, 3% в ампулах по 20 мл, 1,2% во флаконах по 50 мл. Холина хлорид (Choline chloride) Минимальная суточная потребность в холине составляет 600-1000 мг/сут, однако, его широкое распространение в пищевых продуктах приводит к тому, что в среднем европейцы потребляют около 6.000 мг/сут холина. Основными источниками холина являются фосфатидил холин и сфингомиелин мембран клеток. Наиболее богаты холинсодержащими фосфолипидами следующие продукты:
В организме холин поступает во все ткани, но наибольшие его количества содержатся в печени, почках, молочных железах, плаценте, мозге и мышцах.
ФЭ: В организме человека холин обеспечивает следующие основные функции: 1. Синтез ацетилхолина. В нейронах парасимпатической нервной системы и плаценте за счет действия фермента холинацетилазы холин трансформируется в медиатор – ацетилхолин. 2. Синтез фосфолипидов мембран клетки (лецитина). Холин может напрямую включаться в молекулы диглицеридов при участии ЦТФ, как активатора молекулы. Кроме того, холин может обеспечить синтез лецитина de novo, выступая, как донор метильных групп гомоцистеина. 3. Холин трансформируется в бетаин – резервный донор одноуглеродных остатков в организме. В обычных условиях, переносчиком одноуглеродных остатков в организме, при синтезе ДНК и регенерации гомоцистеина в метионин, является тетрагидрофолиевая кислота (ТГФК). В том случае, если работа фолатного цикла нарушается (например, при дефиците витамина ВС или лечении антифолатами – метотрексатом) холиновый шунт остается едиственным источником метильных групп. 4. Липомобилизующее действие (нормализация жирового обмена). Холин является кофактором фермента карнитин-ацил трансферазы (КАТ), который переносит длинноцепочечные жирные кислоты на карнитине в митохондрии для их последующего окисления. 5. Антимутагенное и антиканцерогенное действие. Данный эффект холина связан, как полагают, по крайней мере с двумя механизмами: [ Бетаин и холин обеспечивают метилирование протоонкогенов c-fos, c-myc, c-Ha-ras. В неметилированном состоянии эти гены подвергаются гиперэкспрессии и стимулируют рост и деление клетки. В метилированном состоянии экспрессия этих генов падает и клетка вступает в период диференцировки. [ Этерификация холином диацетилглицеридов также является важным компонентом антимутагенного действия. Диацетилглицериды являются вторичными мессенджерами онкогенных белков семейств erbB, ras и src. Они передают сигнал от этих белков на протеинкиназы С и запускают неконтролируемое деление клетки. Под влиянием холина избыток диацетилглицеридов этерифицируется в фосфолипиды мембран и лишается своей онкогенной функции.
Схема 4. Метаболизм холина. ДГ – дегидрогеназа, S-АГ – S-аденозил-гомоцистеин, S-АМ – S-аденозил-метионин. Правая ветвь схемы показывает трансформацию холина в медиатор ацетилхолин. Левая ветвь – трансформация холина в бетаин, которая обеспечивает резервный транспорт метильных групп в обход фолиевой кислоты и синтез фосфолипидов de novo. Нижняя ветвь – прямой синтез фосфолипидов из холина при участии ЦТФ. Применение. Дефицит холина у человека не описан. У лабораторных животных (крысы, макаки, собаки, морские свинки и куры) безхолиновая диета вызывала развитие жировой дистрофии печени. Интересно, что у крыс дегенерация гепатоцитов наступала уже через несколько часов после назначения безхолиновой диеты. В настоящее время холин применяют эмпирически при циррозе печени, гепатитах, жировой дистрофии печени. Внутрь холин назначают по 1000 мг 3-5 раз в день в течение 1-4 недель. Для внутривенного введения готовят 1% раствор холина (для этого разводят 10 мл 20% раствора холина в 200 мл физраствора или 5% глюкозы), который вводят внутривенно капельно со скоростью не более 30 капель/мин, всего 2-3 г/сут. НЭ: Диспепсические явления. При быстром внутривенном введении возникает ощущение жара, брадикардия, падение АД (полагают, что это связано с активацией холинергических систем организма), тошнота и рвота. ФВ: порошок, раствор 20% в ампулах по 10 мл.
Основным пищевым источником карнитина являются продукты животного происхождения, которые содержат в десятки тысяч раз бóльшие его количества, чем фрукты и овощи. Наибольшие количества карнитина содержатся в следующих продуктах:
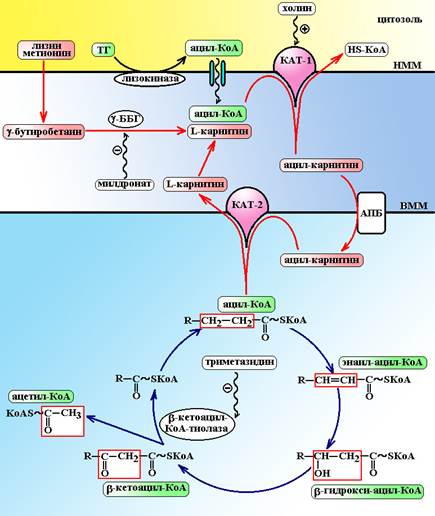
Карнитин после введения в организм хорошо всасывается, абсорбция карнитина осуществляется при участии стереоспецифического транспортера, который обеспечивает усвоение исключительно L-изомера карнитина. Основным депо карнитина в организме является мышечная ткань. МД: L-карнитин образует челночный механизм, который осуществляет транспорт остатков жирных кислот в митохондрии через их мембрану (схема 5). Лизокиназа наружной мембраны митохондрий гидролизует триглицериды и переносит ацильный остаток жирной кислоты на HS-КоА, который по специальным порам попадает в межмембранное пространство митохондрий. Здесь, карнитин-ацил трансфераза I (КАТ-1) переносит остаток жирной кислоты на молекулу карнитина, а HS-KoA выталкивает обратно в цитоплазму. Ацил-карнитин специальным белком переносится внутрь митохондрии и здесь КАТ-2 переносит ацильный остаток на молекулу HS-KoA, а карнитин выталкивает в межмембранное пространство и цикл переноса ацильного остатка вновь повторяется. ФЭ: 1. Перенос карнитином длинноцепочечных жирных кислот (пальмитиновая, стеариновая и др.) в митохондрии с последующим их b-окислением является одним из самых энергетически выгодных процессов. При окислении 1 моль глюкозы образуется 38 моль АТФ, тогда как окисление 1 моль гексановой жирной кислоты (капроевой кислоты, содержит, как и глюкоза, 6 атомов углерода) образуется 45 моль АТФ. Кроме того, ацетил-КоА, образущийся в ходе b-окисления используется для синтеза кетоновых тел, которые потребляются тканями миокарда и нервной системы в качестве источников энергии. Однако, процесс липолитического получения энергии более затратен по кислороду – в случае гликолиза 1 моль кислорода позволяет получить 6,3 моль АТФ, а при липолизе расход 1 моль кислорода позволяет синтезировать только 5,63 моль АТФ. Т.о. липолиз, несомненно, более выгодный в плане получения энергии, но и более затратный процесс.
Схема 5. Работа карнитинового челнока и b-окисление жирных кислот. ТГ – триглицериды, НММ – наружная мембрана митохондрии, ВММ – внутренняя мембрана митохондрии, g-ББГ – g-бутиробетаин гидроксилаза, АПБ – ацилпереносящий белок, КАТ-1,2 – карнитин-ацил трансферазы I и II типов. 2. Липолитическое действие. За счет работы карнитина жирные кислоты окисляются и удаляются из цитоплазмы клетки. В организме уменьшается объем жировой ткани, снижается масса тела. Происходит устранение липидной дистрофии гепатоцитов и кардиомиоцитов. 3. Анаболическое действие. Карнитин связывает аммиак и обеспечивает органификацию ионов аммония, включение его в биосинтез аминокислот. В итоге, увеличивается синтез белка и обеспечивается прирост мышечной массы. Удачное сочетание анаболического эффекта с устранением избыточного отложения жира часто используется в спортивной медицине у спортсменов, занимающихся силовыми видами спорта. 4. Карнитин удаляет из митохондрий остатки короткоцепочечных жирных кислот (уксусной, изовалериановой, октаноевой, пиваликовой), которые образуются в процессе b-окисления длинноцепочечных жирных кислот. Накопление этих кислот в митохондриях может вызывать нарушение процессов окислительного фосфорилирования. 5. В процессе удаления из митохондрий короткоцепочечных кислот образуется ацетил-карнитин, который крайне важен для метаболизма в ЦНС: он обеспечивает утилизацию мозгом кетоновых тел, стимулирует синтез ацетилхолина, фактора роста нервов, миелина. Показано, что он улучшает мнестические способности, оказывает легкий анксиолитический эффект. Применение и режим дозирования. · Новорожденные и недоношенные дети с плохой прибавкой массы тела и задержкой роста. Назначают внутрь или внутривенно детям до 2 лет в дозе 150 мг/кг/сут, в возрасте от 2 до 6 лет по 100 мг/кг/сут, от 6 до 12 лет – 75 мг/кг/сут. · Взрослым карнитин назначают при нервной анорексии, физическом истощении, продолжительных и интенсивных спортивных тренировках по 2-6 г/сут внутрь в 2-3 приема. · Реабилитация пациентов с миокардиодистрофиями, кардиомиопатиями, постинфарктным кардиосклерозом, миопатиями. Назначают внутрь по 1-4 г/сут в 2-3 приема. · У пациентов с хронической почечной недостаточностью, находящихся на гемодиализе карнитин вводят по 2,0 г однократно сразу после завершения очередного сеанса гемодиализа. НЭ: При введении внутрь в больших дозах может вызвать боли в эпигастральной области. ФВ: таблетки жевательные 100 мг; раствор 10% во флаконах по 10 мл и 20% во флаконах по 50 и 100 мл для приема внутрь, раствор 20% в ампулах по 5 мл для инъекций. Дата добавления: 2015-01-12 | Просмотры: 1305 | Нарушение авторских прав |
 Кальция пангамат (Calcii pangamas, Vitamin B15) Витаминные функции пангамовой кислоты до конца не ясны. Полагают, что механизм ее действия может быть связан со способностью выступать в роли донатора метильных групп.
Кальция пангамат (Calcii pangamas, Vitamin B15) Витаминные функции пангамовой кислоты до конца не ясны. Полагают, что механизм ее действия может быть связан со способностью выступать в роли донатора метильных групп. МД: В организме человека липоевая кислота может восстанавливаться до дигидролипоевой кислоты и образовывать при этом окислительно-восстановительную систему, которая способна переносить протоны водорода и ацильные группы.
МД: В организме человека липоевая кислота может восстанавливаться до дигидролипоевой кислоты и образовывать при этом окислительно-восстановительную систему, которая способна переносить протоны водорода и ацильные группы. МД: Полагают, что холин выполняет 2 основные функции. С одной стороны, он выступает в качестве структурного компонента для синтеза полярных молекул. С другой стороны, он участвует в переносе одноуглеродных остатков (метильных групп) в качестве первичного донора.
МД: Полагают, что холин выполняет 2 основные функции. С одной стороны, он выступает в качестве структурного компонента для синтеза полярных молекул. С другой стороны, он участвует в переносе одноуглеродных остатков (метильных групп) в качестве первичного донора.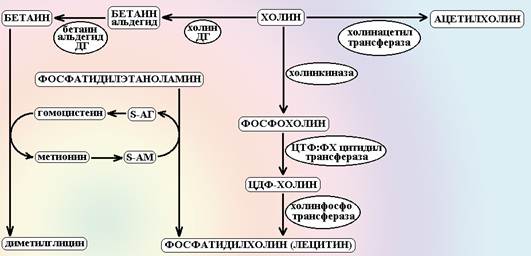
 Карнитина хлорид (Levocarnitine, Carnitene, Elcar, Vitamin BT) L-карнитин поступает в организм человека с пищей (»75%), а также способен синтезироваться в печени и почках из 2 аминокислот – лизина (который выступает в роли источника углеводородного скелета) и метионина (донора метильной группировки). Для синтеза L-карнитина требуются 5 ферментов и 5 витаминных кофакторов – витамины С, РР, В6, В12 и ВС. Лимитирующей стадией синтеза карнитина является окисление g-бутиробетаина при участии аскорбиновой кислоты ферментом g-бутиробетаин гидроксилазой.
Карнитина хлорид (Levocarnitine, Carnitene, Elcar, Vitamin BT) L-карнитин поступает в организм человека с пищей (»75%), а также способен синтезироваться в печени и почках из 2 аминокислот – лизина (который выступает в роли источника углеводородного скелета) и метионина (донора метильной группировки). Для синтеза L-карнитина требуются 5 ферментов и 5 витаминных кофакторов – витамины С, РР, В6, В12 и ВС. Лимитирующей стадией синтеза карнитина является окисление g-бутиробетаина при участии аскорбиновой кислоты ферментом g-бутиробетаин гидроксилазой.