|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
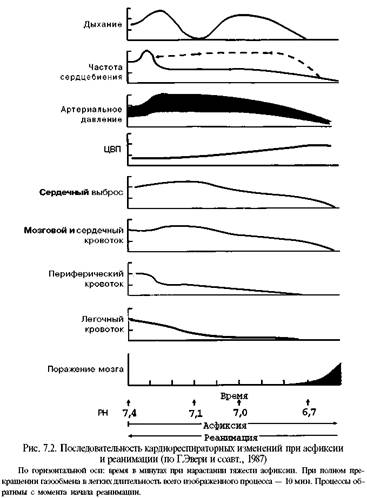
Первичная помощь новорожденному в родильной комнате. Асфиксия новорожденныхСогласно Международному консенсусу по реанимации новорожденных (МКРН; 2000; Pediatrics. - 2000. - V. 1 0 6. - №3. - Р. 1-16), н е менее чем 1 0 % детей сразу после рождения требуется активная медицинская помощь для того, чтобы они активно закричали, регулярно задышали, приобрели хороший цвет кожных покровов и мышечный тонус, частоту сердцебиений большую, чем 100 в 1 минуту. Среди недоношенных процент требующих указанной помощи гораздо выше. Так, в Москве более чем у 40% детей гестационного возраста менее 32 нед., 20% детей гестационного возраста 3 2 — 3 6 нед. и 1 0 % детей гестаци-онного возраста 3 7 — 4 1 нед. с первых минут жизни самостоятельное дыхание бывает неэффективным (Дегтярев Д.Н., 1999). В МКРН указано, что ежегодно в мире умирает более 5 млн новорожденных, и в 19% случаев причиной смерти является асфиксия. Эксперты полагают, что более 1 млн смертей новорожденных во всем мире можно было бы предотвратить, если бы на местах совершенствовалась техника первичной помощи новорожденным сразу после рождения. Частота рождения детей в асфиксии — 1—1,5% (с колебаниями от 9% среди детей гестационного возраста при рождении менее 36 нед. до 0,3% — среди детей со сроком гестации более 37 нед.). Т е р м и н о л о г и я. Асфиксия новорожденного — отсутствие газообмена в легких ребенка после рождения, т.е. удушье — неспособность дышать при наличии других признаков живорожденности. Типичные биохимические проявления асфиксии — гипоксемия, гиперкапния и патологический ацидоз. Термин асфиксия новорожденного — самый неточный из используемых в неонатологии хотя бы потому, что в переводе с греческого означает беспульсие, а такие дети обычно — мертворожденные. Кардиореспираторная депрессия при рождении — синдром, характеризующийся угнетением при рождении и в первые минуты жизни основных жизненных функций; проявляется брадикардией, пониженным мышечным тонусом, гиповентиляцией, т.е. неэффективным дыханием, артериальной гипотензией, но нередко при отсутствии в крови гиперкапнии. При этом обычно у ребенка имеется один или два вышеупомянутых симптома угнетения жизнедеятельности, и оценка по шкале Апгар через 1 мин после рождения составляет 4 — 6 баллов. Частота рождения детей с кардиореспираторной депрессией разной степени, по данным различных авторов, доходит до 1 0 — 1 5 %. Обычно этим детям требуется лишь создание оптимальных условий окружающей среды и временная дыхательная и/или другая поддержка (до данным МКРН, 5 — 1 0 % всех новорожденных сразу после рождения требуется вспомогательная вентиляция легких), и через 5 минут оценка по шкале Апгар становится 7 баллов и выше. У таких детей прежде диагностировали легкую или среднетяжелую асфиксию при рождении и назначали совершенно им не требующуюся жидкостную и фармакотерапию. Акте-, интра-, перинатальная гипоксия — термин, используемый при выявлении у плода брадикардии, вторичной к гипоксемии и резкому снижению перфузии, оксигенации тканей, вторичному метаболическому ацидозу из-за нарушений дыхательной функции плаценты до или в родах, безотносительно к этиологии патологического процесса. Реанимация (оживление) — восстановление легочных или сердечных функций после их прекращения (т.е. после периода отсутствия дыхания или сердцебиений). Первичное апноэ — начальный физиологический ответ на острую перинатальную гипоксию — прекращение дыхательных движений, брадикардия, тран-зиторная артериальная гипертензия (рис. 7.1) и следующие за ними периодическое гаспинг-дыхание (судорожное дыхание, регулируемое центром, расположенным в каудальной части продолговатого мозга, с максимальным сокращением инспираторных мышц и пассивным выдохом обычно при затруднении прохождения воздуха на выдохе через верхние отделы дыхательных путей, прежде всего через голосовую щель). Начатое в этой фазе оживление требует кратковременной вспомогательной вентиляции легких (ВВЛ), практически всегда результативно — быстрый эффект, хороший прогноз. Вторичное апноэ — вторичная остановка дыхания (прекращение дыхательных движений грудной клетки) после гаспинг-дыхания, следовавшего за первичным апноэ. Типично падение артериального давления, брадикардия, мы-
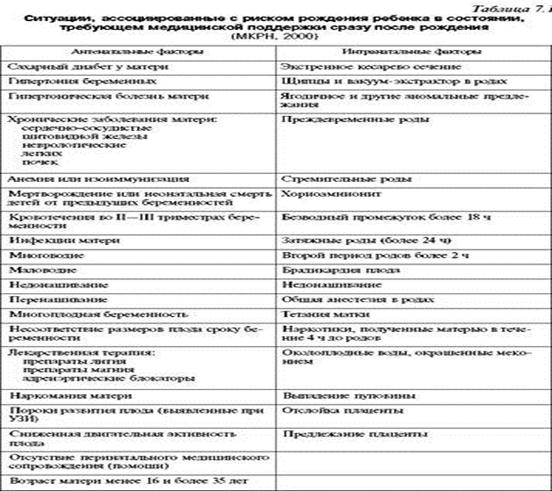
шечная гипотония. Оживление, начатое в этой фазе перинатальной гипоксии, требует не только ВВЛ, но и ИВЛ с последующей сосудисто-сердечной интенсивной терапией и, обычно, медикаментозной терапией, в частности полиорганных нарушений. Восстановление жизнедеятельности новорожденного — медленное, прогноз не всегда благоприятный. Асфиксия острая — асфиксия новорожденного, причиной которой являются лишь интранатальные факторы (см. ниже). Асфиксия, развившаяся на фоне хронической внутриутробной гипоксии — асфиксия новорожденного, развивавшегося антенатально в условиях длительной плацентарной недостаточности, анте- и/или длительной гипоксии (более 4 нед.). Этиология. Причиной рождения ребенка в условиях кардиореспираторной депрессии могут быть: Срессированные роды. Лекарства, полученные интранатально от матери — анестетики и анальгетики, антидепрессанты, магния сульфат, адреноблокаторы (см. табл. 3.6). Постгеморрагический шок — фетоматеринские и фетофетальные транс фузии, преждевременная отслойка плаценты, разрывы сосудов пуповины и др. (см. гл. XVIII). Травма — внутричерепные повреждения, кровоизлияния при быстрых родах, ягодичном и тазовом предлежании, использовании акушерских щипцов, вакуум-экстрактора. Собственно болезни плода: сердца, легких, мозга — врожденные аномалии, травмы или инфекционные поражения. Асфиксия новорожденных — одна из частых причин кардиореспиратор-ной депрессии. Ж. Неустановленные причины: нередко причину рождения ребенка с кардио-респираторной депрессией и низкой оценкой по шкале Апгар выявить не удается. В МКРН перечислены следующие факторы, ассоциированные с неонаталь-ной депрессией и асфиксией (табл. 7.1). Что касается присутствия мекония в околоплодных водах, то его обнаруживают в 1 2 — 1 5 % родов, но лишь у каждого 5 - г о из таких детей обнаруживают фе-тальный дистресс и аспирацию мекония, т.е. меконий в трахее. Суммируя изложенное, можно выделить 5 ведущих механизмов, приводящих к острой асфиксии новорожденных: прерывание кровотока через пуповину (истинные узлы пуповины, сдав-ления ее, тугое обвитие пуповиной вокруг шеи или других частей тела ребенка); нарушение обмена газов через плаценту (преждевременная полная или неполная отслойка плаценты, предлежание плаценты и др.); неадекватная гемоперфузия материнской части плаценты (чрезмерно активные схватки, артериальные гипотензия и гипертензия любой этиологии у матери); плохая оксигенация крови матери (тяжелые анемия, сердечно-сосудистые заболевания, дыхательная недостаточность); недостаточность дыхательных усилий новорожденного (иатрогенная — влияние медикаментозной терапии матери; антенатальные поражения мозга плода, врожденные пороки развития легких и др.). Наиболее высок риск рождения в асфиксии у недоношенных, переношенных и детей с задержкой внутриутробного развития. У многих новорожденных
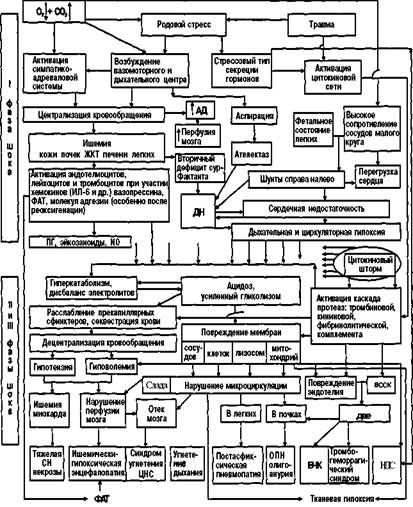
Схема 7.1. Патогенез острой асфиксии новорожденных, не осложненной хронической антенатальной гипоксией АД - артериальное давление; О П Н - острая почечная недостаточность; ЦНС - нейтральная нервная система; ЖКТ - желудочно-кишечный тракт; ДН - дыхательная недостаточность; ВССК - внут-рисосудистое свертывание крови; N0 - оксид азота; ПГ - простагландины; ДВС - диссеминирован-ное внутрисосудистое свертывание (крови); ВЧК - внутричерепное кровоизлияние; СН - сердечная недостаточность; ФАТ - фактор активации тромбоцитов; НДС - иммунодефицитное состояние. имеется сочетание факторов высокого риска развития как анте-, так и интрана-тальной гипоксии, хотя не обязательно антенатальная гипоксия приводит к рождению ребенка в асфиксии.
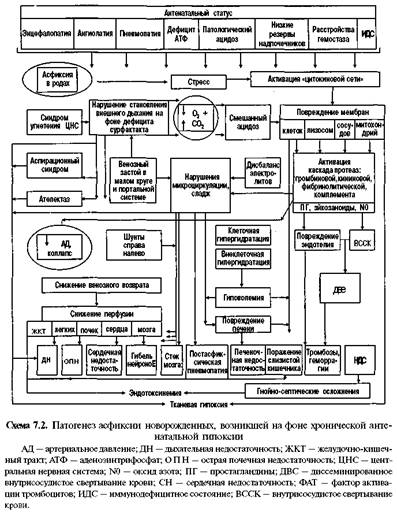
П а т о г е н е з. Кратковременная умеренная внутриутробная гипоксия (схема 7.1 рис. 7.2) вызывает включение механизмов компенсации, направленных на поддержание адекватной оксигенации тканей плода. Увеличивается выброс глюкокортикоидов, число циркулирующих эритроцитов и объем циркулирующей крови. Возникает тахикардия и, возможно, некоторое повышение систолического давления без увеличения сердечного выброса. Увеличивается двигательная активность плода и частота дыхательных движений грудной клетки при закрытии голосовой щели, что также способствует компенсации гемодина-мических нарушений. Упомянутые изменения определяются тремя известными в настоящее время путями приспособления (адаптации, реакций защиты) плода к нарастающей гипоксии: физиологический — повышение симпатической активности (активация синтеза норадреналина и адреналина параганглиями и мозговым слоем надпочечников плода); метаболический — активация анаэробного гликолиза; фармакологический — повышение синтеза тормозного медиатора в головном мозге — гамма-аминомасляной кислоты (ГАМК), а также эндогенных опиатов, аденозина. Тяжелая и/или длительная гипоксия влечет за собой срыв механизмов компенсации, что проявляется прежде всего истощением симпатоадреналовой системы и коры надпочечников, артериальной гипотензией, брадикардией, коллапсом. Продолжающаяся гипоксия приводит к активации анаэробного гликолиза. Нарастающий дефицит кислорода заставляет организм централизовать кровообращение: снизить оксигенацию кишечника, кожи, печени, почек и преимущественно кровоснабжать жизненно важные органы (головной мозг, сердце, надпочечники). Централизация кровообращения, в свою очередь, усугубляет тканевой метаболический ацидоз (в крови резко увеличивается уровень лакта-та). Развиваются снижение двигательной активности плода, частотной активности на ЭЭГ, числа дыхательных экскурсий грудной клетки, появляется бра-дикардия. Патологический ацидоз увеличивает проницаемость сосудистой стенки и клеточных мембран. Это приводит к гемоконцентрации, сладжированию эритроцитов, образованию внутрисосудистых тромбов, выходу жидкой части крови в интерстициальное пространство, гиповолемии. Повышение проницаемости клеточных мембран вызывает дисэлектролитемию (гиперкалие-мию, гипомагниемию, гипокальциемию) и может спровоцировать ДВС-син-дром. Гипоксическая энцефалопатия, которая является самым грозным клиническим проявлением тяжелой асфиксии, возникает прежде всего вследствие энергодефицита нейронов из-за ишемии ткани головного мозга (артериальная гипо-тензия при АД на локтевой артерии менее 50 мм рт.ст., тромбозы венул и арте-риол, нарушение венозного оттока из-за отека головного мозга), патологического ацидоза, а также дисэлектролитемии, мелких кровоизлияний в ткань мозга и субарахноидальное пространство. Наличие таких кровоизлияний не служит главным прогностическим критерием как в остром периоде, так и для дальнейшего нервно-психического развития. Поражения головного мозга обусловлены не только изменениями его в момент гипоксии, но и могут возникать в процессе реанимации ребенка, в постгипоксическом периоде, что в настоящее время обычно объясняют накоплением в крови и тканях избытка свободных радикалов и продуктов перекисного окисления липидов (кислородный парадокс — токсичность избытка кислорода после периода длительной гипоксии), протеолитических ферментов, ионов кальция в цитозоле нейронов и др. Отсюда вытекает опасность чрезмерно активной, неконтролируемой ок-сигенотерапии в неонатологии. Считается, что мозг новорожденных более устойчив к гипоксии, чем мозг взрослых, и поражения мозга в неонатальном периоде при гипоксии возникают только в структуре полиорганной недостаточности. Однако последствия перенесенной новорожденным гипоксии — прежде всего неврологические, а остальные функциональные системы, как правило, самовосстанавливаются. Синдром дезадаптации сердечно-сосудистой системы включает: Неонатальную легочную гипертензию и персистирование фетальных коммуникаций. Транзиторную дисфункцию миокарда с или без ишемических некрозов и сниженной, нормальной или даже повышенной сократительной функцией сердца. Расстройства ритма. Гипоксия поддерживает также высокое сопротивление в сосудах легких (легочная гипертензия), что наряду с артериальной гипотензией приводит к патологическому шунтированию (справа налево через артериальный проток и овальное отверстие; рис. 7.3). Факторами, усугубляющими, а иногда и определяющими тяжесть поражения головного мозга у ребенка, являются антенатальные нарушения. Патогенез асфиксии новорожденных, развивающейся на фоне хронической антенатальной гипоксии, представлен на схеме 7.2. Антенатальная хроническая гипоксия вызывает замедление темпов роста капилляров головного мозга, что приводит к увеличению объема цилиндра Крога (участок ткани головного мозга на один функционирующий капилляр). Как показали экспериментальные исследования, нарушение темпов роста и ветвления капилляров головного мозга у плода и новорожденного продолжается даже после окончания действия гипоксии. Вслед за гемодинамическими расстройствами наступают дегенеративные изменения паренхимы мозга и нейро-глии. У 2 0 — 2 5 % детей, родившихся в состоянии тяжелой сочетанной асфиксии, имеются пороки развития мозга. На заключительном этапе периода изгнания даже нормальных родов уменьшение в момент схваток плацентарного кровотока, увеличение потребления кислорода тканями плода приводят к существенному снижению РаОг в крови плода, в частности в пупочных артериях, что является одним из важнейших компонентов родового стресса. Однако здоровый ребенок не рождается в состоянии первичного апноэ, ибо у него при рождении нет бра-дикардии. Отсутствие же дыхания при рождении у здорового ребенка обусловлено, наиболее вероятно, самонаркозом, родовым катарсисом с избытком эндогенных эндорфинов (подробности — см. в гл. IV). Для ребенка же, подвергшегося перинатальной гипоксии, родовой стресс наступает в условиях уменьшения или даже исчерпания резервов адаптации, а отсюда он может родиться как в состоянии первичного, так и вторичного апноэ. Учитывая то, что неонатолог не может быть полностью уверен, какое апноэ имеется у ребенка — первичное или вторичное, всегда надо не терять времени на повторную стимуляцию активного дыхания внешними стимулами (шлепки,
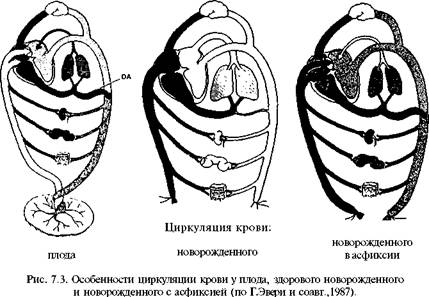
Циркуляция у плода. Оксигенированная кровь от плаценты течет по пупочной вене (незаштрихованный сосуд) в портальный синус печени (на рис. отсутствует), и часть крови достигает печени, а часть через венозный (аранциев) проток попадает в нижнюю полую вену, где соединяется с кровью, идущей от внутренних органов (на рис. — почки, кишечник, кожа). Около половины крови из нижней полой вены, попадая в правое предсердие через овальное отверстие, течет в левое предсердие, где смешивается с кровью из легочной вены. Относительно хорошо оксигенированная кровь (очень редкая штриховка) попадает в сердце, мозг и восходящую аорту. Другая половина крови из нижней полой вены смешивается с кровью из верхней полой вены и у ж е слабо оксигенирована (темный цвет), она попадает в левый желудочек. Из-за спазма легочных артериальных сосудов большая часть крови через открытый артериальный (боталлов) проток течет в нисходящую аорту, где она, конечно, менее оксигенирована (интенсивная штриховка), чем в восходящей аорте (разреженная штриховка). Циркуляция у здорового новорожденного. После расправления легких и перевязки пупочных сосудов легочный кровоток резко увеличивается, и из-за повышения системного давления и давления в левом предсердии межпредсердная перегородка захлопывает межпредсердное (овальное) отверстие (одновременно резко падает давление в правом предсердии). Сразу после рождения кровь протекает через артериальный проток слева направо. Однако через некоторое время давление в легочной артерии и аорте выравнивается и под влиянием повышения напряжения кислорода в крови тормозится синтез ва-зодилататорных простагландинов стенкой артериального протока и он спазмируется. Кровоток становится таким же, как и у взрослых. Циркуляция у новорожденных, родившихся в асфиксии. Расправление легких у рожденных в асфиксии неполное, сосудистое сопротивление в легких - высокое, легочный кровоток — низкий при нормальном количестве крови в легочной вене, кровоток через артериальный проток (справа налево) высокий, овальное отверстие открыто, ибо в левом предсердии давление ниже, чем в правом предсердии, и кровоток через отверстие идет также справа налево. Частично венозная кровь идет к мозгу из восходящей аорты. Кровь в нисходящей аорте также бедна кислородом. В целом кровоток напоминает кровоток плода.
щелчки по пятке и др.), а на первой же минуте жизни стремиться к ликвидации гипоксии у ребенка при помощи вспомогательного или искусственного дыхания. Важнейшим повреждающим фактором при асфиксии является гипоперфузия тканей, зависящая прежде всего от артериальной гипотонии и функционального состояния мозга и сердца. Если при острой интранатальной среднетяжелой асфиксии за счет сохранения ауторегуляторных способностей при умеренном снижении системного кровяного давления интенсивность мозгового кровотока не уменьшается за счет понижения сопротивления кровотоку в мозге, то у детей с тяжелой асфиксией, особенно после перенесенной длительной внутриутробной гипоксии, этого нет, и интенсивность мозгового кровотока всецело определяется системным давлением и КОС крови. Однако чрезмерно высокое артериальное давление, гиперволемия, могущие возникнуть, в частности, при очень активной жидкостной фармакотерапии, резко усиливает интенсивность мозгового кровотока и внутричерепное давление, способствуя этим развитию отека мозга и внутричерепных кровоизлияний. Считается, что у доношенных новорожденных надо поддерживать артериальное давление в пределах 5 0 — 5 5 мм рт.ст., а у глубоконедоношенных — в пределах 3 5 — 4 0 мм рт.ст. Другим фактором, который может обусловить гиперволемию, является чрезмерно активная секреция у части детей антидиуретического гормона (АДГ). Синдром избыточной секреции А Д Г проявляется олигурией, гипонатриемией, гиперволемией, гипоосмолярнос-тью плазмы, но повышением относительной плотности и осмолярности мочи. Это может провоцировать развитие отека мозга, судороги, мышечную гипотонию и гипорефлексию. Олигурия у детей с тяжелой гипоксией и шоком может быть, конечно, обусловлена и преренальной почечной недостаточностью, канальцевым некрозом, ДВС-синдромом с тромбозами сосудов почек (см. гл. XXII). Таким образом, тяжелая перинатальная гипоксия может вызывать множественные органные (или функциональных систем) дисфункции, которые можно обобщить следующим образом (табл. 7.2). Безусловно, одной из причин неврологических и дыхательных расстройств у детей, родившихся в асфиксии, могут быть повреждения спинного мозга, обусловленные как длительной внутриутробной гипоксией, так и травматизмом в родах. Что касается головного мозга, то считается, что острая интранатальная асфиксия приводит прежде всего к изменениям в парасагиттальных, корковых отделах, тогда как длительная острая или хирургическая гипоксия — к повреждениям в таламической области, стволовых, базальных отделах. Первая группа повреждений нередко проявляется в раннем неонатальном периоде симптомом слабых, вялых плеч, а вторая — глазной симптоматикой с расстройствами двигательной активности глазных яблок, приступами апноэ, гаспинг-дыха-нием, длительным сохранением потребности в ИВЛ, склонностью к летаргии, коме, позднему появлению сосательного рефлекса, более высокой потребностью в глюкозе. Подробнее о гипоксически-ишемической энцефалопатии — см. гл. XI. Классификация. В 1950 г. американский акушер Виржиния Алгар предложила шкалу клинической оценки состояния новорожденных через 1 и 5 минут после рождения (табл. 7.3). Здоровые новорожденные имеют оценку по шкале Алгар 7—10 баллов, т.е. у них могут быть акроцианоз, некоторое снижение мышечного тонуса и рефлекторной возбудимости за счет физиологичной для них централизации кровообращения при катехоламиновом и эндорфиновом всплеске в родах.
Общепринято, что если оценка по шкале Апгар через 5 мин не достигла 7 баллов, то ее проводят и фиксируют каждые следующие 5 мин до того момента, когда она достигнет 7 баллов и более. Динамическая оценка по шкале Апгар и ценный показатель для объективизации состояния ребенка при рождении — верификации эффективности медицинских мероприятий сразу после рождения, но она не имеет абсолютного значения как в диагностическом, так и в прогностическом плане по следующим соображениям: в настоящее время начинать реанимационные мероприятия (точнее, первичную медицинскую помощь) новорожденному принято уже на первой минуте жизни; 25-75% новорожденных со значительным ацидозом при рождении име ли нормальную оценку по шкале Апгар; оценка по шкале Алгар не корре лирует не только с выраженностью ацидоза при рождении, но и с други ми возможными метаболическими нарушениями (гипогликемия, гипо- кальциемия, гипераммониемия и др.), характером асфиксии (острая или развившаяся на фоне хронической внутриутробной гипоксии) и не по зволяет дифференцировать терапию; низкая оценка по шкале Апгар через 1 мин — не синоним асфиксии, так как она может быть следствием кардиореспираторной депрессии при рождении, что, однако, не сказывается на характере и времени реани мационных мероприятий при рождении ребенка; соответственно оцен ка по Апгар не должна быть единственным критерием диагностики ас фиксии; прогностическая значимость оценки по шкале Апгар через 1 и 5 мин не велика, но она существенно возрастает, если оценка 0—3 балла сохраняет ся на 10-й, 1 5 - й и 20-й минутах жизни (согласно обзору В.S.Carter и со- авт., 1993, у доношенных детей, имеющих оценку 0 — 3 балла через 1 мин, неонатальная смертность составляет 5,6%, тогда как при оценке 0 — 3 бал ла через 20 мин — 59%; при тех же временных интервалах у детей с очень низкой массой тела при рождении неонатальная смертность была соот ветственно 50% и 100%; по данным тех же авторов, частота развития в по следующем детского церебрального паралича у выживших доношенных детей при оценке по шкале Апгар 0 — 3 балла через 5 мин — 1 %, через 15 мин - 9%, через 20 мин - 57%). Оценка по шкале Апгар в Международной классификации болезней X пересмотра отсутствует как диагностический критерий асфиксии новорожденных, а критериями тяжелой асфиксии при рождении, согласно решению Американской академии педиатрии и колледжа акушеров (1994), являются: глубокий метаболический или смешанный ацидоз (рН менее 7,0 _) в крови пуповинной артерии; персистирование оценки по шкале Апгар 0—3 балла более 5 мин; доказанные полиорганные поражения: сердечно-сосудистой системы, легких, почек, ЖКТ, крови, т.е. полиорганная недостаточность. Таким образом, тяжелую асфиксию при рождении диагностируют, если у ребенка имеются признаки И, III стадий шока. Здесь есть известное противоречие, ибо мы не всегда можем быть убеждены, что шок у ребенка в асфиксии чисто гипоксический. В частности, нередко тяжелая асфиксия сочетается с кровопотерей плода (в кровоток матери, плаценту, к близнецу, при кровотечении вследствие отслойки плаценты). Кроме того, не всегда в родильном доме есть возможности для круглосуточного определения рН; даже в США они есть лишь в 15% родильных домов (Carter B.S. et al., 1993). Критериями диагностики тяжелой асфиксии являются: оценка по шкале Апгар через 5 мин — 3 балла и ниже; клинические признаки полиорганных поражений (хотя бы двух органов + резистентный к инотропным препаратам шок, т.е. длительность введения допамина и/или добутрекса при инфузионной терапии больше 1 часа на фоне адекватной ИВЛ и рациональной температурной защиты). Среднетяжелую асфиксию следует диагностировать: при наличии у ребенка оценки по шкале Апгар через 5 мин менее 6 бал лов + признаков шока II стадии, проявившихся в необходимости проведения ИВЛ, потребности в инфузионной терапии в сочетании с инотропами. И все-таки основными критериями тяжести асфиксии должны быть: ответ на адекватную терапию, течение и исход патологии в раннем неонатальном периоде, отражающие выраженность повреждения витальных функций. Таким образом, окончательно тяжесть асфиксии диагностируют не в родильной комнате, а по окончании раннего неонатального периода. При кардиореспираторной депрессии при рождении (особенно если причина ее очевидна) у ребенка без отчетливых проявлений другой патологии и гладком течении раннего неонатального периода необходимости ставить какой-либо диагноз нет. Необходимо различать при постановке диагноза острую асфиксию и асфиксию новорожденных на фоне хронической внутриутробной гипоксии, а также отмечать сопутствующие состояния и диагнозы, осложнения, потребовавшие направленной специфической терапии. Дата добавления: 2015-02-05 | Просмотры: 867 | Нарушение авторских прав |