|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
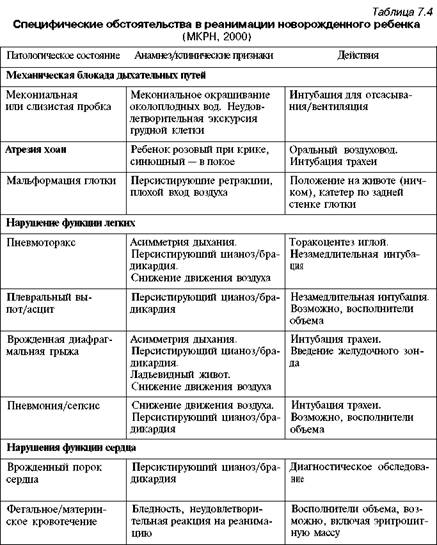
Дифференциальный диагноз. Дифференциальную диагностику у детей с асфиксией проводят с состояниями, вызывающими кардиореспираторную депрессиюДифференциальную диагностику у детей с асфиксией проводят с состояниями, вызывающими кардиореспираторную депрессию, а также с острыми кровопотерями (в том числе при травмах внутренних органов), внутричерепными кровоизлияниями, пороками развития мозга, с болезнями сердца, легких, внутричерепной родовой и спинальными травмами, диафрагмальной грыжей. При этом надо помнить, что нередко упомянутая патология может не только ассоциироваться или мимикрировать асфиксию, но и быть причиной ее. У переношенных детей с асфиксией особенно часты синдром аспирации мекония, родовые травмы, персистирующая легочная ги-пертензия и пневмоторакс, а у недоношенных — синдром дыхательных расстройств, внутричерепные кровоизлияния, синдром гипераммониемии. У доношенных и, особенно, переношенных детей, родившихся в кардиореспира-торной депрессии или в асфиксии средней тяжести особо обязателен скрининг на врожденный гипотиреоз. МКРН рекомендует руководствоваться следующим (табл. 7.4). Лечение. Асфиксия новорожденных — терминальное состояние, выведение из которого требует использования общепринятых реанимационных принципов, сформулированных П.Сафаром (1980) как ABC-реанимация, где: А — airway — освобождение и поддержание свободной проходимости воздухоносных путей; В — breath — дыхание, обеспечение вентиляции — искусственной (ИВЛ) или вспомогательной (ВВЛ); С — cordial, circulation — восстановление или поддержание сердечной деятельности и гемодинамики. Однако у новорожденных имеется ряд особенностей оказания реанимационного пособия в родильном зале, обусловленных как своеобразием реактивности организма этого периода жизни человека, так и тем, что подготовка к реанимации должна быть более активной и длительной, чем даже сам процесс оживления ребенка. Основные принципы оказания первичной помощи новорожденному при асфиксии и кардиореспираторной депрессии можно сформулировать так: 1) плановость, превентивность реанимационного пособия, что обеспечивается: готовностью персонала, готовностью места и оборудования, готовностью медикаментов;
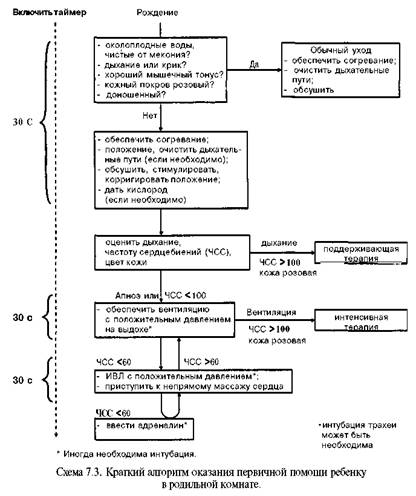
температурная защита новорожденного; не ожидать оценки по Апгар и оказывать реанимационное пособие уже на первой минуте жизни; ABC-реанимация, терапия шаг за шагом с обязательной обратной связью и оценкой эффективности каждого шага; асептика при проведении всех мероприятий; неврологическая направленность; стремление минимизировать медикаментозную терапию, избежать поли- прагмазии, применять препараты с очевидным клиническим эффектом; осторожное отношение к инфузионной терапии с медленным струйным/ введением растворов только при наличии специальных показаний (положительный симптом белого пятна как свидетельство гиповолемии, шок), а рутинное проведение инфузионной терапии только капельное или при помощи инфузионных насосов, равномерное в течение суток; стремление как можно раньше начать энтеральное питание и ограничение по возможности периода полного парентерального питания, но в то же время ребенок никогда не должен голодать или испытывать жажду, быть обезвожен; 1 0) мониторное наблюдение в постасфиктическом периоде (клиническое, аппаратное, лабораторное). До сих пор выхаживание новорожденных, в том числе и оказание им первой помощи в родильном зале, являются сочетанием знаний, умения, навыков и искусства врача оценить ребенка в целом, стремления к тому, чтобы ребенок чувствовал себя как можно более комфортабельно, удобно, выглядел хорошо. Готовность персонала. Оптимально, когда оказание первичной помощи новорожденному при асфиксии осуществляют два человека (неонатологи или неонатолог и акушер, неонатолог и реаниматолог или специально обученная медицинская сестра). Готовность персонала определяют следующие факторы: постоянный творческий контакт с акушерами и знание особенностей те чения беременности, родов, фармакотерапии матери, состояния плода во время беременности и родов; знание факторов высокого риска рождения ребенка в асфиксии или с кар- диореспираторной депрессией; освоение алгоритма помощи новорожденным при асфиксии (см. схему 7.3); владение практическими навыками оказания помощи новорожденному при асфиксии и работы с аппаратурой; контроль готовности оборудования, места, медикаментов; асептика при выполнении всех манипуляций и процедур. На схеме 7.3 представлен алгоритм помощи ребенку в родильной комнате согласно Международному консенсусу по реанимации новорожденных (2000). Готовность места оказания первичной помощи ребенку, родившемуся в асфик сии. Островок реанимации должен быть обустроен в родильном зале или около него и оборудован следующим образом. Апгар-таймер — включают в момент рождения для четкой регистрации прошедшего с момента рождения времени и оценки по шкале Апгар. Блок оптимизации окружающей среды и температурной защиты — столик (пеленальный), источник лучистого тепла, стерильные теплые пеленки, защитные экраны, колпаки. Блок восстановления проходимости дыхательных путей — устройство для отсоса (электроотсос, пневмонический, ножной, груша или др.), ораль ные воздуховоды, отсосные катетеры, эндотрахеальные трубки разных размеров, детский ларингоскоп. Блок оксигенотерапии — источник сжатого кислорода (баллон с редукто ром или централизованная система), дозиметры (обязательно с возмож ностью получения кислородно-воздушной смеси разных соотношений,
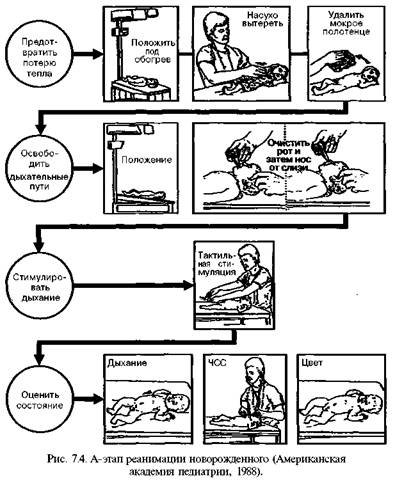
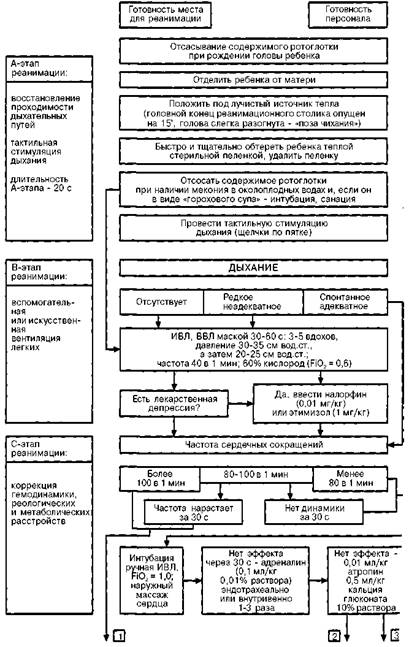
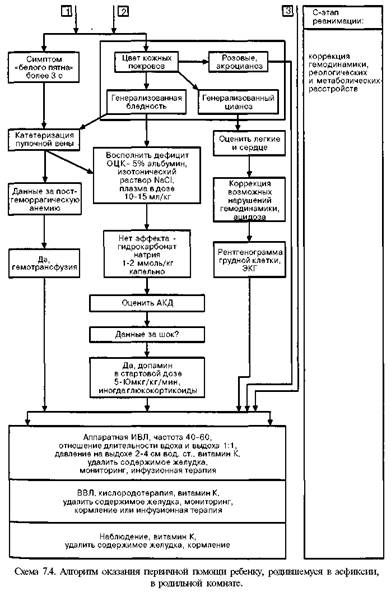
для чего оптимально иметь баллоны со сжатым воздухом), установка для увлажнения и подогрева воздушно-кислородной смеси, набор соединительных трубок и приспособлений для инсуффляции ребенку (тройник Аира, адаптер-маски разных размеров, воронка, головной колпак, набор соединительных трубок). Для надежной работы аппаратов давление в кислородной системе должно быть не менее 3 — 5 атм. Блок искусственной вентиляции легких — саморасправляющийся дыхательный мешок (типа Амбу, Лэрдал, Беннета и др.), системы Аира (Т-адаптер) Neo-Puff, аппарат для автоматической вентиляции легких типа Бэбилог II, Сикрест, MVP-10 и др. Блок медикаментозной терапии — одноразовые шприцы, перчатки, а так·? же инфузаторы (Линеомат и др.), наборы катетеров для пупочной вены, медикаментов (табл. 7.5). Блок контроля жизнедеятельности — кардиомонитор, транскутанный мониторинг уровня оксигемоглобина, аппарат для измерения артериального кровяного давления, секундомер, фонендоскоп. Контроль готовности места реанимации: комплектность оборудования и лекарственных препаратов; стерильность оборудования, материалов и медикаментов для ухода (с указанием даты стерилизации); контрольная проверка — освещения ларингоскопа, работы дозиметра, аппарата для ИВЛ; включение в электрическую сеть источника тепла, электроотсоса и аппарата для ИВЛ; подключение к кислородной системе дозиметра и аппарата ИВЛ. На схеме 7.4 представлен более детализированный (по сравнению со схемой 7.3) алгоритм оказания первичной помощи новорожденному в родильном зале, принятый в России. Α-шаг реанимации (I этап) (рис. 7.4) начинается с отсасывания катетером содержимого полости рта уже при появлении головы ребенка в родовых путях
(грудная клетка находится еще в родовых путях!), если околоплодные воды окрашены меконием. Отсасывание содержимого носовых ходов может провоцировать брадикардию, а потому эту процедуру надо производить осторожно, а у детей с брадикардией в родах вообще лучше от нее отказаться. Отрицательное давление при отсасывании не должно превышать 1 0 0 мм рт.ст. (13,3 кПа или 1 3 6 см вод. ст.). Новорожденные при наличии светлых околоплодных вод абсолютно не нуждаются в проведении отсасывания содержимого из ротовой полости, глотки, носа или желудка после рождения. Интенсивное отсасывание содержимого в подобных случаях, к сожалению, часто продолжает рутинно применяться при неосложненных родах и является основной причиной отсрочки начала спонтанного дыхания или, в случае первичного апноэ, приводит к отсрочке начала необходимой вспомогательной вентиляции.
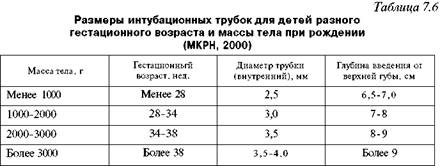
Сразу после появления ребенка из родовых путей надо включить Апгар-таймер! Согревание. Ребенка принимают в стерильные подогретые пеленки под источник лучистого тепла. Источник лучистого тепла мощностью около 400 Вт должен находиться на расстоянии 60 см от ребенка. Для предотвращения тепловых потерь новорожденным температура в родильной комнате должна быть не ниже 25°С, не должно быть сквозняков. Важно не допускать как снижения температуры тела ниже 36,5°С, так и перегревания, ибо оба состояния угнетают дыхание. У закричавшего ребенка в качестве источника тепла может быть использован контакт кожа к коже на животе матери. Пеленку после обтирания ребенка сразу удаляют и заменяют сухой. Если сразу после рождения ребенок не дышит, надо провести нежную, но активную тактильную стимуляцию — щелкнуть ребенка по подошве или энергично обтереть его спину. Пеленкой или марлей можно удалить секрет и из ротовой полости (МКРН). Околоплодные воды, слизь, иногда и материнскую кровь с кожи ребенка обтирают теплой стерильной пеленкой и сразу же ее удаляют (для предупреждения охлаждения). Все манипуляции реанимирующий врач и медицинская сестра или акушерка должны делать в перчатках (профилактика ВИЧ-инфицирования). Эти процедуры обычно неэффективны у детей с сочетанной (анте- и интра-натальной) среднетяжелой или тяжелой асфиксией (брадикардия, генерализованные резкая бледность или цианоз, указания на тяжелую гипоксию плода в родах), ибо такие дети рождаются уже с вторичным апноэ, поэтому тратить много времени на стимуляцию дыхания бесполезно — ребенок все равно самостоятельно задышать не сможет, необходима срочная доставка кислорода при помощи В В Л или ИВЛ. В таких случаях сразу после отсасывания из ротоглотки, или даже без этого, пережимают пуповину двумя зажимами Кохера и перерезают ее и ребенка быстро переносят на реанимационный столик под источник лучистого тепла. Положение ребенка. В положении ребенка на спине со слегка запрокинутой головой (поза для чихания), для чего подкладывают под плечи валик из пеленки толщиной примерно 2 см, проводят либо вновь, либо впервые отсасывание содержимого носоглотки, производят щелчок по подошве и начинают ВВЛ. В положении ребенка не должно быть как переразгибания, так и гиперфлексии головы, так как это нарушает проходимость верхних дыхательных путей. Многолетнее обсуждение вопроса об оптимальном сроке перевязки пуповины после рождения закончилось убеждением, что удоношенного ребенка, особенно имеющего факторы риска асфиксии или кардиореспираторной депрессии при рождении, перевязку надо делать сразу после рождения, ибо это облегчает все последующие манипуляции по оживлению и ускоряет их выполнение. Кроме того, плацентарная трансфузия при поздней перевязке пуповины обычно достигает около 20 мл/кг массы тела и затрудняет кардиореспиратор-ную адаптацию доношенного ребенка к условиям внеутробной жизни. У недоношенных детей, которым свойственны гиповолемия и артериальная гипотен-зия при рождении, плацентарная трансфузия улучшает адаптацию к условиям внеутробной жизни. Поэтому при преждевременных родах лучше отделение ребенка от матери (пережатие пуповины при еще не отделившейся плаценте) проводить через 1 мин (МКРН подтверждает эту рекомендацию), располагая его после рождения на одном уровне с матерью. Безусловно, это должно сопровождаться всеми перечисленными мероприятиями по температурной защите ребенка и обеспечению проходимости воздухоносных путей. За одну минуту обычно плацентарная трансфузия достигает 80% (через 15 с после рождения — 25%, через 30 с - 50%). В конце первого этапа реанимации, длительность которого не должна превышать 20—25 секунд, врач должен оценить дыхание ребенка. При появлении у него адекватного дыхания (после санации и стимуляции) следует сразу же определить частоту сердечных сокращений (ЧСС) и если она выше 100 уд./мин, а кожные покровы розовые (или с небольшим акроциано-зом) надо прекратить дальнейшие реанимационные мероприятия и организовать наблюдение (мониторинг) в последующие часы жизни. Парентерально нужно ввести витамин К (однократное введение), что необходимо сделать в родильной комнате всем детям, родившимся в асфиксии или с кардиореспира-торной депрессией. По возможности надо стремиться как можно раньше начать кормить ребенка молоком матери. Согласно рекомендациям МКРН (2000), если сразу после рождения ребенок (околоплодные воды которого окрашены меконием) не дышит или у него угнетено дыхание, частота его сердцебиений менее 100 в минуту или у него бедный мышечный тонус, или кожные покровы прокрашены меконием, необходимо прямое отсасывание трахеального содержимого и удаление мекония из воздухоносных путей. Таким образом, такого ребенка сразу после рождения, как правило, надо интубировать и начать ВВЛ или ИВЛ. Конечно, интубацию проводят после перевязки пуповины, обсушивания ребенка и переноса его на реанимационный столик под источник лучистого тепла. В то же время в этих же рекомендациях подчеркивается, что примерно 12% новорожденных рождаются с околоплодными водами, окрашенными мекони-ем. И если ребенок активен, начал самостоятельно дышать, то в активном отсасывании не только из трахей, но даже из ротоглотки никакой необходимости нет, это может лишь ухудшить состояние ребенка (ларингоспазм, брадикар-дия и др.). Если при наличии самостоятельного дыхания кожные покровы ребенка цианотичны, надо начать давать кислород через маску и, следя за динамикой цианоза, стремиться определить его причину. Наиболее часто общий цианоз обусловлен гемодинамическими нарушениями (сердечная недостаточность при врожденных пороках сердца, персистирующей фетальной циркуляции и др., артериальной гипотонии разной этиологии и др.), поражениями легких (массивная аспирация, внутриутробная пневмония, пневмоторакс, диафрагмальная грыжа, ателектазы, пороки развития легких, синдром дыхательных расстройств и др.), ацидозом. Поэтому на фоне кислородотерапии необходимы рентгенограмма грудной клетки, оценка КОС крови и гематокритного показателя. В-шаг реанимации (II этап), задачей которого является восстановление внешнего дыхания, вентиляция легких, ликвидация гипоксемии, проводят детям с отсутствием или с неэффективностью самостоятельного дыхания (редкое, наличие генерализованного цианоза или бледности и др.). Адекватная вентиляция — ключ к успешной неонатальной реанимации. Начинают этот этап с вентиляции при помощи маски (важен адекватный для ребенка размер маски, закрывающей нос и рот ребенка, но не давящей на глаза) и саморасправляющегося дыхательного мешка объемом 3 5 0 — 4 5 0 мл (Лэрдал, Амбу, хуже — Пенлон, Р Д А - 1 и др.) или проточно наполняющегося мешка, тщательно следя за давлением вдоха (первые 3 — 5 вдохов у доношенных детей с давлением 35—50 см вод. ст., ввиду того, что легкие только что родившегося ребенка еще содержат внутриутробную легочную жидкость, последующие — 2 0 — 2 5 см вод. ст.), для чего необходим манометр или предохранительный клапан, и экскурсиями грудной клетки. Маску (мертвое пространство маски должно быть менее 5 мл) надо держать большим пальцем и двумя пальцами левой руки и нежно, но плотно прижать. Другие два пальца левой руки используют для поддержки подбородка ребенка. Частота дыхания 4 0 — 6 0 в 1 мин — обычно адекватна. Всегда используют постоянное положительное давление. Приводим рекомендации МКРН (2000) из раздела Оксигенация и вентиляция: 100% кислород традиционно используют для ликвидации гипоксии. Хотя биохимические и предварительные клинические данные показывают возможность использования более низких концентраций кислорода в некоторых случаях, это недостаточно для изменения рекомендаций об использовании 1 0 0 % кислорода в тех случаях, когда требуется вспомогательная вентиляция. Если кислород недоступен, то вспомогательная вентиляция может быть проведена комнатным воздухом. Действительно, в конце 1990-х годов появился ряд работ, где показано, что эффективность реанимации с использованием комнатного воздуха не уступает по эффективности использованию для этой цели 100% кислорода. Однако указанные исследования не были рандомизированными и касались детей с массой более 1000 г. Более того, самими авторами акцентировалось, что в сравнительных группах оценка по шкале Апгар была через 1 минуту выше в группе оживляемых комнатным воздухом по сравнению с группой, для которой с этой целью использовали 1 0 0 % кислород (Saugstrat O.D. et al., 1998). Однако, как подчеркивалось в более ранних работах (о чем сказано выше), примерно 4—5% новорожденным в родильной комнате все же необходим кислород в более высокой концентрации, чем в комнатном воздухе. По-видимому, как свидетельствует наш опыт и данные литературы, детям с кардиореспираторной депрессией, не имеющим анамнестических данных для развития тяжелой анте- и/или интранатальной гипоксии, возможно, а может быть и гораздо более целесообразно, с учетом опасности высоких концентраций кислорода после периода даже кратковременной гипоксии, действительно проводить первичную масоч-но-мешковую реанимацию комнатным воздухом, но для этого надо иметь баллон со сжатым воздухом. Оптимальный поток воздушно-кислородной смеси — 5—8 л/мин. Хорошие экскурсии грудной клетки свидетельствуют о достаточной или даже избыточной вентиляции альвеол, а также об отсутствии у больного серьезных проблем, связанных с нарушением проходимости дыхательных путей и поражением легочной паренхимы. Подтвердить правильность интубации в клиниках 3-го уровня может определение СО2 в выдыхаемом воздухе (МКРН, 2000). Действия при неэффективной масочной вентиляции: Прервать вентиляцию. Отсосать содержимое из ротоглотки. Повторно правильно установить маску. Увеличить давление на вдохе до 50 см вод. ст. Увеличить длительность вдоха до 2 — 5 с. Важно следить и за растяжением живота и оценить, надо ли ставить назога-стральные или орогастральные трубки, что предотвращает также аспирацион-ный синдром при желудочно-пищеводно-глоточном рефлюксе. Однако надо помнить, что эта процедура может провоцировать брадикардию, а потому ее лучше проводить через 5 минут после рождения. Показания для эндотрахеальной интубации Данные, свидетельствующие о тяжелой аспирации мекония, — около плодные воды имеют вид горохового супа, т.е. содержат частички, ко мочки мекония, кожные покровы ребенка прокрашены меконием (если кожные покровы ребенка прокрашены меконием, то у 2 0 — 3 0 % детей да же при активной аспирации из ротоглотки и носа в родах мекония его в трахее остается много, и следует ожидать развития аспирационной пневмонии). Неэффективность 2-минутной вентиляции мешком и маской, на что ука зывает, в частности, отсутствие повышения ЧСС до более 1 0 0 уд./мин. Подозрение на обструкцию воздухоносных путей (западение языка и нижней челюсти, обструкция носовых ходов и носоглотки, чрезмерное переразгибание шеи, зоб, пороки развития). Брадикардия (ЧСС менее 60 через 30 с после начала ВВЛ и необходимость наружного массажа сердца). Необходимость длительной дыхательной поддержки (диафрагмальная грыжа, СДР I типа — болезнь гиалиновых мембран, атрезия хоан, синдромы утечки воздуха, врожденная пневмония, стрептококковый В сепсис и др.). Гестационный возраст менее 28 нед., ибо этим детям, как правило, вводят сурфактант из-за высокой вероятности его дефицита и развития СДР I типа. Шок любой этиологии (постгеморрагический и др.). Интубацию трахеи проводят при помощи ларингоскопа в течение не более чем 20 с, и если она не удалась, то надо вновь вернуться к ИВЛ при помощи маски и мешка, а после ликвидации или резкого уменьшения гипоксемии повторить попытку интубации. Важно не паниковать! Размеры интубационных трубок — см. в таблице 7.6. Нижний конец эндотрахеальной трубки должен располагаться над бифуркацией трахеи, т.е. на уровне II грудного позвонка. Катетер для отсасывания должен иметь Т-образный коннектор или отверстие в проксимальном конце в целях контроля уровня отрицательного давления, которое не должно превышать 1 0 0 мм рт. или 37 см вод. ст. Параметры ИВЛ обычно следующие: частота дыхания — около 40 (большая частота обычно нужна недоношенным, детям с жесткими легкими, при бра-дикардии, отеке легких), давление на вдохе — около 2 0 — 2 5 см вод. с т., а на выдохе — 2 — 4 см вод. ст., соотношение вдох-выдох — 1: 1 в начале и далее 1: 2.
Через 2 0 — 3 0 секунд после начала И В Л (в том числе и маской, и мешком) необходимо подсчитать частоту сердечных сокращений (за 6 секунд и полученную величину умножить на 10). В ситуации, когда ЧСС находится в пределах 80—100 в минуту, продолжают ИВЛ до тех пор, пока ЧСС не возрастет до 100 в минуту. С-шаг (III этап реанимации) — терапия гемодинамических и метаболических расстройств. При зарегистрированном отсутствии сердечных сокращений у ребенка при регистрации непосредственно перед рождением или ЧСС менее 60 в минуту необходимо срочно начать наружный массаж сердца на фоне ВВЛ маской со 100% концентрацией кислорода. Если в течение 30 с массажа на фоне В В Л эффекта нет — интубировать и начать аппаратную И В Л в сочетании с массажем. Наружный массаж сердца. Надавливают двумя пальцами на нижнюю треть грудины (чуть ниже линии, соединяющей соски, но не на мечевидный отросток из-за опасности разрыва печени!) строго вниз на 1, 5 — 2, 0 см (примерно 1 / 3 переднезаднего размера грудной клетки) с частотой 90 раз в минуту, координируя с частотой В В Л или ИВЛ (по МКРН, 2000, соотношение должно быть 3:1). При эффективном непрямом массаже сердца должен регистрироваться пульс на плечевой или бедренной артерии. Наружный массаж сердца может быть прекращен при появлении самостоятельных сердечных сокращений с частотой более 60 в минуту. Если в течение 30 секунд адекватной вентиляции и массажа сердца эффект отсутствует, то следует стимулировать сердечную деятельность 0,01% раствором (!) адреналина, который вводят в дозе 0,1 мл/кг массы тела (0,01—0,03 мг/кг) либо эндотрахеально, либо в вену пуповины. Вводимое количество раствора адреналина разводят равным количеством изотонического раствора натрия хлорида. Введение можно повторить через 5 мин (до 3 раз), но уже только внутривенно (полагают, что из легких с нарушенным кровоснабжением и оксигенаци-ей всасывание адреналина минимально). Одновременно продолжают ИВЛ и непрямой массаж сердца. Инфузионная терапия. Вслед за этим катетеризируют пупочную вену (длина пупочного венозного катетера равна расстоянию от плеча до пупка — 5 см, кончик катетера должен находиться между диафрагмой и правым предсердием), измеряют центральное венозное и артериальное кровяное давление, оценивают цвет кожных покровов и состояние микроциркуляции (симптом белого пятна). Периферические вены (головы или конечностей) также могут быть использованы, но обычно в них труднее заводить катетер. МКРН (2000) допускает в случае трудности венозного доступа проводить инфузионную терапию, в порядке исключения, интраоссально. При симптоме белого пятна (исчезновение после надавливания пальцем врача) 3 секунды и более, являющемся признаком гиповолемии, надо ввести волемические препараты (кристаллоиды — изотонический раствор натрия хлорида, раствор Рингера; 5% альбумин, кровь) в дозе 10 мл/кг массы тела. Кровь (точнее, эритроцитную массу!) вводят только при установленной постгеморрагической анемии (отслойка плаценты, фетоматеринская и фетофетальные трансфузии и др.). Вливания альбумина не имеют преимуществ перед кристаллоидами, но увеличивают риск развития инфекционных болезней, и применение его ассоциируется с увеличением риска смертности (МКРН, 2000). Гидрокарбонат натрия. Если через 4 — 5 минут после начала ИВЛ ребенок бледен или цианотичен либо у него брадикардия, то вероятен метаболический ацидоз, и можно ввести натрия гидрокарбонат в дозе 1 — 2 ммоль/кг (2 — 4 мл 4,2% раствора натрия гидрокарбоната на 1 кг массы тела). И все же у подавляющего большинства новорожденных с асфиксией патологический ацидоз ликвидируется на фоне адекватной вентиляции легких, и потому в родильной комнате редко следует вводить гидрокарбонат натрия и оптимально его использовать после лабораторного контроля КОС. При уровне рН 6, 8 — 6, 9 механизм анаэробного гликолиза блокируется, и продукция энергии прекращается. рН 6,7 не совместим с последующей нормальной жизнью. Еще раз подчеркнем, что гидрокарбонат натрия надо вводить лишь после налаживания адекватной вентиляции, ибо при ее отсутствии введение гиперосмолярного раствора гидрокарбоната натрия может привести к гиперосмолярности крови, возрастанию Рсо2 крови, что может приводить к повреждению функции клеток ЦНС и миокарда, повышает риск внутричерепных кровоизлияний. Конечно, надо помнить, что выраженная бледность кожных покровов новорожденного может быть также признаком низкого сердечного выброса, тяжелой анемии, гиповолемии, гипотермии, а не только ацидоза, и соответственно дифференцировать эти состояния. Выраженная артериальная гипотония со стойкой олигурией — показание для капельного назначения допамина в стартовой дозе 3 — 5 мкг/кг/мин. Налоксона гидрохлорид — антагонист наркотиков, применяющийся для снятия респираторной депрессии у детей, матери которых получили наркотики за 4 часа до родов. Установление и поддержание адекватной вентиляции всегда должно предшествовать введению налорфина. Рекомендуемую дозу налоксона 0,1 мг/кг можно вводить эндотрахеально, внутривенно или, если перфузия тканей адекватна, внутримышечно, подкожно. Иногда при повторных апноэ на-локсон вводят повторно. Налоксон не вводят детям матерей, недавно перенесших синдром отмены наркотиков, ибо это может провоцировать развитие синдрома отмены у ребенка (МКРН, 2000). В России в некоторых стационарах предпочитают вместо налорфина вводить этимизол (1 мг/кг). Введение налор-фина явно предпочтительнее, ибо на фоне сохраняющейся гипоксемии этими-зол может способствовать развитию повреждений миокарда. Оптимально начинать плановую инфузионную терапию при ее необходимости через 4 0 — 5 0 минут после рождения. Обычный объем инфузионной терапии в первые сутки жизни — около 6 0 — 6 5 мл/кг/сут. (у недоношенных менее 7 5 0 г при рождении объем может быть увеличен до 100—150 мл/кг, но при сердечной недостаточности, отечных легких сокращен до 50 мл/кг). Очень важно помнить, что гораздо более важен темп инфузионной терапии, чем объем. В первые сутки жизни инфузируемый раствор — обычно 5—10% глюкоза, на вторые сутки начинают добавлять электролизы. Характер и темп инфузионной терапии во многом зависят от результатов мониторинга за основными клинико-ла-бораторными параметрами. Дети, родившиеся в тяжелой асфиксии, обычно требуют продленной И В Л или В В Л в течение суток и более. Врачебная тактика при осложнениях изложена в соответствующих разделах учебника. Тактика ИВЛ и других видов респираторной терапии изложена выше. Лечение детей, перенесших асфиксию, особенно на фоне неблагоприятного течения беременности, должно быть этапным: отделение патологии новорожденных родильного дома, отделение патологии новорожденных детской больницы, отделение реабилитации для новорожденных с поражением ЦНС. В случае очень тяжелого состояния после проведения первичной реанимации и медленного восстановления жизненно важных функций необходим перевод в отделение реанимации новорожденных детской больницы. Необходимо помнить, что повреждения мозга у детей, родившихся в асфиксии, развиваются не только в момент тяжелой гипоксии, но и в постасфиксическом периоде, и потому необходимо этапное лечение гипоксически-ишемической энцефалопатии. Дата добавления: 2015-02-05 | Просмотры: 995 | Нарушение авторских прав |