|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Физиология старения сердечно-сосудистой, бронхолегочной, мочевыделительной, центральной нервной систем, желудочно-кишечного тракта, опорно-двигательного аппарата.
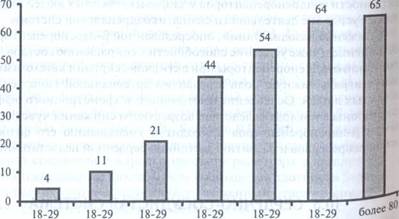
По мере старения происходят постепенные и малозаметные изменения в структуре и функциях различных систем. Эти снижения резервных возможностей функциональных систем приближаются к порогу дисфункции, и до тех пор, пока организм не подвергся существенному стрессорному воздействию, гомеостатические механизмы могут справляться с минимальными колебаниями. В ряде случаев срыв адаптационных возможностей в результате стрессорного воздействия приводит к развитию заболеваний. Вместе с тем, даже у очень старых людей сокращение резервных возможностей функциональных систем не является неизбежным и может варьировать весьма широко по величине резервов, способности адаптации к внутренним и внешним стрессорным факторам. Старение характеризуется изменениями ряда физиологических показателей организма. Наиболее выраженными и типичными является следующие изменения, по сравнению с уровнем этих показателей в 30 лет (100%): - снижение скорости проведения нервных импульсов на 5%; - снижение уровня основного обмена — на 18%; - снижение содержания воды в организме — на 20%; - снижение сердечного выброса — на 30%; - снижение СКФ - на 32%; - снижение почечного кровотока на 50%; - снижение максимальной емкости легких на 60%; - снижение максимального потребления кислорода на 63%; - снижение массы мозга на 45%; - снижение количества гломерулярных клубочков — на 45%; - снижение массы тела — на 15% и др. Вместе с тем, возрастные изменения в органах и системах организма могут развиваться с разной скоростью. Так, в костной системе они проявляются рано, но протекают медленно, в то время как в некоторых структурах ЦНС они долго не обнаруживаются, но впоследствии развиваются очень быстро. Различные методы исследования, благодаря своей способности количественно выражать величину того или иного параметра, могут выявлять изменения показателей, имеющих отношение к функциональным и регуляторным характеристикам органов и систем у пожилых людей, и тем самым помогать в установлении БВ конкретного человека и ведущих патогенетических механизмов преждевременного старения. По мере старения наиболее выраженные изменения происходят в артериях. Уже к 30-40 годам в их стенках на 5—10% уменьшается содержание эластина и начинается их кальциноз, который особенно выраженным после 60—65 лет жизни. Следствием этих процессов являются постепенное уменьшение эластичности артерий, снижение их приспособительных возможностей к расширению и сужению, ослабляется кровоток. Обычно эти изменения наиболее выражены в аорте, крупных артериях и в артериях нижних конечностей. В венах, увеличивается площадь поперечного сечения, их извилистость. Возрастные изменения затрагивают и сеть капилляров. Так, число рабочих капилляров на 1 мм2 ногтевого ложа уменьшается примерно в 1,5 раза. На нижних конечностях обнаруживают безкапиллярные зоны. В результате происходит ухудшение кровоснабжения ведущих функциональных систем и органов — мозг, мышцы, внутренние органы, что приводит к развитию быстрой утомляемости у пожилых и старых людей и повышению АД. Так, к 60 годам систолическое АД в среднем возрастает до 140 мм рт. ст., а диастолическое — до 90 мм рт. ст. Превалирование артериальной гипертензии (систолическое АД>140 мм рт. ст., диастолическое>90 мм рт. ст.) в зависимости от возраста, представлено на рис. 5.
Возраст, лет
Рис. 5. Превалирование артериальной гипертензии в зависимости от возраста
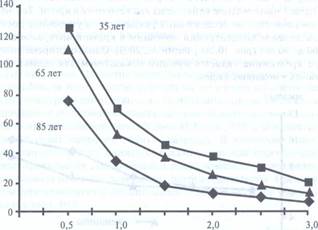
В связи с возрастными изменениями в крупных сосудах сердце затрачивает больше энергии на обеспечение кровообращения. Помимо этого страдает кровоснабжение и самой сердечной мышцы - миокарде, следствием чего являются склеротические изменения в ней. Эти изменения также начинаются в возрасте 30 лет и становятся особенно выраженными, после 40 лет. В старческом возрасте нередко выявляют расширение полостей сердца и ослабление его резервных и функциональных возможностей, уменьшается сократительная способность миокарда, он прорастает соединительной тканью. Возрастные изменения сердечно-сосудистой системы суживают ее функциональные и приспособительные возможности. Увеличение емкости сосудистого русла на ряду с возрастным снижением сердечного выброса приводит к увеличению времени общего кругооборота крови — от 45,0-50,5 с у лиц в возрасте 20-39 лет до 57,5—64,0 с у 60-69-летних, а в возрасте 70-79 лет время кругооборота крови составляет уже 62,0—68,5 с. С возрастом вследствие склеротических изменений в сердечной мышце проводимость возбуждения в миокарде ухудшается. Нагрузка на сердце, сопровождающаяся повышением частоты сердечных сокращений и выраженными изменениями метаболизма, способствует частому возникновению атриовентрикулярной блокады. Эта проблема по мере старения усугубляется возрастным снижением лабильности атриовентрикулярного узла и пучка Гиса. У пожилых людей постепенно уменьшается количество клеток, осуществляющих функцию автоматизма в синоатриальном узле. Это происходит медленно в среднем возрасте и более выраженно - после 60 лет. У людей старше 75 лет синоатриальный узел может содержат менее 10% нормального количества таких клеток. После 60 лет уменьшается количество волокон в левой ветви пучка Гиса, вследствие замещения их фиброзной тканью. При старении снижается нейрогуморальный контроль над кровообращением, ослабляются рефлексы с механорецепторов сердца и сосудов, развивается циркуляторная гипоксия, которая, присоединяясь к тканевой гипоксии, становится важным вторичным механизмом старения. Сердечно-сосудистые заболевания являются основной причиной смерти пожилых людей. Коронарный атеросклероз с клиническими проявлениями и без них имеет место у большинства пожилых людей. Анатомические изменения в органах сердечно-сосудистой системы включают в себя фиброз, кальциноз и отложения липофусцина, амилоида и ХС в артерии, артериолы, миокард и его структуры (оболочки, клапаны). Важнейшую роль в возникновении и прогрессировании этих изменений по мере старения играют нарушения липидного обмена. Большой спектр лабораторных тестов используется почти исключительно для мониторинга патологических последствий атеросклеротических поражений сердечно-сосудистой системы (например, исследование ферментов для диагностики и определения прогноза инфаркта миокарда). Однако возрастные изменения этих показателей имеют свои определенные закономерности, которые необходимо учитывать при диагностике заболеваний, а также использовать для оценки БВ. Согласно результатам различных исследований установлено, что активность КК у женщин на 15-20% ниже, чем у мужчин во всех возрастных группах. Более того, после 60 лет у женщин активность снижается на 2% (идет параллельно со снижением костной массы, общей массы тела и физической активности), а у мужчин на 7% (за счет снижения мышечной массы и активности КК в миокарде). Еще более выраженное снижение активности КК отмечается после 90 лет, при этом активность КК-МВ снижается так сильно, что ее не удается обнаружить. С возрастом у мужчин и женщин отмечается незначительное увеличение активности ЛДГ (у лиц старше 60 лет активность ЛДГ повышена на 10%). Несколько изменяется спектр изоферментов ЛДГ за счет снижения изофермента ЛДГ 5. У ослабленных пожилых людей активность этих ферментов снижена, и даже при инфаркте миокарда активность КК может оставаться в пределах референтных величин. Активность АсАТ с возрастом изменяется незначительно. По мере старения постепенно снижаются легочные резервы. Обусловлено это, прежде всего, происходящими со временем денеративно-дистрофическими процессами в костно-мышечном каркасе грудной клетки после 60 лет: снижением эластичности соединительной и мышечной ткани, появлением очагов обызвествления в реберных хрящах, возникновением остеопороза ребер, ограничением подвижности реберно-позвоночных сочленений. В межреберных мышцах уменьшается содержание белка, формируются жировые отложения и соединительная ткань. В результате этих процессов увеличивается ригидность грудной клетки (легкие легче расширяются, а способность к спадению снижается), следствием чего является снижение жизненной емкости легких, форсированной жизненной емкости и объема форсированного выдоха в секунду. Возрастные изменения происходят в бронхиальном дереве, соединительной ткани легких и альвеолах. Первоначальная инфильтрация лимфоидными и плазматическими клетками соединительной и мышечной ткани бронхиального дерева в дальнейшем приводит к развитию атрофии и склерозированию ткани бронхов. Поэтому в пожилом и старческом возрасте объемно-скоростные величины воздушного потока в воздухопроводящей системе легких снижаются. В соединительной ткани легких развиваются явления дегидратации, обусловливающей утрату волокнами фибриллярности и упругости, а отложение солей кальция усиливает ригидность и снижает растяжимость легочной ткани. В результате подвижность легочных краев и экскурсия купола диафрагмы в период между 60 и 90 годами жизни уменьшаются на 1—1,5 см, что снижает величину жизненной емкости легких. Базальная мембрана аэрогематического барьера увеличивается с 1—1,5 мкм (40—49 лет) до 3—4 мкм (в 70 лет). Стенки альвеол неравномерно утолщаются, а прорастающие в них коллагеновые волокна, заполняя альвеолы, формируют зоны склероза. Изменения эластичности грудной клетки и легких приводят к нарушению нормального соотношения между легочной вентиляцией и перфузией, с одновременным увеличением объема физиологического мертвого пространства. Увеличение аэрогематического барьера дополнительно препятствует диффузии газов из альвеол в кровь, в результате не только снижается насыщение крови кислородом, но и повышается содержание СО2. Так артериальное рО2 снижается приблизительно на 5% каждые 15 лет, начиная с 30-летнего возраста, а рСО2 возрастает приблизительно на 2% каждые 10 лет после 50-летнего возраста. К 85-90 годам масса легочной ткани уменьшается в среднем на 23% относительно 65-85 лет. Возрастные изменения в альвеолярно-капиллярной мембране и базальной мембране приводят к замедлению диффузии кислорода из вдыхаемого воздуха в кровь в результате альвеолярно-артериальная разница напряжения O2 с возрастом увеличивается. У здоровых молодых людей при дыхании воздухом эта разница составляет 10—15 мм рт.ст, а у лиц старше 70 лет может достигать 30 мм рт.ст. Снижение парциального давления кислорода и альвеолярно-артериальной разницы в напряжении О2, казалось бы должны вызывать определенные клинические проявления (гипоксия), однако этого не происходит, т. к. по мере старения снижается и потребление О2. Это обусловлено тем, что у пожилых людей снижается мышечная масса, Интенсивность метаболизма в органах и системах. В процессе онтогенеза примерно в 3 раза сокращается функциональный резерв системы дыхания. Если максимальная вентиляция легких у лиц среднего возраста составляет 85—87 л/мин, то у лиц 80-89 лет — 52 л/мин. Возрастные изменения в респираторной системе сопровождаются формированием целого ряда компенсаторно-приспособительных механизмов. Оптимальный уровень регуляции дыхания поддерживается за счет повышения чувствительности периферических хеморецепторов к гипоксии, нейронных структур гипоталамуса к адреналину и ацетилхолину, в результате чего происходит учащение дыхания. Поэтому минутный объем дыхания у пожилых людей поддерживается практически на том же уровне, что и молодом возрасте. Важными структурными компонентами приспособительных процессов в дыхательной системе при старении является гипертрофия мышечно-эластического аппарата респираторной части легкого, которая способствует сохранению упругости эластических свойств легочной ткани. Еще одним адаптивным механизмом оптимального кислородного обеспечения тканей у пожилых людей служит сдвиг кривой диссоциации оксигемоглобина вправо, обусловленный в основном увеличением содержания в эритроцитах 2,3-дифосфоглицерата. У пожилых людей выявляется уменьшение почечного кровотока, СКФ и клиренса эндогенного креатинина. Анатомические изменения включают прогрессирующую потерю почечной массы, в первую очередь коркового слоя. Если почки среднего 40-летнего мужчины весят около 250 г, то к 80 годам — 200 г. Общее число функционирующих гломерулярных клубочков резко сокращается пропорционально изменениям массы почки. При гистологическом исследовании выявляют увеличение количества склерозированных гломерулярных клубочков. К 40 годам склерозируется 5% гломерул, а к 80 годам - 40%. Факторами, принимающими участие в формировании этих изменений, являются генерализованный атеросклероз, артериальная гипертензия и потребление большого количества белка в течение всей жизни. Дегенеративные изменения в гломерулах и сокращение числа гломерулярных капиллярных пучков в кортикальном слое почки ведут к атрофии приводящих и отводящих артериол. Почечный кровоток снижается в процессе старения приблизительно на 10% в десятилетие после 30 лет, так что к 90 годам составляет приблизительно 300 мл/ мин, или около 50% по сравнению с молодым возрастом. Уменьшение почечной перфузии наиболее выражено во внешнем корковом слое почки и минимально в мозговом. По мере снижения функционирующих гломерулярных клубочков оставшиеся здоровые подвергаются гиперфильтрации и гиперперфузии. Через некоторое время эти процессы приводят к повреждению структуры и нарушению функции гломерул. Для процесса старения специфичным является то, что эти изменения приводят к уменьшению СКФ. Функциональные изменения в различных отделах нефрона у лиц пожилого возраста приведены ниже. Гломерулярные клубочки: • уменьшение СКФ; • снижение почечного кровотока. Проксимальный каналец: • снижение реабсорбции фосфатов; • снижение максимальной экскреции глюкозы. Дистальный каналец: • неспособность максимально экскретировать кислоты; • нарушенная способность к разведению мочи; • сниженная способность к максимальному концентрированию мочи; • нарушение задержки натрия. У взрослых СКФ остается стабильной до 35 лет, затем постепенно и неуклонно снижается к 65 годам. После 65 лет заметно снижается клиренс эндогенного креатинина, что обусловлено значительны изменением СКФ, и в меньшей степени нарушением секреции и реабсорбции. Влияние возраста на клиренс эндогенного креатинина представлено на рис. 6.
СКФ, мл/мин/1,73 м2
Возраст (годы)
Рис. 6. Зависимость клиренса эндогенного креатинина от возраста
В настоящее время установлено, что СКФ после 40 лет снижается на 1% в год (приблизительно на 0,8 мл/мин/1,73 м2 в год). У здорового 80-летнего человека СКФ составляет только 1/2—1/3 фильтрации 30 летнего. Эндогенным источником креатинина в организме являются мышцы, поэтому креатинин экскретируется в кровь с относительно постоянной скоростью, которая пропорциональна мышечной массе человека. С возрастом мышечная масса и клиренс эндогенного креатинина снижаются. Суммарным эффектом является то, что концентрация креатинина в сыворотке крови остается постоянной даже когда истинная СКФ и клиренс креатинина снижены. Поэтому у пожилых людей существенное снижение СКФ может маскироваться относительно нормальным уровнем креатинина в сыворотке крови. Зависимость клиренса эндогенного креатинина и концентрации креатинина в сыворотке крови улиц разного возраста представлены на рис. 7.
Клиренс эндогенного креатинина, мл/мин
Концентрация креатинина в сыворотке, мг/дл
Рис. 7. Зависимость клиренса эндогенного креатинина и концентрации креатинина в сыворотке крови улиц разного возраста
В связи с представленными закономерностями у пожилого пациента оценка функции почек не должна основываться только на определении концентрации креатинина в сыворотке крови. Для адекватной оценки функции почек необходимо учитывать ряд факторов: возраст, массу тела, пол. Они должны использоваться для расчета СКФ по следующей формуле (для женщин результат дополнительно должен быть умножен на 0,85): СКФ (мл/мин)= (140 — возраст) • масса тела (кг)/72 • креатинин сыворотки (мг/дл) Диапазон нормальных величин уровня мочевины в крови довольно широк в любом возрасте. Скорость метаболизма белков также оказывает значительное влияние на его величину в крови. Тем не менее, многочисленные исследования указывают на умеренное постоянное увеличение концентрации мочевины в крови в интервале возраста с 60 до 90 лет. Хотя наиболее значительные морфологические и функциональные изменения наблюдаются со стороны гломерулярных клубочков, тем не менее, структурные и функциональные возрастные изменения претерпевает и канальцевый аппарат нефрона. Уменьшение длины и объема проксимальных канальцев влияет на тубулярный транспорт различных веществ. Одним из возможных проявлений нарушения функции канальцев почек (реабсорбции) является снижение уровня мочевой кислоты в крови (особенно у женщин) в течение 8-го десятилетия жизни. Имеются сообщения о небольшом увеличении в моче содержания альбумина и глюкозы. Но более значимым, является увеличение с возрастом почечного порога для глюкозы (в норме он равен 180 мг% - 10 ммоль/л), который у пожилых людей может составлять выше 300 мг% (16,6 ммоль/л), прежде чем появится глюкозурия. Поэтому у пожилых людей проведение исследования мочи на глюкозу для диагностики СД неэффективно. Рассчитывать необходимую дозу инсулина по содержанию глюкозы в моче нельзя. Более существенные изменения претерпевают резервные возможности функции почек. Особенно наглядно эти изменения проявляются в неспособности почек быстро отвечать на изменения в количестве жидкости и электролитов в организме. Приблизительно на 5% каждые 10 лет, начиная с 50-летнего возраста, снижается максимальная концентрационная способность почек. Отмечается удлиненный ответ почек на водную нагрузку. В конечном итоге, старение сопровождается снижением адаптационной способности почек, что проявляется замедлением и сокращением по своей величине (диапазону) ответной реакции на нагрузочные тесты. Средние величины для некоторых функций почек у 40 и 80-летних мужчин приведены в табл. 1.
Таблица 1. Средние величины для некоторых функций почек у 40 и 80-летних мужчин
С возрастом развивается снижение почечной чувствительности к АДГ, что возможно служит одной из причин возрастного увеличения секреции данного гормона. Возрастные уменьшения почечного кровотока и гломерулярной фильтрации, а также заболевания, сопровождающиеся развитием вторичного гиперальдостеронизма, типа застойной сердечной недостаточности, цирроза печени, или нефротического синдрома, могут приводить к задержке натрия у людей пожилого возраста и сопровождаться водной перегрузкой организма. Наряду с задержкой натрия у пожилых людей может регистрироваться и его потеря через почки. М. Epstein и N.K. Hollenberg (1976) показали, что почечный ответ на ограничение соли с возрастом становится все более вялым. Ограничение потребления натрия до 10 мэкв в день сопровождается различным периодом для снижения полувы- ведения натрия с мочой — 17,6 ч — у молодых лиц и 30,9 ч — у старых людей. Эти данные говорят о том, что по мере старения почки все более склонны к потере натрия. Механизмы, лежащие в основе этой тенденции носят мультифакториальный характер и связаны с возрастными изменениями в секреции атриального натрийуретического пептида, деятельности ренин-ангиотензин-альдостероновой системы и функции почечных канальцев. С возрастом снижается эндокринная функция почек. В первую очередь это касается нарушения синтеза гормональной формы витамина D - кальцитриола, что приводит к нарушению всасывания кальция в кишечнике. Снижается как базальный, так и стимулированный уровень ренина, сопровождающийся постепенным падением секреции альдостерона. Урогенитальные расстройства (УГР) являются превалирующими последствиями менопаузы. Их имеют около 50% всех перименопаузальных женщин. Атрофический вагинит одно из наиболее частых проявлений урогенитальных нарушений. Золотым стандартом в диагностике атрофического вагинита служит цитогормональный анализ вагинального эпителия, однако наиболее простым и доступным методом диагностики недостаточности эстрогенов является измерение вагинального pH. У пременопаузальных женщин эстрогены способствуют образованию колоний лактобактерий, которые производят молочную кислоту из вагинального гликогена и тем самым поддерживают низкие значения pH. После менопаузы, когда количество лактобактерий во влагалище резко снижается, pH возрастает, что может служить диагностическим признаком дефицита эстрогенов. Болезненное, частое или неполное мочеиспускание является проблемой многих пожилых людей. Стрессовое недержание мочи характеризуется потерей мочи при изменении внутрибрюшного давления (кашель, чихание, смех). К истинному недержанию мочи при напряжении у женщин в постменопаузе могут присоединиться или развиться самостоятельно симптомы гиперактивного мочевого пузыря. Причины, вызывающие урогенитальные расстройства у женщин по мере старения многообразны. К ним относятся инфекции, воспаления парауретральных желез, авитаминоз, аллергия, психические заболевания и т.д. Дефицит эстрогенов является лишь одной из этих причин, но очень важной. Клинически урогенитальные расстройства проявляются симптомами атрофического вагинита и цистоуретрита с нарушением контроля мочеиспускания или без него. Основными из этих симптомов являются: - поллакиурия — учащение позывов к мочеиспусканию в течение дня (более 4—5 эпизодов мочеиспускания в день) с выделением при каждом мочеиспускании небольшого количества мочи; - цисталгия — учащенное, болезненное мочеиспускание, сопровождающееся чувством жжения в течение дня, часто ощущаются боли в области мочевого пузыря и рези в уретре при мочеиспускании (это ощущение может исчезать при переключении внимания); - никтурия — учащение позывов к мочеиспусканию в ночное время (более одного эпизода мочеиспускания за ночь). Термин «никтурия» используется для обозначения любых пробуждений во время сна, после которых происходит мочеиспускание, в т. ч. и связанных с возрастными изменениями в циркадной структуре сна. Основной причиной никтурии у женщин с урогенитальными расстройствами (УГР) является дефицит эстрогенов, поэтому в пери- и постменопаузе частота и тяжесть УГР нарастают. Одновременно с возрастным усугублением УГР, никтурия влечет за собой структурное нарушение сна и сонливость в дневное время, которые вместе с частыми пробуждениями ночью предрасполагают к падениям, травмам и переломам, особенно при остеопорозе. Для лиц старше 60 лет характерно смещение диуреза ото дня к ночи, что связывают с нарушением секреции антидиуретического гормона. Если в норме диурез должен уменьшается в ночное время, то при бодрствовании ночью даже в горизонтальном положении соответствующего уменьшения диуреза не происходит. Выраженная атрофия уротелия, объясняет повышенную чувствительность атрофической слизистой оболочки уретры, треугольника Лието к попаданию даже минимальных количеств мочи, вызывающих клинические проявления указанных нарушений. У женщин самым влиятельным фактором появления нарушений функции нижнего отдела мочевого тракта является снижение уровня эстрогенов в крови. Эстрогены замедляют атрофию в тканях уретры и влагалища, сосудистых сплетениях уретры, а возможно и их иннервации. Кроме того, эстрогены повышают сопротивление к инфекциям со стороны мочевого тракта путем снижения pH, подавления перемещения Е. coli и увеличения количества колоний лактобактерий. У мужчин задержка мочи часто связана с простатитом или ДГП предстательной железы. Частичная обструкция уретры обнаруживается у 20-30% мужчин старше 65 лет и у 11-14% женщин с недержанием мочи. Последующий застой мочи в мочевом пузыре предрасполагает к резкому увеличению инфекций мочевого тракта после 65—70 лет. Клиника атрофического цистоуретрита, сочетание с развитием истинного недержания мочи при напряжении, или смешанного, когда к истинному недержанию мочи при напряжении присоединяется императивный (повелительный) позыв, приводят к недержанию мочи при позыве, или неудержанию мочи. Причиной этих проблем также является потеря мышечного тонуса мочевым пузырем и уретрой. Возрастные изменения мочевого пузыря заключаются, прежде всего, в снижении эластичности мышцы-детрузора и образовании «трабекул», которое проявляется вытягиванием отдельных мышечных пучков на фоне гипотрофических изменений в тонкой мышечной стенке мочевого пузыря у пожилых женщин. Согласно определению Международного общества Удержания мочи (International Continence Society — ICS) под истинным недержанием мочи при напряжении следует понимать «непроизвольную потерю мочи, объективно доказанную и вызывающую социальные или гигиенические проблемы» [Abrams P. et al., 1990]. В большинстве случаев потеря мочи происходит при увеличении внутрибрюшного давления, когда внутрибрюшное давление и давление внутри мочевого пузыря превышают максимальное уретральное давление при отсутствии активного сокращения детрузора. У здоровых женщин максимальное уретральное давление превышает внутрипузырное давление постоянно, за исключением процесса мочеиспускания [Samsioe С., 1998]. В основе истинного недержания мочи при напряжении лежит неполная передача внутрибрюшного давления на проксимальную уретру вследствие ее смещения из интраабдоминальной позиции. Эта дислокация уретровезикального сегмента происходит, в основном, вследствие ослабления связок, обеспечивающих его правильное анатомическое положение. Поддерживающий связочный аппарат состоит из гладкой мускулатуры и соединительной ткани с большим содержанием коллагена. Эти структуры содержат рецепторы к эстрогенам и являются эстроген-чувствительными. Результатом полноценной уретральной поддержки является поднятие проксимальной уретры над тазовым дном, устойчивость ее к увеличению внутрибрюшного давления, возможность компрессии и поддержания удержания мочи. В настоящее время симптомы атрофического цистоуретрита и истинного недержания мочи при напряжении, а также гиперактивного мочевого пузыря, являясь отражением дефицита эстрогенов, рассматриваются как основные «маркеры» БВ и старения. Достоверно показана связь степени тяжести УГР с длительностью постменопаузы (тяжелая степень УГР встречается у женщин старшей возрастной группы с длительностью постменопаузы более 10 лет) и выраженностью дефицита эстрогенов. Нарастающая недостаточность эстрогенов приводит к необратимым возрастным изменениям в структурах урогенитального тракта, что резко снижает качество жизни больных с УГР (при средней степени тяжести УГР на 16%, при тяжелой степени — на 70,5%) [Shumaker F. et al., 1994]. Однако до сих пор единых подходов к их диагностике УГР не выработано. Диагностическая ценность отдельных уродинамических параметров либо постоянно пересматривается, либо подвергается сомнению. Считается, что основным показателем изменения уродинамики у женщин с УГР является снижение максимального уретрального давления. Вместе с тем для выработки правильной тактики лечения пожилых женщин важно понимать, что в основе всех этих процессов лежит возрастной дефицит эстрогенов, приводящий к ухудшению васкуляризации уретры, снижению количества а-адренергических рецепторов и атрофии гладкой и поперечнополосатой мускулатуры уретры. Проявление симптомов атрофического цистоуретрита, и главным образом симптомы поллакиурии и цисталгии, служат частой причиной необоснованного назначения антибактериальной терапии у женщин пожилого возраста, что ведет к усилению атрофических процессов в уротелии и усугублению симптомов поллакиурии, цисталгии, никтурии. В основе данного заблуждения лежит распространенная точка зрения о высокой частоте рецидивирующих урогенитальных инфекций (более 2 инфекций в год) у 10-15% женщин. Однако исследования последних лет показали, что только 4% женщин в возрасте 60 лет страдают рецидивирующей инфекцией мочевых путей, а к 70 годам частота ее возрастает до 11% [Балан В.Е. и соавт., 2002]. Пища, потребляемая человеком, необходима для построения и функционирования его организма. Недостаточность и избыточность питания являются одним из факторов риска преждевременного старения, а целенаправленная коррекция статуса питания одним из основных направлений профилактической медицины в плане увеличения продолжительности жизни. Нарушение питания — состояния, обусловленные изменением потребления пищи или нарушением ее утилизации организмом, что приводит к нарушению функций на субклеточном, клеточном и органном уровнях. В развитии процессов старения важное значение имеют две крайних формы выраженности нарушения питания — ожирение и недостаточность питания. В прежние времена врачам приходилось иметь дело главным образом с последствиями недостаточности питания, теперь их внимания в большей степени требуют проявления переедания. Избыточное питание приводит к ожирению, спутниками которого являются атеросклероз, артериальная гипертензия, ИБС, СД, и к уменьшению продолжительности жизни. По мере старения потребление энергии снижается. В среднем люди старше 70 лет расходуют на 1/3 меньшее количество калорий по сравнению с молодыми. Расходование энергии лицами более старшего возраста (40—74 лет) — почти на 1/3 меньше (2100-2300 ккал в день), чем у людей в возрасте 24-34 лет (2700 ккал в день). У многих пожилых людей расход энергии еще ниже. Примерно 16—18% пожилых людей расходуют менее 1000 калорий ежедневно. Поступающая в виде пищи энергия расходуется на основной обмен, тепловой эффект пищи и жизнедеятельность. Известно, что с возрастом основной обмен снижается, прежде всего, из-за снижения мышечной массы, но другие составляющие остаются относительно постоянными. Физически активные пожилые люди имеют более высокий расход энергии, чем ведущие малоподвижный образ жизни, и таким образом достигают потребления энергии равного или превышающего таковой молодых людей. Низкая физическая активность пожилых людей может быть причиной снижения расхода энергии, но требования к основным пищевым составляющим с возрастом не снижаются. Статус питания оказывает воздействие на продолжительность и качество жизни. Исследования на животных показали, что продолжительность жизни тесно связана со статусом питания. Ограничение калорий, за исключением создания недоедания, приводит к увеличению продолжительностью жизни. В связи с этим ограничение поступления калорий с пищей остается единственным известным способом последовательно замедлить старение у животных. Распространяется ли эта закономерность на людей оценить трудно, т. к. отсутствуют данные продолжительных рандомизированных исследований. Вместе с тем, имеющиеся результаты показывают, что смертность среди лиц с ИМТ на 15-20% меньше средней величины для всего населения ниже. Краткосрочное ограничение поступления калорий оказывает благоприятный эффект на АД, уровень ХС в крови и метаболический гомеостаз. Физиологические потребности людей старше 50 лет в пищевых продуктах существенно отличаются. Эти отличия заключаются в следующем: • энергетические потребности организма снижаются; • увеличивается потребность в белках: ежедневно необходимо получать 1,2—1,5 г высококачественных белков, содержащих незаменимые аминокислоты, на 1 кг массы тела; • весовая доля углеводов в пище должна составлять не более 40%; следует избегать употребления моно- и дисахаридов; • увеличивается потребность в витаминах и минеральных веществах (особенно в кальции). Физиологические основы, объясняющие увеличенную потребность в ряде веществ и микросоставляющих питания, у пожилых людей связаны с рядом особенностей метаболизма и изменением функционального состояния органов и систем. В желудочно-кишечном тракте, начиная уже с 45 лет, снижается желудочная секреция и выделение свободной соляной кислоты. Согласно данным ряда исследователей у 30% людей в возрасте 60— 70 лет и 40% в возрасте 70-80 лет желудочная секреция вообще отсутствует. Дефицит синтеза гастромукопротеинов приводит к дефициту внутреннего фактора Кастла, вырабатываемого париетальными клетками желудка и обеспечивающего всасывание цианкобаламина (витамина В12). Помимо снижения желудочной секреции, у пожилых людей высока распространенность инфицирования Helicobacter pylori и наличия атрофического гастрита. Выявляемость Helicobacter pylori увеличивается с возрастом и у лиц старше 60 лет она составляет более 80%. У более чем 30% людей старше 60 лет обнаруживают серологические маркеры атрофического гастрита. Непосредственной причиной довольно быстрого развития атрофии является выработка аутоантител к обкладочным клеткам и внутреннему фактору. Аутоантитела связываются с обкладочными клетками слизистой оболочки желудка, повреждают функциональные железы и приводят к прогрессирующей атрофии. Антитела к внутреннему фактору блокируют соединение витамина В12 с внутренним фактором и тем самым препятствуют его всасыванию. В силу приведенных причин уровень витамина В12 в организме снижается с возрастом. Причем у 12% пожилых людей дефицит витамина В12 удается обнаружить при исследовании сыворотки крови. У подавляющего большинства остальных пожилых людей имеется метаболический дефицит витамина В12, который можно обнаружить по повышению концентрации метаболитов — метилмалоновой кислоты и гомоцистеина. Эти метаболиты являются чувствительными маркерами дефицита витамина В12 в тканях. Витамин В12 нужен для синтеза ДНК, являясь, по сути, катализатором в этой реакции. Именно каталитические свойства производных витамина В12 приводят к тому, что потребность в нем столь мала, что в процессе синтеза витамин В12 не расходуется, а циклично вступает в реакции как активное вещество. В результате такого цикла из уридин-монофосфата образуется тимидин-монофосфат. При снижении уровня витамина В12 уридин начинает плохо включаться в состав молекулы ДНК, что и приводит к многочисленным нарушениям. Кроме того, витамин В12 участвует в обмене жирных кислот, при его дефиците образуется и накапливается токсичная метилмалоновая кислота, что сопровождается поражением периферической нервной системы. Поэтому даже субоптимальные уровни витамина В12 в крови могут вызывать нервно-психиатрические нарушения без развития мегалобластной анемии. В пожилом и старческом возрасте несколько увеличивается длина кишечника, его стенки претерпевают атрофические изменения, уменьшается количество функционирующих желез и число ворсинок на единицу поверхности слизистой оболочки. В двенадцатиперстной и тощей кишках заметны снижение толщины слизистой оболочки, атрофия мышечного слоя, что приводит к функциональным нарушениям («старческий запор»). По мере старения снижается абсорбционная способность тонкой кишки. В результате резко уменьшается всасывание аминокислот, витаминов, макро- и микроэлементов. Эти нарушения особенно выражены в отношении кальция. Кальций является эссенциальным элементом с ключевой ролью в поддержании массы костной ткани, регуляции нервной возбудимости, мышечном сокращении и гемостазе. Все поступающие с пищей соли кальция лучше растворимы в кислой среде. Нарушение секреции соляной кислоты слизистой оболочкой желудка является одной из причин снижения всасывания кальция в кишечнике. Другой причиной служит снижение с возрастом содержания провитамина D (7- дегидрохолестерола) в коже. Наиболее активной формой витамина D3 является кальцитриол — l,25(OH)2D3, который образуется в митохондриях клеток почек под действием 1-гидроксилазы. Механизм его действия подобен стероидным гормонам. Главная функция кальцитриола состоит в обеспечении всасывания кальция, поступившего с пищей. Снижение содержания 7-дегидрохолестерола в коже, а также уменьшение коркового вещества почек (снижение активности 1-гидроксилазы) при старении сокращают способность организма поддерживать кальциевый гомеостаз и приводят к снижению массы костей (остеопорозу). Определение уровня кальцитриола в сыворотке крови может помочь выявить пожилых людей с риском дефицита кальция. Возрастные изменения в поджелудочной железе начинают регистрировать с возраста 40—45 лет. Активность ферментов поджелудочной железы достигает максимума к 30 годам, а затем постепенно снижается, особенно после 60 лет. К 80 годам масса поджелудочной железы уменьшается на 60%, происходят заметные сосудистые изме-нения. Такая картина наблюдается у 54% пожилых и 84% старых людей. Функциональная недостаточность железы обычно проявляется при стрессовых ситуациях, как, например, диетических излишествах, приеме алкоголя. Хорошим маркером оценки экзокринной функции поджелудочной железы и оценки состояния кишечного пищеварения у пожилых людей является исследование панкреатической эластазы-1 в кале. Референтные величины содержания панкреатической эластазы-1 в кале составляют более 200 мкг/г кала. При развитии недостаточности экзокринной функции поджелудочной железы, что наблюдается при старении, содержание панкреатической эластазы-1 в кале снижается. Исследование эластазы-1 в кале прекрасный маркер для выявления причины нарушения всасывания пищи в организме. Снижение активности панкреатической эластазы-1 в кале выявляется у больных с хроническим панкреатитом, раком поджелудочной железы, ИЗСД (менее 100 мкг/г кала у 30% больных) и ИНСД (менее 100 мкг/г кала у 12% больных), что свидетельствует о недостаточности экзокринной функции поджелудочной железы в данных группах пациентов. Ведущее значение в старении имеют возрастные изменения ЦНС и нейроэндокринной системы, играющих ведущую роль в регуляции обменных процессов и жизненных функций в организме человека. В настоящее время установлена зависимость между степенью развития головного мозга и продолжительностью жизни человека, что определяет роль старения самой нервной системы в качестве ведущего фактора в старении всего организма. Оно проявляется в морфо-функциональных и психологических изменениях, отражающихся на умственной и физической работоспособности, памяти, эмоциях, сложных поведенческих реакциях и других сторонах жизнедеятельности. Для старения ЦНС характерна асинхронность изменений состояния различных структур мозга. Эти изменения нервных клеток коры головного мозга выражены отчетливо на тех ее участках, которые сформировались в эволюции позднее, и менее интенсивны в филогенетически более «старых» участках. При старении возникают количественные и качественные изменения в структурах ЦНС. По мере старения в ткани головного мозга уменьшается число нервных клеток и увеличивается количество глиальных соединительнотканных элементов. Так, на 1 мм2 среза коры мозжечка у людей в возрасте 30-40 лет приходится 825 клеток, 60 лет — в среднем 640—680, 70—100 лет — 400—500 клеток. Подсчитано, что общее число нервных элементов в ткани головного мозга уменьшается на 10-20%, а в некоторых отделах — на 25-35%. Так, к 80 годам у людей число нервных клеток в спинномозговых ганглиях уменьшается на 30%, число нервных волокон в ряде нервов — на 32%. В обонятельном нерве у 16-30-летних людей атрофировано 20% волокон, у 61-75-летних — 68, у 76-91-летних — 73% всех волокон. В коре головного мозга наибольшая убыль нервных клеток отмечается в верхней височной извилине, наименьшая — в постцентральной. К 70 годам кора головного мозга теряет 20%, а к 90 годам — 44—49% своего клеточного состава. У лиц старше 80 лет регистрируют утрату около 85% клеток Беца в обоих полушариях. Но и оставшиеся нейроны не обязательно сохраняют свои нормальные функции. Отмечаются ускоряющиеся изменения в проксимальных дендритах, прогрессирующее уменьшение числа горизонтальных дендритов и дендритных шипиков, и в конечном итоге утрата апикальных стержней в лобной доле, в поверхностных отделах коры височной доли, в прилегающих зонах тенториального участка коры и в зубчатом ядре. Потеря этих элементов имеет наиболее неблагоприятное значение, поскольку они участвуют в модулировании корковой активности. К достижению возраста 80—90 лет масса мозга снижается на 5-10% (например, у мужчин 20-30 лет он равен в среднем 1394 г, а в 90 лет — 1161 г), что, возможно, является одной из причин более частого развития субарахноидальных гематом у пожилых людей, мозг которых имеет больше пространства для смещений. Уменьшение клеточного состава в одной из областей головного мозга вследствие тесной взаимосвязи нейронных структур оказывает существенной влияние на деятельность ЦНС в целом. Согласно данным компьютерной томографии в течение первых 60 лет жизни происходит медленное, но неуклонное увеличение желудочков мозга (вследствие атрофии мозга), и на 8—9-м десятилетиях жизни этот процесс заметно ускоряется. Однако до настоящего время отсутствуют полноценные стандарты для диагностики атрофии мозга и корреляции размеров мозга с его функцией. Компенсация функциональных возможностей ЦНС при старении обеспечивается тем, что наряду с дегенеративно-атрофическими процессами происходит увеличение поверхности нейронов, органел, объема ядер, количества ядрышек, числа контактов между нейронами. Кроме того, помимо гибели части нейронов, отмечается рост глии, что приводит к увеличению соотношения количества глиальных клеток к нервным и благоприятно сказывается на трофике нейрона. По-видимому, мобилизация функциональных механизмов ЦНС и объясняет отсутствие прямой связи между числом погибших нейронов и степенью функциональных изменений в деятельности той или иной структуры мозга. Старение сопровождается увеличением в мозжечке соотношения глиоциты/нейрон с 3,6±0,2 до 5,9±0,4. Активность ацетилхолинтрансферазы к 80 годам уменьшается на 50% по сравнению с 20-летним возрастом. С возрастом снижается и синтез глутаминовой кислоты. Однако наиболее выражены при старении не функциональные изменения в самом мозжечке, а те, что касаются мозжечково-лобных отношений. Это затрудняет или полностью устраняет у пожилых людей возможности взаимокомпенсации функциональных нарушений одной из этих структур. В лимбической системе головного мозга при старении снижается общее число нейронов, а в сохранившихся нейронах увеличивается количество липофусцина, ухудшаются межклеточные контакты Астролгия разрастается, значительно снижается на нейронах количество аксоматических и аксодендрических синапсов, уменьшается шипиковый аппарат. При повреждении тканей мозга реиннервация клеток в пожилом возрасте идет медленно. Возрастные изменения медиаторного обмена наиболее выражены в лимбической системе. Длительность циркуляции возбуждения по структурам лимбической системы с возрастом уменьшается. Все это сказывается на кратковременной памяти и формировании следов долговременной памяти, на поведении, мотивации и эмоциях. После 60 лет возникают дисфункции стриопаллидарной системы головного мозга, что вызывает различные двигательные нарушения, амнезии, вегетативные расстройства, сопровождающиеся гиперкинезами, тремором, гипомимией. Причиной таких нарушений являются 2 процесса: морфологический и функциональный. При старении объем стриопаллидарных ядер снижается. Количество интернейронов в неостриатуме становится меньше. Вследствие этих морфологических изменений, а также изменения медиаторного обмена и рецепторных процессов, нарушаются функциональные связи стриарных систем через таламус с экстрапирамидной корой. Стриарные ядра имеют отношение к синтезу дофамина, одного из медиаторов обладающего тормозящим действием. При старении накопление дофамина в стриарных образованиях уменьшается. Старение приводит к нарушениям регуляции со стороны стрипаллидума тонких, точных движений конечностей, в частности пальцев рук, нарушениям мышечной силы, к невозможности длительного сохранения высокого тонуса мышц. Важнейшая роль в поддержании гомеостаза и обеспечении функциональных резервов организма принадлежит гипоталамо-гипофизарной системе. Изменения в данной системе при старении имеют настолько важное практическое значение, что служат базисной основой для разработки многих программ профилактики старения. (эндокринной системы?) Ствол мозга является филогенетически более старой структурой ЦНС, поэтому в возрастном аспекте он наиболее стабилен: количество нейронов в нем уменьшается незначительно. При старении существенно изменяются функции спинного мозга, в основном вследствие снижения его кровоснабжения. В первую очередь возрастные изменения затрагивают длинно-аксонные нейроны спинного мозга. К 70 годам число аксонов в корешках спинного мозга уменьшается на 30%, в нейронах накапливается липофусцин, появляются различного рода включения, падает активность ацетилхолинтрансферазы, нарушается трансмембранный транспорт К+ и Na+, включение аминокислот в нейроны затрудняется, содержание РНК в нейронах уменьшается (особенно после 60 лет). В этом же возрасте замедляется аксоплазматический ток белков, аминокислот. Все эти изменения лежат в основе снижения лабильности нейрона, уменьшения в 3 раза частоты генерируемых импульсов, увеличения длительности потенциала действия. Моносинаптические рефлексы спинного мозга с латентными периодами 1,05 мс в молодом возрасте составляют 1%, к старости латентный период этих рефлексов удлиняется вдвое. Такое удлинение времени рефлексов обусловлено замедлением образования и выброса медиатора в синапсах данных рефлекторных дуг. В полисинаптической рефлекторной дуге спинного мозга время реакции увеличивается за счет замедления медиаторных процессов в синапсах. Указанные изменения в синаптической передаче приводят к снижению силы сухожильных рефлексов, увеличению их латентного периода. У лиц 80 лет и старше резко снижается или даже исчезает ахиллов рефлекс. Например, латентный период ахиллова рефлекса у молодых лиц составляет 30—32 мс, а у стариков — 40—41 мс. Такие изменения характерны и для других рефлексов, что проявляется замедлением моторных реакций у старых людей. Приведенные данные не только существенно расширяют наши представления о механизмах старения, но и показывают важность понимания возрастных изменений в других («не основных») системах гомеостаза для определения БВ человека и составления программы предупреждения старения и его коррекции. Во многом эти изменения являются следствием возрастных нарушений в основных системах гомеостаза. Однако часть из них участвует первоначально в реализации программы развития организма, а по ее завершении, служит непосредственным механизмом трансформации этой программы в механизм формирования старения и сцепленных с ним главных болезней. Жизнь — единство трех потоков: потока материи, потока энергии и потока информации. По мере старения регистрируется прогрессирующее ослабление потока информации, реализуемого сложными механизмами регуляции. В старости нервная система работает в более низком частотном спектре передачи информации; падает пропускная возможность системы воспринимать, перерабатывать и передавать информацию; сужается диапазон возможной перекодировки информации; снижается способность системы быстро переходить с одного режима работы на другой; уменьшается способность длительно поддерживать определенный ритм воспроизведения информации и подвижность нервных процессов. В общем, эти изменения можно определить как нарастание дефицита информации по мере старения. Еще И.П. Павлов показал, что при старении раньше других в нервных центрах страдают тормозящие процессы (они охраняют нервные центры от истощения и стимулируют восстановление). В дальнейшем удалось установить, что при старении изменения тормозящих процессов регистрируется на разных уровнях ЦНС и вегетативной нервной системы. Ослабление этих процессов в подкорковых центрах, в коре головного мозга отражается на эмоциональной сфере, психике пожилого человека. Аналогичные сдвига в высших вегетативных центрах приводят к тому, что многие вегетативные реакции приобретают в старости застойный, затяжной характер. Страдает и возбудительный процесс; ограничивается возможность воспроизводить частые ритмы, удлиняется время возврата к исходному состоянию, снижается работоспособность и др. Во многих нейронах уменьшается амплитуда, растет длительность потенциала действия. По мере старения изменяется и взаимоотношение возбуждения и торможения с процессами утомления и восстановления. С возрастом ослабляется активирующее влияние торможения на течение восстановительных процессов, что ограничивает работоспособность нервных центров, способствует более быстрому развитию утомления. В связи с ослаблением внутреннего торможения могут не подавляться в должной мере возникающие эмоции, человек в старости нередко становится вспыльчивым, неадекватно эмоционально реагирующим на какое-либо незначительное событие. Безусловно, все эти изменения являются следствием нарушения синтеза различных нейромедиаторов и изменения порога чувствительности структур ЦНС к регуляторным воздействиям по мере старения. Дата добавления: 2015-11-28 | Просмотры: 1525 | Нарушение авторских прав |